Volume 29, No.4 Pages 298 - 301
1. 最近の研究から/FROM LATEST RESEARCH
SACLA BL1における生きた哺乳類細胞の軟X線FELシングルショット観察
Synchrotron X-ray microvascular imaging to visualize microcoronary artery function in mice
[1]東京大学 先端科学技術研究センター Research center for advanced science and technology, The university of Tokyo、[2](国)理化学研究所 放射光科学研究センター RIKEN, SPring-8 Center、[3]東京大学 物性研究所 The Institute for solid state physics, The university of Tokyo
- Abstract
- 水の窓軟X線顕微鏡は、水と炭素の吸収コントラストにより細胞を高コントラストにラベルフリー観察できる。しかし、その生細胞への応用は、細胞への放射線障害の問題により制限されてきた。我々は、放射線による細胞障害を無視できる、フェムト秒パルスによるシングルショット撮像が可能な、軟X線自由電子レーザーによる軟X線顕微鏡を開発した。さらに、照明・結像光学系に大視野かつ長作動距離、軟X線自由電子レーザーの照射に耐えるウォルターミラーを利用することで、培養液中の生きた哺乳類細胞の観察を可能とした。観察された生細胞像は、化学固定細胞とは大きく異なる構造を示していた。
1. はじめに
炭素と酸素の吸収端に挟まれる水窓領域(280-530 eV)の軟X線を利用すると、水中での生細胞の内部構造を高空間分解能・高コントラストにラベルフリー観察できる。そのため、軟X線による生細胞の観察は1990年代より試みられてきた。しかし、軟X線は細胞に放射線障害を与え、細胞構造を破壊してしまうことが知られている。そのため現在ほとんどの軟X線細胞観察の研究で、パラホルムアルデヒドなどで化学固定された細胞試料の観察が行われている[1, 2][1] D. Y. Parkinson, et al.: J. Struct. Biol. 162 (2008) 380-386.
[2] K. L. White, et al.: Sci. Adv. 6 (2020) 1-13.。一方で、固定プロセスにより細胞の微細構造や細胞内元素が喪失するため、生きた細胞を放射線障害を回避して観察する手法が求められてきた。
軟X線自由電子レーザー(SXFEL)は非常に明るい超短パルス性の軟X線光源である。SXFELはパルス幅フェムト秒オーダーの超短パルス光源であるため、SXFELを照明光源に用いた顕微鏡ではシングルショット撮像において細胞構造が破壊されるより前に露光が終了し、放射線障害による細胞構造の変化を無視できる[3][3] H. N. Chapman, et al.: Nat. Phys. 2 (2006) 839-843.。XFELとコヒーレント回折法を利用した生きたウイルス[4][4] M. M. Seibert, et al.: Nature 470 (2011) 78-81.や細菌[5, 6][5] T. Kimura, et al.: Nat. Commun. 5 (2014) 1-7.
[6] G. Van Der Schot, et al.: Nat. Commun. 6 (2015) 1-9.の観察が行われている。しかし、それらに比べて大きな哺乳類細胞の観察はコヒーレント回折法では困難であった。一方で、広く用いられる軟X線結像素子フレネルゾーンプレートは入射熱の影響を受けやすくSXFELの照射に耐えない。哺乳類細胞の研究は医療や薬理の研究に役立つ点で重要であり、ダメージフリー・ラベルフリーの観察手法の開発が望まれてきた。
SXFELを用いた哺乳類細胞の観察を可能にするために、我々はSACLAの軟X線自由電子レーザービームライン(BL1)[7][7] S. Owada, et al.: J. Synchrotron Radiat. 25 (2018) 282-288.にてウォルターミラーを照明・結像光学系に用いた顕微鏡を開発した[8][8] S. Egawa, et al.: Opt. Express 27 (2019) 33889.。ウォルターミラーは回転体形状を持つ斜入射反射型結像素子である。楕円面と双曲面の二面構成となっているため、球面収差が無い上にアッベの正弦条件が概ね満足されてコマ収差が小さい。斜入射反射型なので受光面積が広く、反射効率も良いため強力な軟X線の照射による熱負荷に耐える他、作動距離が長く、色収差が無視できる。長い作動距離は培養液を含む厚い試料ホルダーの使用を可能にし、色収差が無いことにより分光イメージングが容易になる。本稿ではSACLAにおける顕微鏡開発と生きた哺乳類細胞の観察結果[9][9] S. Egawa, et al.: Optica 11 (2024) 736-743.を紹介する。
2. 超短パルス軟X線顕微鏡の開発
SACLA BL1に構築された軟X線透過顕微鏡の模式図を図1に示す。SXFELの三次高調波として生成された水の窓軟X線を利用した。典型的なパルス幅は約30フェムト秒である[10][10] S. Owada, et al.: J. Synchrotron Radiat. 27 (2020) 1362-1365.。コンデンサーウォルターミラー(CWM)の入射開口での推定パルスエネルギーは約100ナノジュールである。入射ビームは常設のKirkpatrick-Baezミラー(KBミラー)とCWMに順次反射され、試料を照射する。結像用ウォルターミラー(OWM)は、倍率255で透過画像を裏面照射型CCD上に形成する。視野は52 × 52 µm²である。生細胞は培養液とともに真空密封された液体セルホルダーに配置されている(図1の挿入図参照)。液体セルホルダーは、二枚の窒化ケイ素膜チップ、Oリング、ハウジング、4.5 um厚のギャップスペーサー(シリカマイクロロッド)から構成されており、窒化ケイ素膜チップを通して培養液中の細胞を観察できる。イメージングシステムには可視光照明が備わっており、可視光透過イメージングを用いて試料の位置決めができる。
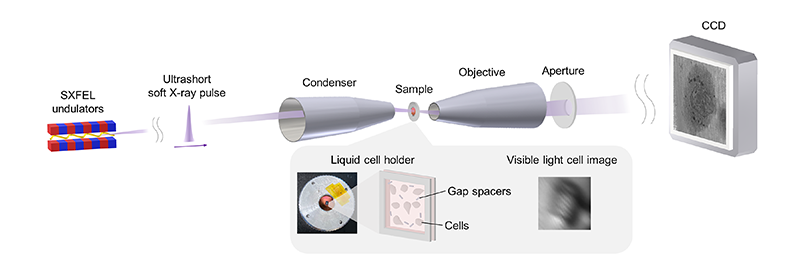
図1 超短パルス軟X線顕微鏡の模式図。引用9より転載。©2024 Optica Publishing Group.
軟X線透過顕微鏡では、強い吸収コントラストにより軽元素の分布を可視化できる。炭素の顕著な吸収と、タンパク質、脂質、核酸などの生体分子に結合している窒素と酸素の存在量の少なさを考慮すると、得られる画像は概ね細胞内の炭素分布を可視化していると解釈できる。
3. 哺乳類細胞の軟X線炭素分布観察
細胞と培養液を封入した液体セルホルダーを準備し、37°Cに維持された試料ホルダーに取り付けた。観察対象に選んだのはチャイニーズハムスター卵巣がん細胞株由来細胞(CHO-K1)である。培養液は熱不活化ウシ胎児血清10%を添加したHam's F-12培地である。光子エネルギー390 eVにて、SXFELパルスシングルショット露光で細胞の画像を取得した(図2AおよびC)。細胞質と核の境界に認められる、核膜構造(図2C矢印1)が観察された。また、核の中心には大きな暗領域(図2C矢印2)が見られ、おそらく核小体と言われている細胞内小器官で、一般に明視野顕微鏡でも観察される部位である。核小体ではリボゾームサブユニット合成、細胞分裂、ストレス対応を担っていることが知られている。そのため、多くの炭素を有する生体分子が集中するのも矛盾はない。興味深いのは、その中心から核膜に向かって複数の線状の構造が延びている(図2C)。このような線状構造は、観察した細胞の約36%(74細胞中27細胞)で確認された。この線状構造は明視野顕微鏡では認められない所見である。また、細胞質内には複数の暗いスポット(<1 µm)が見られることがあった(図2Aの右側)。シングルショット像の参考として、直後に15ショット(総露光時間: 250ミリ秒)で撮影した細胞像を示す(図2BおよびD)。マルチショット像は、長時間の露光により細胞の動きが影響し、ぼやけて見えている可能性があるが(図2D)、シングルショットとマルチショットの両方で観察された構造は長時間存在した構造と考えられる。代表的な核の構造を比較したところ、x-xで示されたギャップ(図2CおよびD)は両方の画像で確認でき、ノイズによる誤認ではなく、ノイズではない本物の構造であることが示唆される。このギャップの幅は約310 nmであり、十分な照射でのテストチャート観察により測定された本顕微鏡の空間分解能230 nmに匹敵する。一方で、いくつかの顕著な違いも見られた。例えば、暗いスポット領域(図2Cの破線円の矢印3)が薄くなり、別の暗領域(図2C矢印4)がマルチショット画像(図2D)でより顕著になった。これらの違いが細胞の生理的動きによるものか、あるいは複数回の軟X線照射による放射線障害によるものかは不明である。
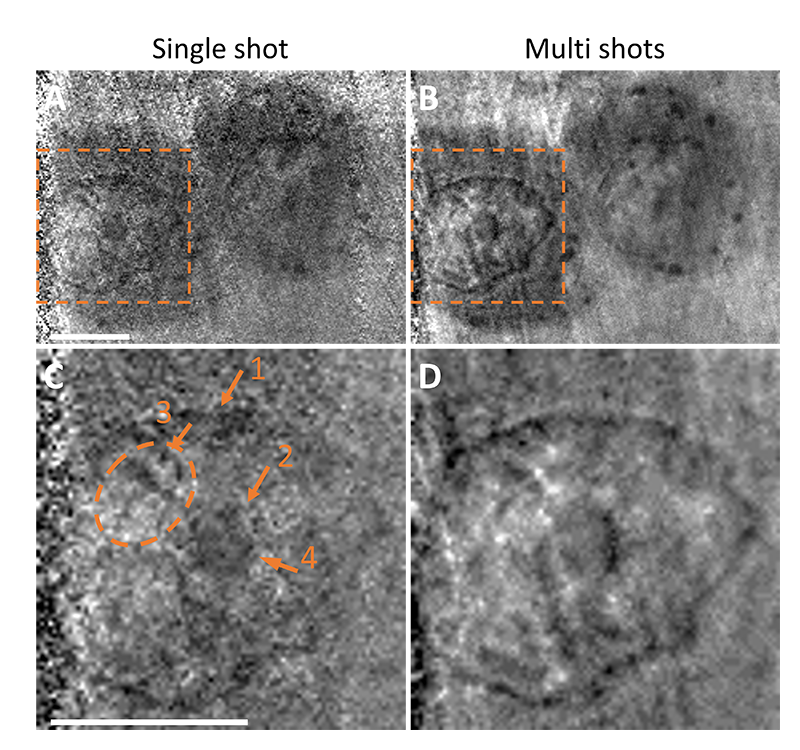
図2 培養液中の哺乳類細胞の(A)シングルショット像と(B)マルチショット像、(C、D)(A)、(B)の矩形枠部の拡大図、1:核膜、2:核小体、3、4:CとDで顕著に変化した箇所.光子エネルギー390 eV、スケールバー:5 μm。引用9より編集の上転載。©2024 Optica Publishing Group.
次に、光子エネルギー300 eVで取得した細胞像を図3に示す。300 eV、390 eVともに水の窓領域内にあるが、300 eVは炭素吸収端(約280 eV)近傍に位置するため、有機物をより高感度に捉えられる。細胞質と核の両方の構造が高いコントラストで明瞭に見える。核の中央には大きな暗領域と核膜が顕著に見られ、多くの1 µm以下の構造の存在が示唆される(図3C)。マルチショット像でも、核の中央にある大きな暗領域と核膜の存在が確認された(図3B)。ただし、マルチショット像はおそらく細胞の動きによってぼやけている(図3D)。図4にパラホルムアルデヒド固定・乾燥したCHO-K1の軟X線像を示す。核内の構造が不明瞭である点と、明るい空胞状の構造が細胞質中に多数見られる点で、培養液中の生きた細胞とは大きく異なる見え方となっている。
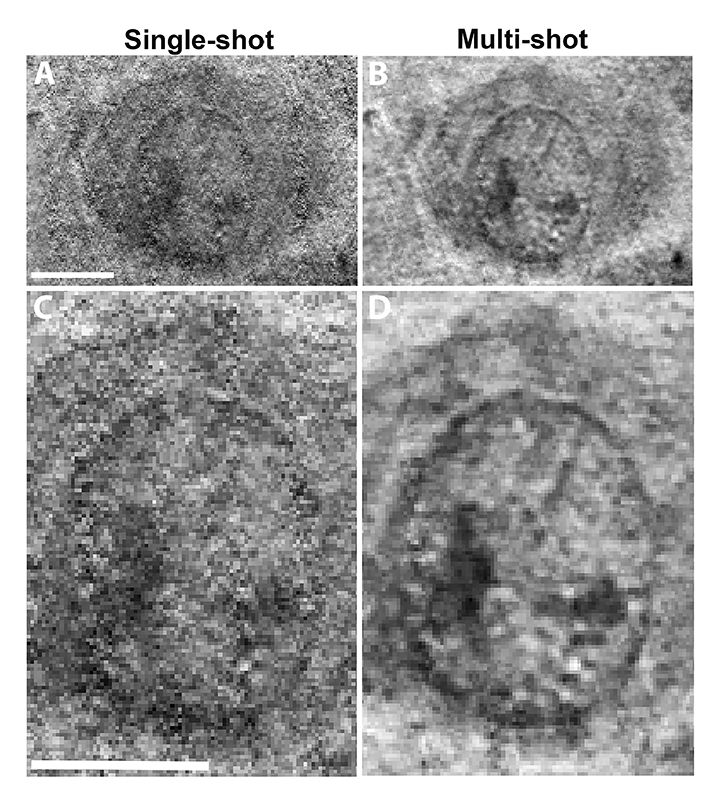
図3 培養液中の哺乳類細胞の(A)シングルショット像と(B)マルチショット像、(C、D)拡大図。光子エネルギー300 eV、スケールバー:5 μm、引用9より転載。©2024 Optica Publishing Group.
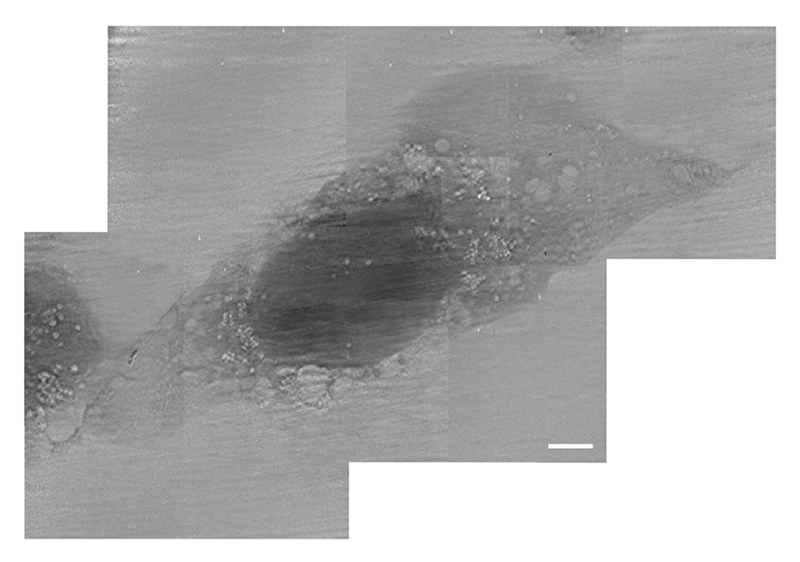
図4 パラホルムアルデヒド固定された細胞の軟X線像、スケールバー:5 μm、引用9より転載。©2024 Optica Publishing Group.
4. タイムラプス軟X線撮影による哺乳類細胞の放射線障害の評価
細胞の軟X線像を繰り返し取得することで、培養液中の生きた細胞への放射線障害の影響を評価した。図5A-Eには、13秒ごとに光子エネルギー300 eV、100ショット露光で観察された一連の細胞像からの抜粋を示している。露光が蓄積するにつれて、細胞質、核、さらには細胞の周囲にもやが明瞭に現れた。細胞、核、そして核小体様の構造の面積が縮小している。図5Fには細胞体と細胞核の面積の推移を示す。これは細胞の体積が縮小したのではなく、細胞付着が弱まって丸まったためかもしれない。なお、タイムラプス撮影は細胞と少量の培養液を液体セルホルダーに入れてから6時間後に10分間にわたって行っている。放射線障害ではなく、培養液のpHなど細胞環境の変化による細胞の形態変化が観察された可能性もある。今後、培養液の還流システムなど整った細胞環境を用意して、放射線障害の影響をより厳密に調べる必要がある。
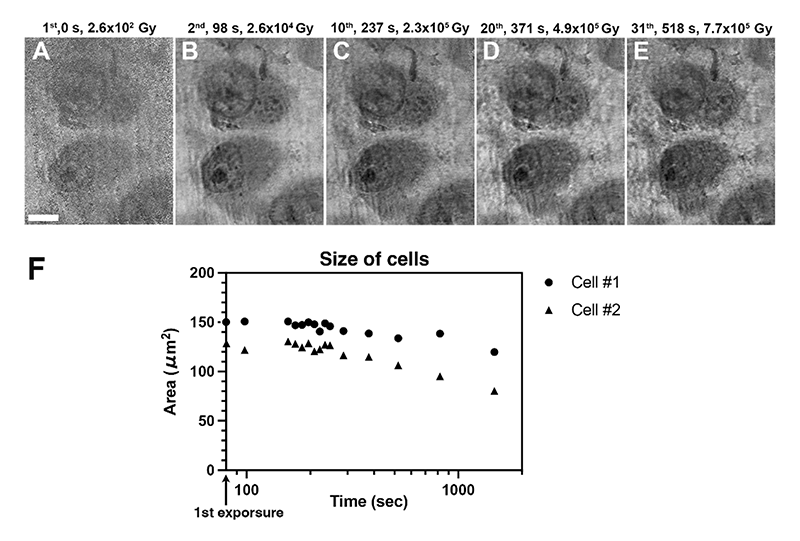
図5 培養液中の細胞のタイムラプス軟X線撮影。(A-E)タイムラプス像の抜粋、(F)細胞の面積の推移、スケールバー:5 μm、引用9より転載。©2024 Optica Publishing Group.
5. まとめと展望
水の窓軟X線の利用により、培養液中の生きた哺乳類細胞内の炭素分布を明瞭に観察することができた。水の窓軟X線顕微鏡による生きた細胞の観察はかつて期待を集めたが、放射線障害と光源の暗さのために断念されていた。SXFELを始めとする光学系の進歩により、放射線障害を無視して、高クオリティの像の撮影が可能となった。観察した細胞は化学固定細胞とは明確に異なる構造を示しており、化学固定細胞により細胞構造が変化することが示唆された。X線顕微鏡や電子顕微鏡では固定細胞の観察がスタンダードとなっているが、固定プロセスが細胞構造に与える影響は示唆されつつあり、凍結法が主流になりつつある。しかし、生細胞観察に越したことはなく、凍結法とは時系列的な情報量が異なる。
タイムラプス撮影の結果、SXFELによる放射線障害により細胞構造が直ちに崩壊するわけではないことがわかった。短時間であれば放射線障害の影響を無視して細胞の生理活動のトラッキングができる可能性もある。また、波長可変なSXFELと色収差のないウォルターミラーの特性を生かした分光イメージングにより、細胞内の元素分布測定への発展が期待できる。引き続き光学系開発と観察を進め、生きた哺乳類細胞の姿を究明したい。
謝辞
本研究はSACLA BL1にてSACLA利用研究課題2021A8030、2021B8042、2022B8030として行われました。本研究開発は、SACLA/SPring-8基盤開発プログラムから多大な支援を受け、理化学研究所の大和田成起博士、山口豪太博士、矢橋牧名博士、東京大学の櫻井快さん、竹尾陽子博士、吉永享太さん、SACLAエンジニアリングチームの方々をはじめ多くの研究者と共同で推進されてきたものです。共同研究者の方々にこの場を借りて深く感謝申し上げます。
参考文献
[1] D. Y. Parkinson, et al.: J. Struct. Biol. 162 (2008) 380-386.
[2] K. L. White, et al.: Sci. Adv. 6 (2020) 1-13.
[3] H. N. Chapman, et al.: Nat. Phys. 2 (2006) 839-843.
[4] M. M. Seibert, et al.: Nature 470 (2011) 78-81.
[5] T. Kimura, et al.: Nat. Commun. 5 (2014) 1-7.
[6] G. Van Der Schot, et al.: Nat. Commun. 6 (2015) 1-9.
[7] S. Owada, et al.: J. Synchrotron Radiat. 25 (2018) 282-288.
[8] S. Egawa, et al.: Opt. Express 27 (2019) 33889.
[9] S. Egawa, et al.: Optica 11 (2024) 736-743.
[10] S. Owada, et al.: J. Synchrotron Radiat. 27 (2020) 1362-1365.
東京大学 先端科学技術研究センター
〒153-8904 東京都目黒区駒場4-6-1
TEL : 03-5452-5187
e-mail : satoru-egawa@g.ecc.u-tokyo.ac.jp
(国)理化学研究所 放射光科学研究センター
〒679-5148 兵庫県佐用郡佐用町光都1-1-1
e-mail : mshimura@ri.ncgm.go.jp
東京大学 物性研究所
〒277-0882 千葉県柏市柏の葉5-1-5
e-mail : tkimura@issp.u-tokyo.ac.jp








