Volume 29, No.4 Pages 282 - 286
1. 最近の研究から/FROM LATEST RESEARCH
(13th SPRUC Young Scientist Award 受賞 研究報告)
Two-way approach for sub-atomic molecular structure visualization with X-ray and electron crystallography
ウィーン大学 Department of Inorganic Chemistry, Faculty of Chemistry, University of Vienna
- Abstract
- 結晶回折測定で決定される3次元分子構造は通常原子座標として表現される。X線回折には本質的に試料の電子分布情報が含まれるが、価電子構造を実験的に特徴づけるには、原子分解能を超える高い測定・解析精度が要求される。測定試料から良質な回折像が得られるのであれば、タンパク質のような高分子中でも電子分布を実験的に特徴づけることができる。一方、低分子化合物であっても、小さな結晶しか得られず原子座標決定さえ困難が伴うケースは頻発する。このような高難度試料から最大限に構造情報を引き出すためには、放射光を含め線源・線種を適切に活用することが期待される。
著者らは最近、電子顕微鏡とX線自由電子レーザーをそれぞれ利用した微小結晶構造解析を行い、2つの手法によって有機化合物構造がどのように可視化されるか検証した。水素原子の可視化位置や原子電荷への感度はそれぞれの散乱特性が特徴的に反映される。サブ原子分解能の描像を得たことで、これらの差異を実験的に区別することができた。本稿は量子ビームを利用した、高難度試料の精密構造情報へアクセス可能にする取り組みを紹介する。
1. はじめに - 結晶構造解析のターゲットと分解能 -
分子の3次元構造を知りたいとき、量子ビームと結晶試料を用いた回折測定を行うことで構成原子の座標情報が得られる。最もよく利用される線種はX線であり、X線回折は原理上、試料の電子分布を反映している。もし高次にわたる回折斑点まで精確な計測値が得られたならば、孤立原子の相対配置としての構造に留まらず、各原子間で相互作用する価電子分布まで解像対象になる。X線の輝度、光子エネルギー、ビーム形状、あるいは検出器等の装置パラメータによって計測の質は左右される。結晶構造解析に放射光が利用される目的のひとつはこのような高精度・高分解能測定である。
試料がタンパク質等の生体高分子結晶の場合も、実験室系のX線回折計では得られない高分解能測定が放射光利用の主目的となる。ただし原子分解能を超えることは稀で、実際にこれまで報告されている生体分子結晶構造の88%は1.5 Å未満の分解能で決定されている(図1)[1][1] https://www.wwpdb.org/。化合物結晶構造データベース[2][2] https://www.ccdc.cam.ac.uk/では、登録構造の質を評価するために0.85 Å分解能が基準値として設定されているが[3][3] https://checkcif.iucr.org/, *C-Alert、タンパク質構造でこれを超えるものは0.4%である。このような高分解能構造解析が達成されたとき、結合長や結合角の微細な変化や、上述のような価電子分布の描像も含めた構造評価が検討できるようになる。
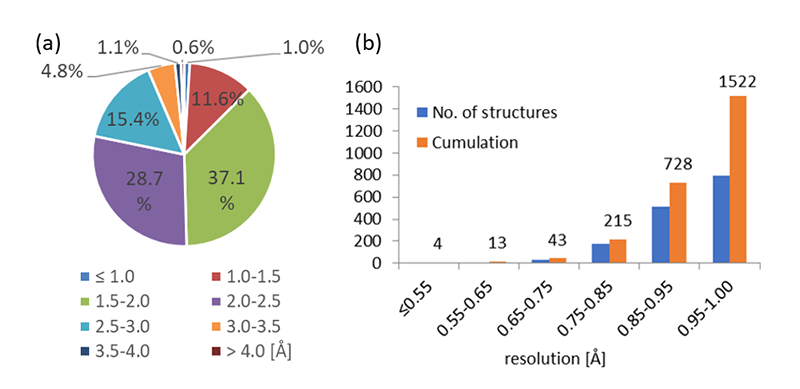
図1 生体高分子構造データベース[1]https://www.wwpdb.org/における空間分解能。(a)全結晶構造における分布割合、(b)分解能1 Å以上に限定した分解能ごと、および累積の構造数。
著者はこのような原子分解能以上での結晶構造解析を行うため、方法論の開拓と改良に取り組んでいる。本稿ではSPring-8、SACLAに加えて電子顕微鏡も用いたこれまでの成果について、課題と展望を含めて紹介する。
2. SPring-8を利用した高分解能タンパク質結晶構造解析
序節で述べた通り、タンパク質結晶が対象でも化合物解析に匹敵する分解能を得た例は少数ながら報告されている。著者らの行った緑色蛍光タンパク質(GFP)の解析はその一例である[4][4] K. Takaba et al.: IUCrJ 6 (2019) 387-400.。GFPはその広い応用拡張性から、実験構造解析、計算化学解析ともに多数の研究報告がなされており、高分解能解析によって新たに得られる知見を比較評価するうえで最適と考えられた。通常分解能での結晶構造は1996年に分解能1.9 Åで報告され[5][5] M. Ormö et al.: Science 273 (1996) 1392-1395.、天然アミノ酸のみからなる分子内環化反応によって形成された発色団が蛍光機能を担うことが明らかにされていた。著者らは発色団に構造多型を持たない既知変異体を利用してmmオーダーの良質の結晶を調製し、SPring-8 BL41XUにおいて回折測定を行った。35 keVの高エネルギーX線およびその高感度検出を可能にしたCdTe検出器(PILATUS 3X CdTe 300K, Dectris)によって0.78 Å分解能の回折データセットが収集された。価電子分布を取り込んだ多極子構造モデル[6][6] N. K. Hansen and P. Coppens: Acta Cryst. A34 (1978) 909-921.とそれに基づくトポロジー解析[7][7] R. F. W. Bader: Atoms in Molecules: A Quantum Theory. Oxford University Press (1990).の結果、GFP発色団の持つ負電荷がフェノール部位とイミダゾリノン部位の両方に分散しつつも、わずかにフェノール側に偏っていることが明らかになった(図2)。結合長の参照可能ないくつかの計算化学研究と比較すると、多くの報告ではイミダゾリノンに負電荷が集中するモデルを導出していた(図2b)。著者らは量子計算モデルでいくつかの相互作用が過大・過小に評価されている可能性や、そもそも構造最適化のベースが低分解能の結晶構造であること等を指摘したが、比較条件が完全に整っているわけではなく、蛍光活性を発現する真の構造的特徴の解明にはさらなる実験的・理論的分析と議論が必要である。
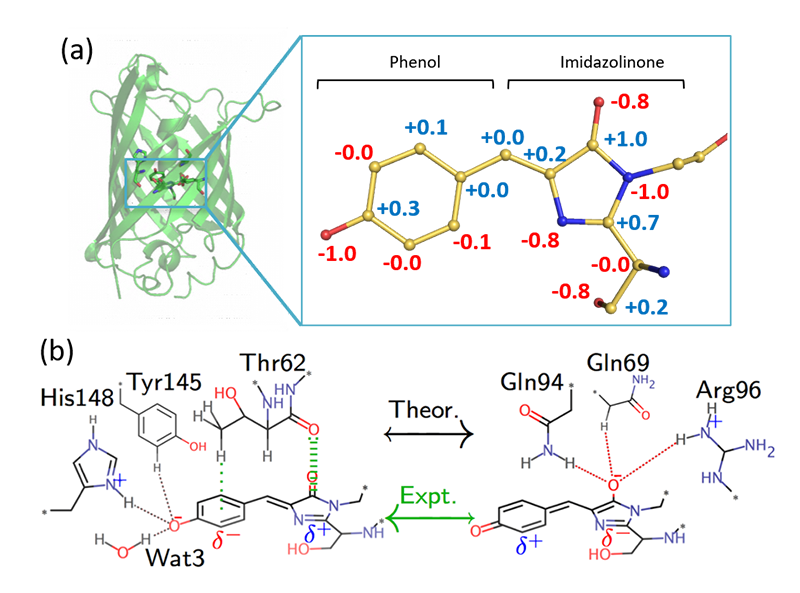
図2 GFP発色団における電荷分布。(a)高分解能X線回折データをもとに決定した発色団の原子電荷、(b)決定した高分解能構造および先行理論から推定される共鳴構造。実験構造では発色団全体での電荷の偏りは小さく、フェノール側にやや負電荷が偏ることを示唆した。文献4より改変。
3. 電子顕微鏡による微小結晶学
本例のように、放射光を利用することでタンパク質のような生体高分子でも精密な原子座標情報、および電荷密度解析を行うことができる。しかし試料結晶が高い回折能を示すことが前提であり、現状ではごく一部の生体高分子にのみ適用可能である。一方で化合物試料の場合、数百μmの良質な結晶を得ることは生体高分子ほど困難ではない。しかし分子デザインが複雑化・多様化するに従って、化合物であっても結晶成長が難しく、良好な回折像が得られないケースが散見される。2010年頃より、電子顕微鏡を利用した3次元結晶構造解析、3D electron diffraction(3D ED)の事例が報告されはじめた[8-10][8] D. Zhang, P. Oleynikov, S. Hovmöller and X. Zou: Z. Krist. 225 (2010) 94-102.
[9] K. Yonekura, K. Kato, M. Ogasawara, M. Tomita and C. Toyoshima: Proc. Natl. Acad. Sci. USA 112 (2015) 3368-3373.
[10] T. Gruene et al.: Angew. Chem. Int. Ed. 57 (2018) 16313-16317.。電子線はX線よりも4-5桁大きな散乱断面積を持つため[11][11] R. Henderson: Q. Rev. Biophys. 28 (1995) 171-193.、1 μm以下の微小結晶でも良好な回折像を与え、構造決定に利用できる。著者は2019年より電子顕微鏡と検出器の効率的な運用による3D EDの拡張に参画してきた。3D EDは生体高分子結晶にも適用可能であるが、新規構造の決定方法が確立されていないこと等の背景から、現状では化合物解析への適用例が多く報告されている。著者らはこれまで、結晶成長しにくい薬剤化合物や薄層性の材料化合物等をターゲットに手法改良に取り組んできた[12-14][12] K. Takaba, S. Maki-Yonekura and K. Yonekura: J. Struc. Biol. 211 (2020) 107569.
[13] K. Takaba, S. Maki-Yonekura, S. Inoue, T. Hasegawa and K. Yonekura: Front. Mol. Biosci. 7 (2021) No. 612226.
[14] 高場圭章: 日本結晶学会誌 64 (2022) 115-116.。化合物の場合はX線による解析同様、原子分解能(1 Å)前後の回折斑点まで測定することで新規構造決定が可能である。電子線による構造解析に対するもう1つの期待は、散乱過程を考慮して価電子の情報を感度良く抽出することである。これは第5節で述べる。
4. XFELによる微小結晶学と化合物解析への適用
同じく2010年代、X線自由電子レーザー(XFEL)を用いたタンパク質結晶構造解析が報告されはじめた。XFELのパルス光は露光による試料損傷の進行よりも短い時間スケールで回折を発生させると考えられており[15][15] S. Boutet et al.: Science 337 (2012) 362-364.、高輝度X線を減衰なく試料に照射することができる。そのため連続光での測定よりも小さな結晶が構造解析のターゲットとなる。この背景に基づくと、上述の散乱断面積の差を埋め合わせ、3D EDに使用されるものと同等の結晶サイズでのX線構造解析が期待できる。パルス光の照射で得られる回折像は結晶の回転を伴わない静止写真として測定され、1フレーム毎に格子定数と結晶方位を決めて積分処理するシリアルX線結晶構造解析(Serial X-ray Crystallography, SX)となる。このためフレームあたりの回折斑点数が少なくなる低分子結晶では不利とされ[16, 17][16] A. S. Brewster et al.: Acta Crystallogr., Sect. D: Biol. Crystallogr. 71 (2015) 357-366.
[17] C. Dejoie et al.: IUCrJ 2 (2015) 361-370.、専ら生体高分子での構造解析が進められてきた。すなわち序節で述べた通り、決定された構造の多くは分解能1.5 Å未満である(図3)。著者らは3D EDと相補することを念頭に、2020年頃よりXFELによる低分子化合物の構造決定を試みてきた。SACLA BL2およびBL3に構築された固定型の試料供給システムと15 keVの高エネルギーパルス光を用いることで、0.82 Å分解能までの回折斑点を測定することができる。3D ED測定に用いたものと同等の微結晶を対象に、新規構造を含む複数の化合物構造を決定した[18-20][18] K. Takaba and S. Maki-Yonekura et al.: Nat. Chem. 15 (2023) 848-855.
[19] K. Takaba and S. Maki-Yonekura et al.: J. Am. Chem. Soc. 146 (2024) 5872-5882.
[20] 高場圭章、眞木さおり、米倉功治: 放射光 37 (2024) in press.。2022年以降LCLS[21, 22][21] E. A. Schriber et al.: Nature 601 (2022) 360-365.
[22] M. Aleksich et al.: J. Am. Chem. Soc. 145 (2023) 17042-17055.、European XFEL[22][22] M. Aleksich et al.: J. Am. Chem. Soc. 145 (2023) 17042-17055.、PAL[23][23] J. Kang et al.: Nat. Chem. 16 (2024) 693-699.からも同様に化合物結晶の解析例が報告されており、XFEL結晶解析の新たな広がりが期待できる。
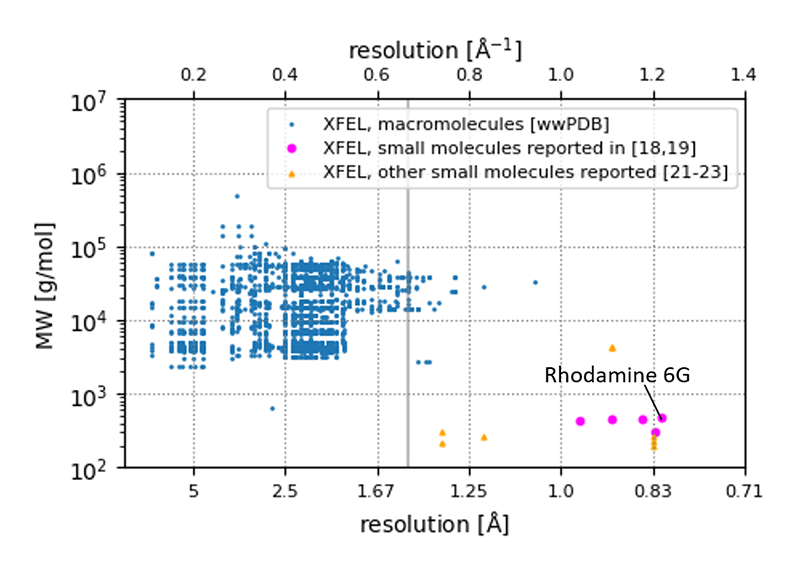
図3 XFELを利用して決定された結晶構造における分解能と分子量の関係。各データは文献1、18-19、21-23より抽出したもの。中央の縦線は分解能1.5 Åを示す。文献20より改変。
5. 異なる線種によって得られるサブ原子分解能情報
このように、良質の結晶が得られなくとも、電子線やXFELを活用することで数μm以下の結晶を用いた構造解析が可能になりつつある。ただ異なるプローブを用いたとしても、試料中の原子座標が決定的に異なることはない。これは各原子の核電荷の寄与が電子散乱に、内殻電子の寄与がX線散乱にそれぞれ支配的であり、分子内でも両者の重心位置がほぼ同一であることから説明できる。しかし水素原子の場合は価電子が散乱に寄与することになり、電子線とX線はやや異なる描像を与える。このことは構造モデルを構築する上で既に知られていることであるが[24-26][24] L. Palatinus et al.: Science 355 (2017) 166-169.
[25] M. T. B. Clabbers, T. Gruene, E. van Genderen, and J. P. Abrahams: Acta Crystallogr. Sect. A.: Found. Adv. 75 (2019) 82-93.
[26] T. Nakane et al.: Nature 587 (2020) 152-156.、両者の差異が実験的に検証された例はなかった。水素原子の可視化位置を定量的に評価するにはサブ原子分解能(<1 Å)が不可欠であり、なおかつ電子線とX線での構造解析ができる限り比較可能な条件で行われる必要がある。著者らの行った3D EDとSXによる化合物構造データはこの検証を行うのに最適であった。ローダミン-6G結晶を用いて2通りに可視化された水素原子位置は結合軸に沿って互いに反対方向にズレており(図4)、少ないサンプリング数ながら、結合様式から予想される極性の大小と矛盾しないことを確認した。また、電荷の偏りが想定される水素結合部位に部分電荷をモデルし、実験値を説明する最適値が求められるかどうかを比較検証した。ここでも散乱特性から想定される通り、3D EDデータでのみ最適値が求まることを示すことができた(図5)。これらの検証は、微小結晶を用いた解析によって原子位置決定以上の構造情報が抽出できることを示唆している。
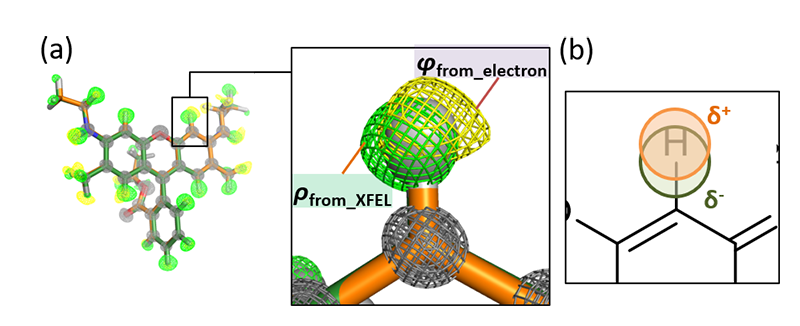
図4 電子線とXFELで観察されたローダミン-6G分子中の水素原子。(a)3D ED、SXで得られた回折データに基づく水素オミットマップ。φfrom_electronが3D EDによる静電ポテンシャル、ρfrom_XFELがSXによる電子密度をそれぞれ示す。(b)結合軸に沿った極性による可視化位置の解釈。
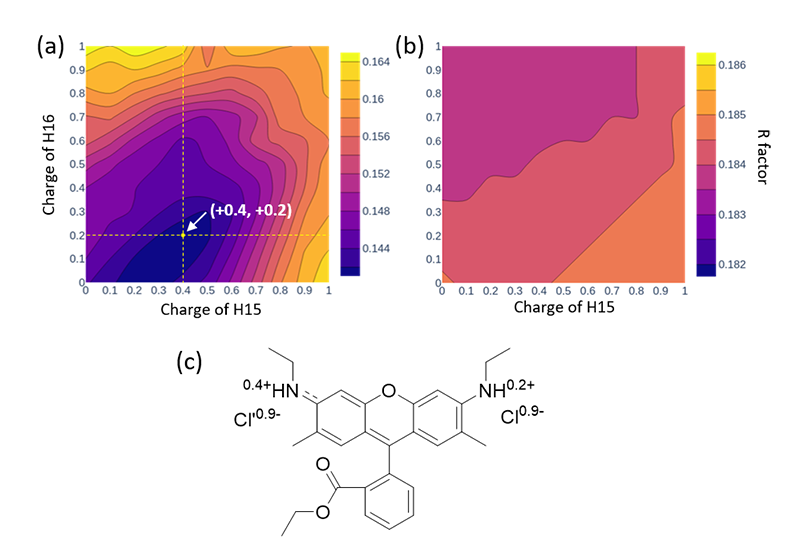
図5 ローダミン-6Gの水素結合部位における最適部分電荷値の探索。2箇所のアミド水素に与える電荷値を変化させ、(a)3D ED、(b)SXでそれぞれ収集した回折データを最もよく説明する値を、R因子で評価した。図中に示す通り3D EDデータでのみ、最適値の組み合わせが得られた。(c)対イオンである塩素の最適電荷も求めたうえで得た構造式。文献18より改変。
6. 組み合わせ・使い分けの可能性
X線と電子線がそれぞれ特徴的な情報を与えるならば、同じ試料を両者で解析して情報を組み合わせることが考えられる。両者はそれぞれ電子密度(ρ)、静電ポテンシャル(φ)の次元で構造を可視化するが、これらの関係はポアソンの方程式
![]()
で記述されるシンプルなものである(ε0は誘電率)図6はローダミン-6Gについて得られた差フーリエマップである。現状では微小結晶からの測定データを用いた価電子の構造モデル化は難しく、孤立原子モデルとの差分として表示している。SXの電子密度マップでは共有結合電子を示すピークが原子間に見て取れるが、3D EDの静電ポテンシャルマップの解釈はノイズとしか解釈されない。これを電子密度次元に変換したマップでは原子位置に正負のピークが現れており、電荷中性モデルとの差分を示していることが想起される。そのまま解釈すれば、電子の多寡については電子線、微細な空間分布にはX線による解像が優れるといえる。しかし完全な変換にはパラメータを増やして核電荷の位置を決める必要がある。このためには、多重回折現象や試料損傷等3D EDにおける測定・解析精度の課題、無数の結晶の静止平均像であるSXの解析・解釈手法における課題に加え、比較スケールの問題もあり、より慎重な議論が必要と考えている。また両線種の透過能の違いによって構造解析に適する試料要件が異なることから、試料に応じた使い分けも考えられる。これは文献19、20で詳述している。
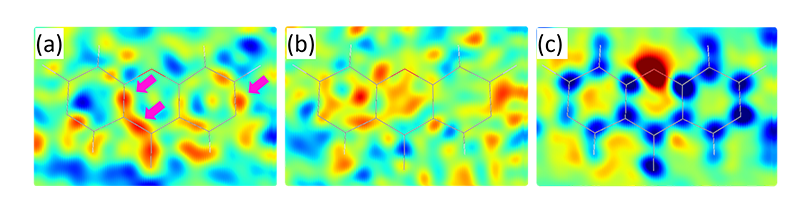
図6 ローダミン-6Gキサンテン環の2D差フーリエマップ。(a)SXデータによる差フーリエ電子密度。矢印のピークは共有結合電子を示唆する。(b)3D EDデータによる差フーリエ静電ポテンシャル。(c)3D EDの測定構造因子から変換したX線構造因子による差フーリエマップ。(b)を電子密度次元に変換したものに相当する。赤が正、青が負を示すよう色分けしたもの。文献18より改変。
7. おわりに
紹介した通り、SPring-8、SACLAあるいは電子顕微鏡を用いることで、従来構造解析の難しかった試料についても、サブ原子分解能情報へアクセスする道は開けつつある。しかしながら前節で述べた通り、得られる情報の精度と妥当性、物理化学的意義の検証が次の課題である。いずれあらゆる分子について、現在原子座標を決めているのと同じように、電子の多寡や形状、あるいは核位置が実験的に決定されることを期待している。このためには量子ビーム源、対応する検出器、装置運用系等のハードの改良、測定データの解析から解釈理論にわたるソフト側の改良、およびユーザーとの議論を含めた連携が不可欠である。著者のこれまで、これからの取り組みがこの点に貢献するよう、活動を続けたく考えている。
謝辞
本研究は著者の京都大学大学院理学研究科、理化学研究所 放射光科学研究センターへの在籍期間に行われたものである。京都大学 竹田一旗准教授、三木邦夫名誉教授、邰洋氏、浴晴彦氏、Hoang-Anh Dao氏、花園佑矢博士、JASRI 長谷川和也博士、登野健介博士、理化学研究所 放射光科学研究センター 米倉功治博士、眞木さおり博士、井上伊知郎博士、濵口祐博士、川上恵典博士、内藤久志博士、矢橋牧名博士、石川哲也博士、東京大学大学院工学系研究科 森本淳平博士、山東信介教授、福田泰啓氏、白鳥陽太氏、彭儀英(Yiying Peng)氏、同物理工学専攻 井上悟博士、長谷川達生教授、産業技術総合研究所 電子光基礎技術研究部門 東野寿樹博士らとの共同研究に基づくものである。研究に協力いただいた皆様へ感謝申し上げます。本研究に関わるX線回折実験は、SPring-8 BL41XUおよびBL44XU(課題番号2015A1033、2015B1037、2016A6624、2016A2536、2016B2536、2017A6728、2017A2542、2018A6827、2018B2705、2016A1856、2016A2533)、SACLA BL2およびBL3(課題番号2021B8018、2022A8025)のもとで行われた。また本研究は、JSPS科研費事業(課題番号20K15764)および理化学研究所基礎特別研究員制度等の支援を受けて実施された。
参考文献
[1] https://www.wwpdb.org/
[2] https://www.ccdc.cam.ac.uk/
[3] https://checkcif.iucr.org/, *C-Alert
[4] K. Takaba et al.: IUCrJ 6 (2019) 387-400.
[5] M. Ormö et al.: Science 273 (1996) 1392-1395.
[6] N. K. Hansen and P. Coppens: Acta Cryst. A34 (1978) 909-921.
[7] R. F. W. Bader: Atoms in Molecules: A Quantum Theory. Oxford University Press (1990).
[8] D. Zhang, P. Oleynikov, S. Hovmöller and X. Zou: Z. Krist. 225 (2010) 94-102.
[9] K. Yonekura, K. Kato, M. Ogasawara, M. Tomita and C. Toyoshima: Proc. Natl. Acad. Sci. USA 112 (2015) 3368-3373.
[10] T. Gruene et al.: Angew. Chem. Int. Ed. 57 (2018) 16313-16317.
[11] R. Henderson: Q. Rev. Biophys. 28 (1995) 171-193.
[12] K. Takaba, S. Maki-Yonekura and K. Yonekura: J. Struc. Biol. 211 (2020) 107569.
[13] K. Takaba, S. Maki-Yonekura, S. Inoue, T. Hasegawa and K. Yonekura: Front. Mol. Biosci. 7 (2021) No. 612226.
[14] 高場圭章: 日本結晶学会誌 64 (2022) 115-116.
[15] S. Boutet et al.: Science 337 (2012) 362-364.
[16] A. S. Brewster et al.: Acta Crystallogr., Sect. D: Biol. Crystallogr. 71 (2015) 357-366.
[17] C. Dejoie et al.: IUCrJ 2 (2015) 361-370.
[18] K. Takaba and S. Maki-Yonekura et al.: Nat. Chem. 15 (2023) 848-855.
[19] K. Takaba and S. Maki-Yonekura et al.: J. Am. Chem. Soc. 146 (2024) 5872-5882.
[20] 高場圭章、眞木さおり、米倉功治: 放射光 37 (2024) in press.
[21] E. A. Schriber et al.: Nature 601 (2022) 360-365.
[22] M. Aleksich et al.: J. Am. Chem. Soc. 145 (2023) 17042-17055.
[23] J. Kang et al.: Nat. Chem. 16 (2024) 693-699.
[24] L. Palatinus et al.: Science 355 (2017) 166-169.
[25] M. T. B. Clabbers, T. Gruene, E. van Genderen, and J. P. Abrahams: Acta Crystallogr. Sect. A.: Found. Adv. 75 (2019) 82-93.
[26] T. Nakane et al.: Nature 587 (2020) 152-156.
Department of Inorganic Chemistry, Faculty of Chemistry, University of Vienna
Währinger Straße 42, 1090 Vienna, Austria
TEL : +43 1 4277-9800503
e-mail : kiyofumi.takaba@univie.ac.at








