Volume 28, No.2 Pages 119 - 123
1. 最近の研究から/FROM LATEST RESEARCH
長期利用課題報告1
放射光X線を用いた巨大な自己集合中空錯体群の構造解明と機能創出
Structure Elucidation and Functionalization of Self-Assembled Gigantic Hollow Complexes by Single-Crystal Synchrotron X-ray Study
[1]東京大学 大学院工学系研究科 応用化学専攻 Department of Applied Chemistry, Graduate School of Engineering, The University of Tokyo、[2]東京工業大学 科学技術創成研究院 化学生命科学研究所 Institute of Innovative Research, Tokyo Institute of Technology
- Abstract
- 我々のグループでは、金属イオン(M)と有機分子(L)の配位結合形成に基づく、配位駆動自己集合によるナノサイズ中空構造のデザインと機能創出を探究してきた。本稿では最近の成果から、(i)我々が開拓してきたMnL2n型球状錯体を用いたタンパク質の1分子閉じ込めへの応用、(ii)ペプチドのフォールディング集合を操ることで実現した種々のトポロジーを示す巨大空孔性構造の創出、および(iii)複数の配位結合協働による新たなナノサイズ空孔構築を取り上げ、未踏構造・機能の創出に向けた進展について紹介する。
1. はじめに
複数の分子やイオンが自律的に集まることで一定の秩序をもった構造を形成する現象を「自己集合」と呼ぶ。自然界においては、コラーゲンの三重らせん形成による堅牢な繊維状構造から、100以上のタンパク質からなる数十ナノメートル径の球状ウイルス殻構造に至るまで、可逆的な分子間相互作用の集積により多様な自己集合システムが形成・機能している。一方、我々のグループでは人工系において、金属イオンと有機分子の配位結合形成を駆動力とした自己集合に基づく、様々な一義構造を有するナノサイズ中空錯体の構築とその機能発現を推進してきた。とりわけ、金属イオン(M)まわりの配位様式と有機配位子(L)の構造が示す幾何学的性質に着目することで、自己集合構造の合理的な設計と化学合成が可能となることを示してきた。その最たる例として、MnL2n型球状錯体の構築について紹介する(図1)。平面4配位構造をとるPd2+と折れ曲がった構造の二座配位子を溶液中において混合することで、配位結合形成に駆動された、一義的な多面体構造をもつ中空錯体の形成が観測された。当初得られたM12L24錯体は36個もの構成分子からなる直径5 nm近くに及ぶ立方八面体構造を示し、この時点で従来知られていた人工系自己集合の概念を飛び越えるものであった。しかしさらに、二座配位子の折れ曲がり角度θや配位子の構造柔軟性を調節することで、アルキメデスの立体(半正多面体)を考えることで予想される、より多くの構成分子からなる錯体群(n = 24, 30)も実際に合成された[1, 2][1] K. Harris, D. Fujita and M. Fujita: Chem. Commun. 49 (2013) 6703-6712.
[2] D. Fujita, Y. Ueda, S. Sato, N. Mizuno, T. Kumasaka and M. Fujita: Nature 540 (2016) 563-566.。さらには、幾何学的な制約から存在し得る構造があとひとつ(n = 60)で完結するということころで、これまで知られていないタイプの多面体構造をもつM30L60およびM48L96錯体の構築が見出された[3][3] Y. Ueda, H. Ito, D. Fujita and M. Fujita: J. Am. Chem. Soc. 139 (2017) 6090-6093.。これらの構造は拡張された4価ゴールドバーグ多面体(無限のバリエーションが予言される)として新たに定義され、合成化学を超えた成果への波及をもたらした。こうした中空錯体の開拓はまた、従来のホスト分子とは異次元の巨大な内部空間の利用により、ナノ粒子の鋳型形成や特異な反応場などへ応用されており[1, 3][1] K. Harris, D. Fujita and M. Fujita: Chem. Commun. 49 (2013) 6703-6712.
[3] Y. Ueda, H. Ito, D. Fujita and M. Fujita: J. Am. Chem. Soc. 139 (2017) 6090-6093.、次に述べるタンパク質の1分子閉じ込めへの実現にも繋がった。
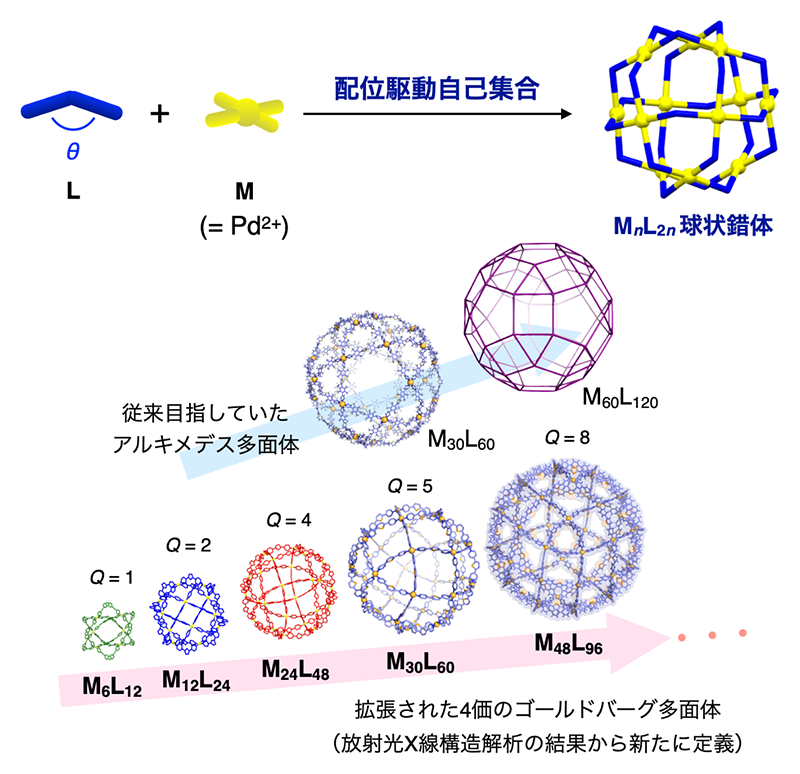
図1 配位駆動自己集合による巨大中空錯体の構築。
2. 巨大中空錯体へのタンパク質の1分子閉じ込め
タンパク質の機能発現は固有のアミノ酸配列に起因する高次フォールディング構造のみならず、周囲の物理的・化学的環境にも大きく影響されることが明らかとなってきている。そこで、複雑な立体構造を保ったまま限られた空間内に「1分子閉じ込め」を行うことができれば、未知の性質や機能、およびそれらの発現過程についての構造情報を各種解析手法により取得可能な場を形成できると期待される。我々は現在、Pd12L24錯体をベースとしたタンパク質を捕捉可能なケージ群を種々開発し、タンパク質の包接による性質や機能の改変、さらには未踏のタンパク質構造の解析について研究を進めている。
図2aに示すように、タンパク質のN末端アミノ基との選択的縮合反応が可能な配位子を設計し、Pd12L24錯体内にクチナーゼ様酵素(CLE)を包接した。その結果、有機溶媒であるアセトニトリル中における失活に対し、凝集沈殿が抑制されることによりCLE単独の場合と比べて1,000倍以上の安定化効果が得られた[4][4] D. Fujita, R. Suzuki, Y. Fujii, M. Yamada, T. Nakama, A. Matsugami, F. Hayashi, J.-K. Weng, M. Yagi-Utsumi and M. Fujita: Chem 7 (2021) 2672-2683.。さらに、長時間経過後に部分的に失活した包接体の溶液を水に溶媒交換したところ、高次構造の復元による酵素活性の再生(リフォールディング現象、図2b)が観測された。このような分子シャペロンに類似した空間捕捉効果の発現はケージ内への1分子包接がなせる技であり、これまで観測困難であったタンパク質の動的構造や機能の解明がさらに期待できる。例えばごく最近、1H−15N HSQCをはじめとするNMR手法を用いたCLE包接体のさらなる詳細解析を行った[5][5] T. Nakama, A. Rossen, R. Ebihara, M. Yagi-Utsumi, D. Fujita, K. Kato, S. Sato and M. Fujita: Chem. Sci. 14 (2023) 2910-2914.。その結果、アセトニトリル/水混合溶媒におけるアセトニトリルの比率を徐々に増すことでアンフォールディング過程における途中段階のスナップショット観察が可能となり、これにより比率が83%付近において極めて鋭い応答を示すことが明らかとなった。さらには、再び水の比率を増やすことでリフォールディングを起こす過程において、従来知られていなかったヒステリシスの存在が観測された(図2c)。
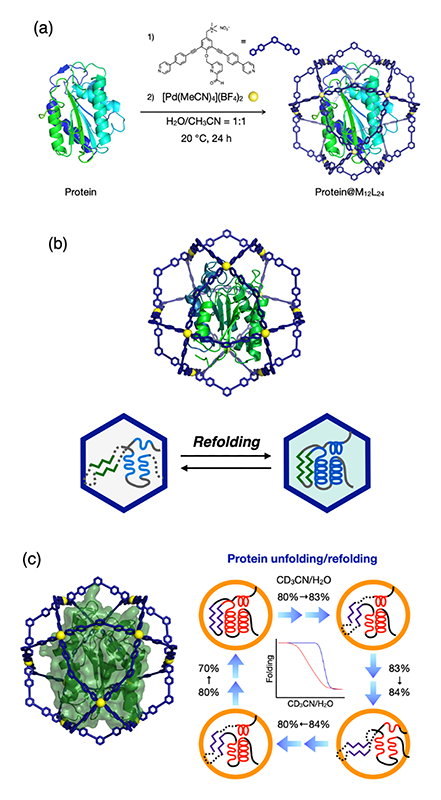
図2 (a)タンパク質の空間捕捉、(b)リフォールディング現象の発現、(c)包接タンパク質のアンフォールディング/リフォールディングにおけるヒステリシス挙動。
Pd12L24錯体の単結晶作製については我々のグループですでに確立されており、種々のタンパク質を閉じ込めた複合体においても類似の条件において良好な単結晶の作製が可能である。そこで本手法をX線結晶構造解析と組み合わせる取り組みについても、SPring-8での継続的な放射光実験を通じてタンパク質適用範囲の拡大や配列制御手法について知見を蓄積しつつあり、今後さらに開発を進める予定である。
3. ペプチドのフォールディング集合による巨大空孔構造の創出
我々のグループでは、金属イオンと数残基のペプチド配位子の自己集合により、ペプチド鎖を特定の配座へとフォールディングさせる過程、およびこれらの3次元的配置を精密制御する過程を協奏的に行う戦略(フォールディング集合)を開拓してきた(図3)。これまでに、初めて人工的に合成されたβ-バレルやウイルスキャプシドに類似した巨大中空状の[6]カテナン[6][6] T. Sawada, Y. Inomata, K. Shimokawa and M. Fujita: Nat. Commun. 10 (2019) 5687.をはじめ、多様なトポロジーをもつ巨大ナノ構造の構築に成功している[7][7] T. Sawada and M. Fujita: Chem 6 (2020) 1861-1876.。
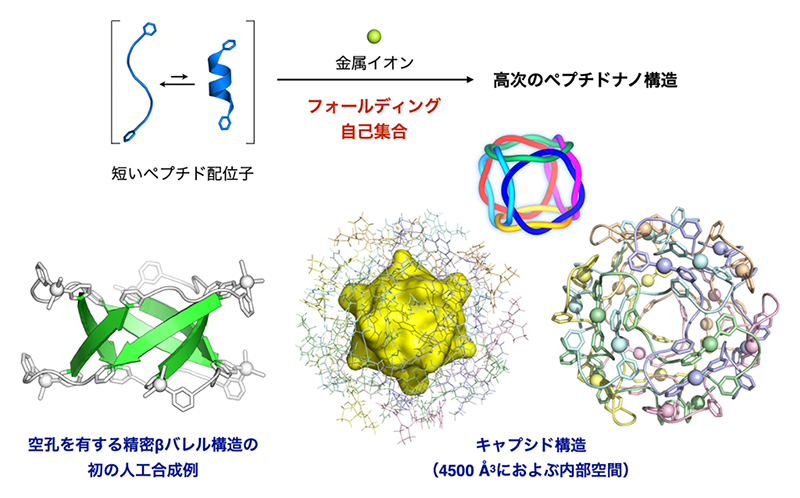
図3 ペプチドと金属イオンによるフォールデング集合。
最近の成果として、二重らせんがドーナツ状に閉じた「トーラス結び目構造」の自在構築を報告している。はじめに、グリシンの3残基配列の両末端に3-ピリジル配位部位を導入したペプチド配位子と銀イオンの自己集合により、図4aに示すような7交点トーラス結び目と呼ばれるトポロジーをもった錯体の形成が確認された[8][8] Y. Inomata, T. Sawada and M. Fujita: Chem 6 (2020) 294-303.。また対アニオンを変えることで、8交点結び目の錯体も結晶化解析を行うことができ、両者が溶液中においては平衡状態にあることが明らかとなった。さらには、トーラス構造が内部空孔をもつことに着目し、空孔内を向いたペプチド側鎖の立体障害を利用することで、9交点構造体への拡張に成功するとともに、10交点トーラス結び目構造の一ヶ所が開裂して無限に連なったトロイダル超らせん構造が形成することが突き止められた(図4b)[9][9] Y. Inomata, T. Sawada and M. Fujita: J. Am. Chem. Soc. 143 (2021) 16734-16739.。このようなトロイダル構造は、DNAにおける遺伝子の発現制御とも関わっていることが知られており、人工的な構築制御の進展による機能創出に期待がもたれる。
ごく最近のSPring-8 BL26B1およびBL41XUを用いた単結晶構造解析では、さらなる巨大多面体型ディスクリート構造の構築や、βシートの人工的な配列構築に関する新たな機序も見出されており、現在論文投稿中である。
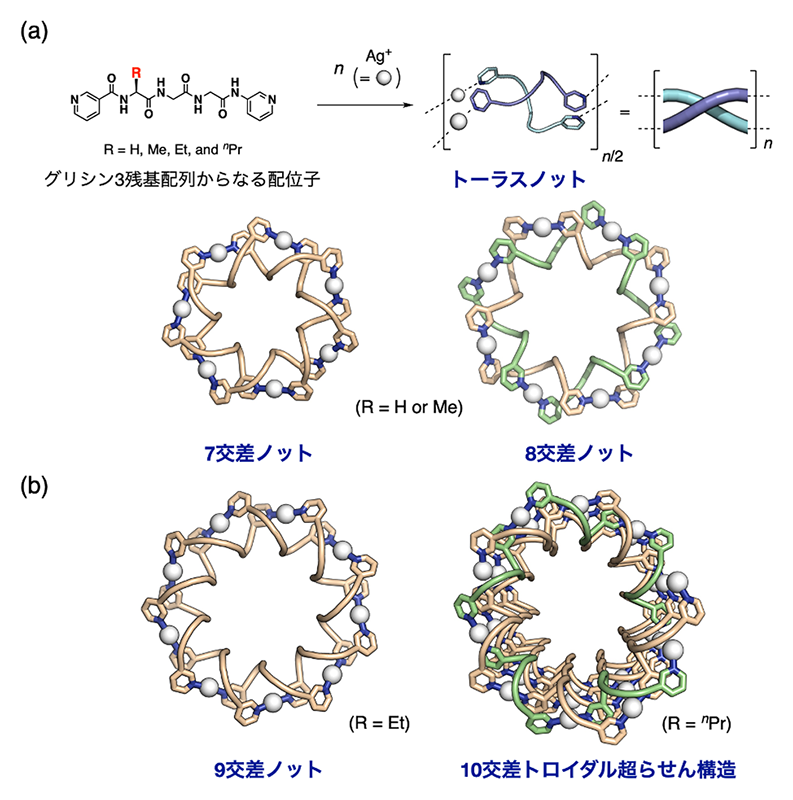
図4 トーラス結び目構造の構築。
4. 配位駆動の多様性:複数配位の協働による多面体型空孔の新たな構築法
配位自己集合によって構築可能な中空錯体のサイズやバリエーションは近年大きく拡大する一方で、近年は空孔の対称性や部分構造の改変にも関心が集まりつつある。高度な秩序性を保ちながら、より複雑な構造を構築制御することは、タンパク質をはじめ自然界における精緻な分子システムに学ぶという観点からも進展が期待される。我々のグループでは最近、金属・・・アセチレン間にはたらくπ配位相互作用が従来のピリジル配位と協働する現象(図5a)をもとに、新たな巨大空孔構造の構築を報告している[10][10] Y. Domoto and M. Fujita: Coord. Chem. Rev. 466 (2022) 214605.。この系では、2つのプロペラ型三座配位子Lが金属イオン(M = CuI, AgI)との錯形成により形式的なサブユニット(M3L2)を形成し、これが金属・・・アセチレン配位によって安定化される。さらにサブユニットが階層的にオリゴマー化することで、一連の(M3L2)n型空孔性錯体が構築された(図5b)。直径は最大で5 nm程度、分子量は約2万と巨大な一義構造であるとともに、その骨格は3次元的な分子絡まり構造を系統的に含んでいることがわかった[11][11] Y. Domoto, M. Abe and M. Fujita: J. Am. Chem. Soc. 143 (2021) 8578-8582.。また、この特異なトポロジーに基づくらせん不斉の高度制御にも成功している[12][12] Y. Domoto, K. Yamamoto, S. Horie, Z. Yu and M. Fujita: Chem. Sci. 13 (2022) 4372-4376.。最近はさらに、金属・・・アセチレンの協働配位を二元系から三元系へと拡張することで、さらに巨大構造の改変へと展開している。すなわち、いったん形成された(M3L2)8錯体(M = AgI)に対して、さらに硝酸イオンを添加することで骨格への形式的な挿入が起こり、凹多面体型のAg21L12錯体が得られた(図5c右)。また類似の方法によって得られたAg13L8錯体の骨格と併せて考えると、(M3L2)nでみられた絡まった構造の部分改変が起こっていることがわかる(現在、論文投稿中)。このような多面体骨格およびそこに内在する絡まった構造の一部分改変は、アセチレンπ配位の示す高い構造許容性・柔軟性によるところが大きいと考えられる。一連の成果は、巨大空孔構造の精密改変と機能発展に向けた知見として今後の展開が期待される。
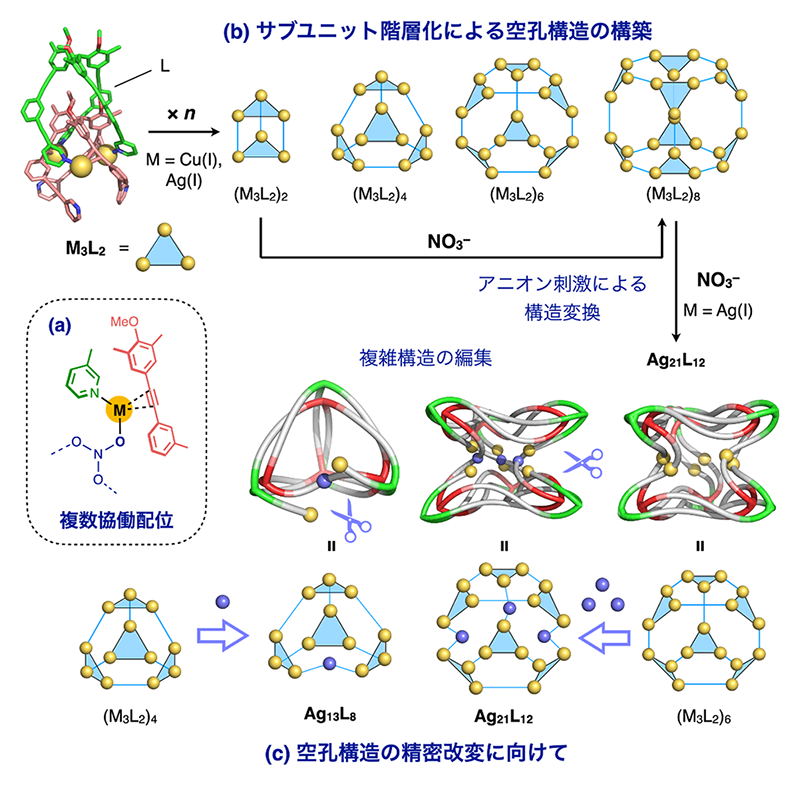
図5 高度に絡まった3次元空孔錯体の動的変換構築。
なおこれら新規錯体の構造解明は、SPring-8 BL26B1/BL41XU(長期利用課題2020A0168-2022A0168、2020A0179-2022A0179)において整備された単結晶回折用の設備類を利用した試行錯誤を通じて達成できたことを付記しておく。例えばAg21L12錯体の構造解析についてはX線照射による損傷を抑えるためヘリカルスキャン測定を行い、またAg13L8錯体ではガラスキャピラリー中に導入した複数個の結晶について測定を行い、これらの回折データを統合することで解析可能なデータを得ることができた。日頃から快適かつ高度な実験環境の実現に尽力されている構造生物学ビームラインスタッフの方々に、改めて深謝したい。
5. 今後の展望
本稿にて紹介した最近の成果はいずれも、放射光施設における実験技術の高度化が物質科学の基礎から応用までを大きく発展させる駆動力となっている好例といえる。一方でより一層の進展が望まれる技術的課題もあり、藤田研究室と共同で研究を進める佐藤宗太 特任教授(東大・社会連携講座)らにより、タンパク質構造解析に用いられる多数の微小結晶に対するデータ取得とKAMOによる解析[13][13] K. Yamashita, K. Hirata and M. Yamamoto: Acta Cryst. D74 (2018) 441-449.や、プレート測定の高度化利用といった最新の機能や解析手法を活用した取り組みが行われつつある。これらの展開と合わせて今後も我々のグループでは、純粋科学としての配位自己集合および未踏機能への応用展開の両者を追究してゆく所存である。
参考文献
[1] K. Harris, D. Fujita and M. Fujita: Chem. Commun. 49 (2013) 6703-6712.
[2] D. Fujita, Y. Ueda, S. Sato, N. Mizuno, T. Kumasaka and M. Fujita: Nature 540 (2016) 563-566.
[3] Y. Ueda, H. Ito, D. Fujita and M. Fujita: J. Am. Chem. Soc. 139 (2017) 6090-6093.
[4] D. Fujita, R. Suzuki, Y. Fujii, M. Yamada, T. Nakama, A. Matsugami, F. Hayashi, J.-K. Weng, M. Yagi-Utsumi and M. Fujita: Chem 7 (2021) 2672-2683.
[5] T. Nakama, A. Rossen, R. Ebihara, M. Yagi-Utsumi, D. Fujita, K. Kato, S. Sato and M. Fujita: Chem. Sci. 14 (2023) 2910-2914.
[6] T. Sawada, Y. Inomata, K. Shimokawa and M. Fujita: Nat. Commun. 10 (2019) 5687.
[7] T. Sawada and M. Fujita: Chem 6 (2020) 1861-1876.
[8] Y. Inomata, T. Sawada and M. Fujita: Chem 6 (2020) 294-303.
[9] Y. Inomata, T. Sawada and M. Fujita: J. Am. Chem. Soc. 143 (2021) 16734-16739.
[10] Y. Domoto and M. Fujita: Coord. Chem. Rev. 466 (2022) 214605.
[11] Y. Domoto, M. Abe and M. Fujita: J. Am. Chem. Soc. 143 (2021) 8578-8582.
[12] Y. Domoto, K. Yamamoto, S. Horie, Z. Yu and M. Fujita: Chem. Sci. 13 (2022) 4372-4376.
[13] K. Yamashita, K. Hirata and M. Yamamoto: Acta Cryst. D74 (2018) 441-449.
(現所属)群馬大学 大学院理工学府 分子科学部門
〒376-8515 群馬県桐生市天神町1-5-1
TEL : 0277-30-1311
e-mail : domoto@gunma-u.ac.jp
東京大学 大学院工学系研究科 応用化学専攻
〒277-0882 千葉県柏市柏の葉6-6-2 三井リンクラボ柏の葉1
TEL : 04-7131-0801
e-mail : nakama@appchem.t.u-tokyo.ac.jp
東京大学 大学院工学系研究科 応用化学専攻
(分子科学研究所 特別研究部門 兼任)
〒277-0882 千葉県柏市柏の葉6-6-2 三井リンクラボ柏の葉1
TEL : 04-7131-0801
e-mail : mfujita@appchem.t.u-tokyo.ac.jp
東京工業大学 科学技術創成研究院 化学生命科学研究所
(JSTさきがけ研究者 兼任)
〒226-8503神奈川県横浜市緑区長津田町4259
TEL : 045-924-5230
e-mail : sawada.t.ak@m.titech.ac.jp








