Volume 22, No.4 Pages 310 - 315
1. 最近の研究から/FROM LATEST RESEARCH
専用ビームラインの研究から ~BL14B1(量子科学技術研究開発機構)~
高温高圧プレス装置による水素化物合成
Syntheses of Hydrides using High-Pressure and High-Temperature Press Apparatus
[1](国)量子科学技術研究開発機構 量子ビーム科学研究部門 Quantum Beam Science Research Directorate, National Institutes for Quantum and Radiological Science and Technology、[2]東北大学 金属材料研究所 Institute for Materials Research, Tohoku University、[3]東北大学 材料科学高等研究所 WPI-Advanced Institute for Materials Research, Tohoku University
- Abstract
- 機能性材料実現をめざして新規水素化物の探索研究を進めている。第一原理計算による理論予測をもとに、放射光その場観察技術を援用し、新規水素化物合成を行った結果を紹介する。高エネルギー密度の水素貯蔵を目的に、資源量豊富な鉄をベースとする水素化物合成を試みた。これまで報告例のなかった3d遷移金属の水素錯体とリチウムの組み合わせからなるLi4FeH6、および、H−イオンと水素錯体が共存するLi3AlFeH8の合成に成功した。また後者の合成条件探索の過程で別の新規水素化物LiAlFeH6の合成にも成功した。
1. はじめに
機能性材料実現をめざして新規水素化物の探索研究が世界各国で進められている。水素エネルギー社会実現のために、水素のエネルギー密度を高める目的で水素貯蔵材料が研究されている。この水素貯蔵の目的以外にも、水素化物の機能性の発現とその理解・応用を目的として、高速イオン伝導材料の開発、高温超伝導の探索などの研究が進められている。近年の合成、理論計算、計測に関する技術の進歩によって、新しい合成指針にもとづく水素化物が次々と報告されている。
気体と固体が反応して固体が生成する反応では、平衡温度と圧力の関係を以下に示すファントホッフの関係式で記述することができる。
ln(f / P0) = ΔH / RT – ΔS / R
ここで、f、P0、T、R、ΔH、ΔSは気体のフガシティ(常圧近傍では気体の圧力)、標準圧力、温度、気体定数、気体1 molあたり生成物の標準生成エンタルピー、反応によるエントロピー変化である。反応によるエントロピー変化は、その大部分が気体分子の解離によるものと近似でき、気体の種類によってほぼ一定の値をとると考えることができる。従って、反応の平衡温度圧力の関係は生成エンタルピーのみで記述できる。このファントホッフの関係式から、負の生成エンタルピーをもつ生成物については、平衡温度が圧力に対して単調増加することが分かる。負の生成エンタルピーをもつ物質が、常温常圧近傍では熱力学的に不安定で合成できない場合でも、圧力を加えることで熱力学的に安定となり、合成可能になる。また常温常圧近傍で熱力学的に安定ながら分解温度が低いため反応が進行しないような系も存在する。そのような系については、圧力を加えることで分解温度を上昇させ、反応が進行できる十分に高い温度で合成を行うことが可能となる。以上の理由から、高温高圧法は気相−固相反応による固相の合成において非常に強力な手法であるといえる。実際に新規酸化物や窒化物が高温高圧法により数多く合成されている。本稿では上記の考えにもとづき、高温高圧下で新規水素化物合成を行った成果について紹介する。
2. 高温高圧下での金属の水素化
高温高圧発生にはキュービック型マルチアンビルプレス装置を用いた。その模式図を図1(a)に示す。油圧によって上金型に下向きの荷重を加える。上金型と固定された下金型は45°の斜面を4個有しており、この上下金型の斜面によって作られる隙間の間に4個のサイドブロックと呼ばれるくさび形金属ブロックを挟みこむ。上金型が下方向に圧し込まれると、くさびの効果でサイドブロックが装置の仮想中心に向かって進む。このようにして油圧によって発生された1軸の荷重を直交する3方向の力に変換する。6個の超硬製ピストン(以下、アンビルと呼ぶ)は同期して高圧装置の仮想中心に向かって圧し込まれる。高圧装置の仮想中心には試料を含む立方体形状の圧力媒体をセットする。圧力媒体が6個のアンビルによって圧縮されることで、試料位置に超高圧が発生する。立方体圧力媒体の一辺の長さはアンビル先端のそれよりも50%程度大きくなっている。アンビルが加圧と共に高圧装置の仮想中心に向かって進行すると、圧力媒体の一部がアンビルとアンビルの隙間に入りガスケットの役割を果たす。

図1 (a) キュービック型マルチアンビルプレス装置の模式図。(b) 本研究で用いた高圧セルの模式図。
立方体圧力媒体中には加熱や金属の水素化に必要なパーツ類一式を組み込んであり、それらをまとめて高圧セルと呼ぶ。本研究で用いた高圧セルの模式図を図1(b)に示す。立方体圧力媒体中に穴を空け、そこに円筒状のヒーターをセットし、内熱方式による加熱を行った。
高温高圧下での金属の水素化には深井らによって開発された方法を用いた[1][1] Y. Fukai and N. Okuma: Jpn. J. Appl. Phys. 32 (1993) L1256.。高温高圧下で金属の水素化を行う上では、どのように試料を高温高圧の水素雰囲気下に保持するかがポイントとなる。深井らの手法では高温高圧下で水素を封じ込めるために岩塩で作製した水素封止カプセルを用いる。この水素封止カプセル中に試料と共に、高圧下で加熱されると水素を放出する化合物からなる内部水素源をセットする。本研究では内部水素源としてアルミニウム水素化物(AlH3)を使用した。高圧下で加熱により放出された水素は水素封止カプセル中に閉じ込められ、試料と水素の直接反応が実現する。試料は水素のみを透過する窒化ホウ素製のカプセルに封じておく。これにより内部水素源が水素を放出した後に残る副生成物と試料との接触が避けられ、水素化反応以外の化学反応を抑制することができる。
この分野の研究は、深井らの先駆的な研究から発展してきた。深井らは上述の数GPa領域で金属を水素化する手法を開発し、放射光その場観察による金属−水素系の高温高圧相図の決定や水素誘起の超多量空孔生成について報告をしている[2][2] Y. Fukai: The Metal-Hydrogen System, Second (Springer, Berlin, 2005).。この手法を用いた金属水素化物合成研究は国内外の複数の研究グループによっても進められてきており、これまでに多くの新規水素化物合成の報告がなされている[3-5][3] D. Kyoi, N. Kitamura and T. Sakai: 高圧力の科学と技術 15 (2005) 317.
[4] K. Puhakainen, E. Stoyanov, M. J. Evans, K. Leinenweber and U. Häussermann: J. Solid State Chem. 183 (2010) 1785.
[5] E. Rönnebro: J. Phys. Chem. Solids 71 (2010) 1154.。
高温高圧下での水素化物の合成反応過程を調べるため、粉末X線回折法によるその場観察を行った[6][6] H. Saitoh, A. Machida and K. Aoki: Chinese Sci. Bull. 59 (2014) 5290.。実験はBL14B1で実施した。その場観察の模式図を図2に示す。偏向電磁石より発生した白色X線を試料に照射し、試料から生じる回折X線をエネルギー分散型検出器で測定することで、粉末X線回折法による高温高圧その場観察を実現した。圧力発生に用いるアンビルは炭化タングステン製でX線を透過しない。アンビルとアンビルの隙間(アンビルギャップ)にはガスケットの役割を果たす立方体圧力媒体の一部が必ず存在しており、超高圧下でも200 µm程度の隙間が存在する。この隙間を入射および回折X線を通すことで、X線回折測定が可能となる。検出器の前には開口200 µmのコリメータが設置されており、試料以外のセルパーツからの回折X線が検出されないようになっている。
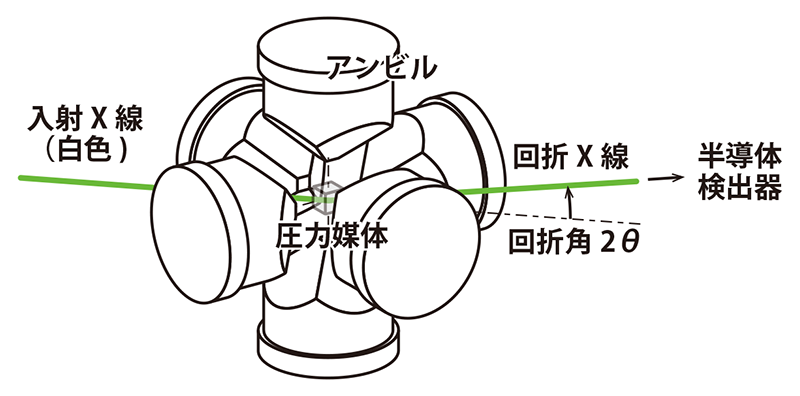
図2 高温高圧放射光その場観察の模式図。アンビルとアンビルの隙間を通して放射光白色X線を試料に照射し、反対側の隙間から出てきた白色回折X線を半導体検出器を使いエネルギー分散法により測定する。
3. 新規鉄錯体水素化物Li4FeH6の合成[7][7] H. Saitoh, S. Takagi, M. Matsuo, Y. Iijima, N. Endo, K. Aoki and S. Orimo: APL Mater. 2 (2014) 076103.
遷移金属は3から5族の金属元素が高い水素親和性を示し単体で金属水素化物を形成するのに対し、6族より周期表で右側に位置する元素は水素親和性が低く、常圧近傍では単体水素化物をほとんど生成しない(パラジウムを除く)。しかし6族より右側の元素も水素と錯イオンを形成し、それらが金属陽イオンとイオン結合した錯体水素化物を作ることが知られている。これらの遷移金属の錯体水素化物については2000年頃までに網羅的に研究が進められ[8][8] K. Yvon: Chim. Int. J. Chem. 52 (1998) 613.、その後、新規錯体水素化物の合成報告は限られていた。著者らは高温高圧法と放射光その場観察技術の組み合わせに理論計算予測を加えることで、2013年以降に新規水素化物合成に次々と成功した[9-12][9] M. Matsuo, H. Saitoh, A. Machida, R. Sato, S. Takagi, K. Miwa, T. Watanuki, Y. Katayama, K. Aoki and S. Orimo: RSC Adv. 3 (2013) 1013.
[10] T. D. Humphries, S. Takagi, G. Li, M. Matsuo, T. Sato, M. H. Sørby, S. Deledda, B. C. Hauback and S. I. Orimo: J. Alloys Compd. 645 (2015) S347.
[11] S. Takagi, Y. Iijima, T. Sato, H. Saitoh, K. Ikeda, T. Otomo, K. Miwa, T. Ikeshoji, K. Aoki and S. Orimo: Angew. Chemie Int. Ed. 54 (2015) 5650.
[12] S. Takagi, Y. Iijima, T. Sato, H. Saitoh, K. Ikeda, T. Otomo, K. Miwa, T. Ikeshoji and S. Orimo: Sci. Rep. 7 (2017) 44253.。この中には従来錯体水素化物は形成しないと考えられていたクロム(Cr)の錯体水素化物の合成例やモリブテン(Mo)に水素が9配位した[MoH9]3−を含む錯体水素化物など従来の考え方の延長では予想できなかった新規水素化物合成の成果も含まれる。本章では著者らの合成以前には報告がなかった3d遷移金属とリチウム(Li)の組み合わせからなる錯体水素化物Li4FeH6の合成の成果について解説する。
合成に先立ち、目的とするLi4FeH6の合成可能性を理論計算予測した。鉄(Fe)は4価の錯イオン[FeH6]4−を形成すること、および、18電子則を満たすように4個のLi+を組み合わせることとし、化学組成をLi4FeH6と仮定した。既知のMg2FeH6の結晶構造との類推からLi4FeH6の初期構造を設定し構造最適化を行った。第一原理計算の結果、図3挿図に示す結晶構造を有するLi4FeH6が熱力学的に安定に存在できること、および、熱力学的安定性の比較から水素化リチウム(LiH)とFeの混合粉末を水素化することで、Li4FeH6が合成できることが示された[13][13] S. Takagi, T. Ikeshoji, T. Sato, K. Aoki and S. Orimo: 日本金属学会誌 77 (2013) 604.。理論計算の結果からは、熱力学的には常圧近傍でもLi4FeH6が安定に存在できると予想されたが、実験では水素化物を得ることができなかった。そこで、新規水素化物が実現しやすい高温高圧下での合成を試みた。合成条件の最適化を迅速に行う目的で放射光その場観察を行った。
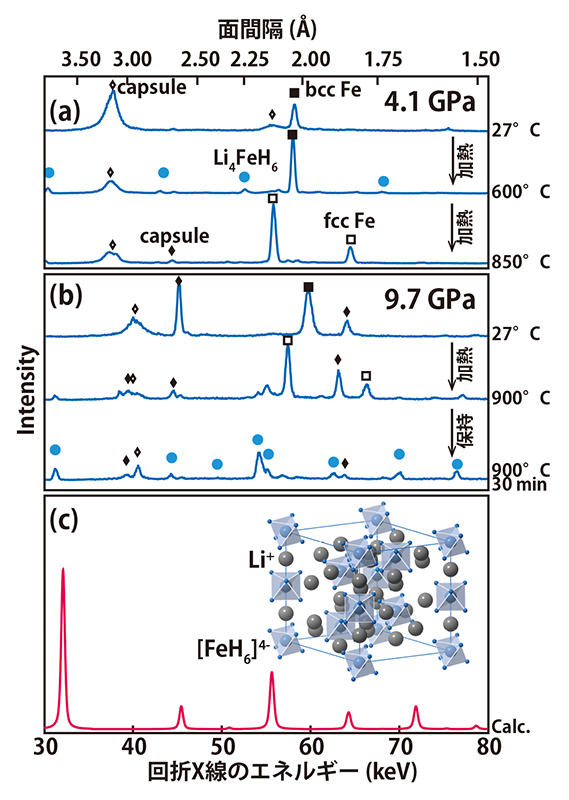
図3 LiHとFeの混合粉末を(a) 4.1 GPa、(b) 9.7 GPaで水素化したときの放射光その場観察の結果。(c) 理論予測されたLi4FeH6の結晶構造とX線回折プロファイル。
出発物質は、LiHとFeをモル比6:1で混合したものを用いた。窒化ホウ素製カプセル中をLiが拡散し散逸してしまうことがあるため、目的とする組成に対してLiを余剰に加えた。出発物質を室温で所定の圧力まで加圧後、加熱を行い高温高圧水素流体中に保持した。高温高圧処理後の試料を高圧下で室温まで冷却し、常圧まで脱圧し回収した。回収試料は実験室系の粉末X線回折計により評価した。
出発物質を4.1 GPa、600℃で水素化した際には、わずかなLi4FeH6の生成は確認されたが、試料の大部分は未反応のままであった。放射光その場観察の結果を図3(a)に示す。600℃で混合粉末を水素流体中に保持すると、丸印で示した位置にわずかに新しいピークが生成することが確認できた。これらのピークは理論予測されたLi4FeH6の単位格子で指数付けすることができ、回収試料の分析結果とも併せて、Li4FeH6の生成が確認された。しかしながらその収率は体積分率で10%以下と極めて少なかった。収率を上げるために反応条件の最適化を試みたが、反応時間を24時間程度としたり、反応温度を800℃まで上昇させたりしたが収率を上げることはできなかった。さらに反応温度を850℃まで上げたところ、生成したLi4FeH6が分解し、これより高温領域ではLi4FeH6が合成できないことが分かった。
分解反応を生じさせることなく、より高温で水素化反応を進行させるために、反応圧力を9.7 GPaとして水素化反応を試みた。すでに述べた通り水素化物の分解温度は圧力に対して単調に増加する。従って、圧力を上げることでより高温まで水素化物が安定に存在できるようになる。その結果、より高温で反応を進行させることが可能となる。9.7 GPaで出発物質を水素化させた際の放射光その場観察の結果を図3(b)に示す。900℃までの加熱中に出発物質中のFeがbccからfccへ構造相転移した。900℃到達後に水素化反応が進行し、約30分でほぼLi4FeH6単相になった。得られた水素化物は常温常圧下に回収可能であり、実験室系の粉末X線回折装置で評価したところ、理論予測されたLi4FeH6が間違いなく合成できていることを確認した。
同様の実験を温度圧力条件を変えて繰り返し行い、結果を反応温度圧力ダイアグラムとして整理したものを図4に示す。Li4FeH6単相を得るためには、900℃以上の高温が圧力にはほぼ依存せず必要であることが分かった。900℃未満の温度領域では、反応が十分に進行しない結果となったが、これはLiHとFe粉末の接触部分に生成したLi4FeH6が、それ以上の水素化反応を妨げている可能性がある。また、Li4FeH6の分解曲線を外挿すると、この水素化物が常圧近傍でも熱力学的に安定であることが示唆された。この結果は第一原理計算による理論予測とも一致した。以上の結果からLi4FeH6は常圧近傍でも熱力学的には安定だが、反応カイネティクスの問題で常圧近傍ではLiHとFeの混合粉末の水素化では合成できないと結論づけた。この結果は見方を変えると、LiHとFeの混合粉末を直接水素化する方法以外の低温で反応が進行する合成ルートを見つけられれば、高圧を加えることなくLi4FeH6が合成できることを示している。

図4 LiHとFe混合粉末を水素化させた際の反応温度圧力ダイアグラム。
4. H−イオン導入による高重量水素密度の鉄錯体水素化物合成[14][14] H. Saitoh, S. Takagi, T. Sato, Y. Iijima and S. Orimo: Int. J. Hydrogen Energy 42 (2017) 22489.
鉄錯体水素化物中にH−イオンを導入することで、さらなる重量水素密度の向上をめざした。すでに述べたように鉄錯体水素化物では18電子則を満たす必要があること、鉄と水素の錯イオンが[FeH6]4−であることから、鉄錯体水素化物を構成する金属陽イオンの組み合わせは、4M+、M2++M’2+、M2++M’++M’’+、M3++M’+の4通りに限られる(M、M’、M’’は金属元素)。特に高重量水素密度の水素化物合成をめざす場合、陽イオンの組み合わせは極めて限定的となる。ここで、例えば鉄錯体水素化物中に2個のH−イオンを導入すると、マイナスイオンの価数の合計は6−となるため、金属陽イオンの組み合わせは、6M+、M2++4M’+、M2++2M’2++M’’++M’’’+、… と増加し、合成可能な錯体水素化物の種類が増加する[15][15] S. Takagi, T. D. Humphries, K. Miwa and S. I. Orimo: Appl. Phys. Lett. 104 (2014) 203901.。実際にNa2Mg2FeH8やNa2Mg2RuH8といったH−イオンを2個含む錯体水素化物の合成が報告されている[10][10] T. D. Humphries, S. Takagi, G. Li, M. Matsuo, T. Sato, M. H. Sørby, S. Deledda, B. C. Hauback and S. I. Orimo: J. Alloys Compd. 645 (2015) S347.。
筆者らは報告されている遷移金属の錯体水素化物の中で最も高い重量水素密度を有するLi3AlFeH8の合成を試みた。第一原理計算による理論予測ではLiH、FeとAlH3の混合粉末を水素化することでLi3AlFeH8が合成できることが示されている[15][15] S. Takagi, T. D. Humphries, K. Miwa and S. I. Orimo: Appl. Phys. Lett. 104 (2014) 203901.。図5挿図に理論予測されたLi3AlFeH8の結晶構造を示す。熱力学的にはLi3AlFeH8は常温常圧下でも安定に存在することが予想されたが、常圧近傍では合成することができないため、前章のLi4FeH6と同様に、新規水素化物合成に有利な高温高圧法での合成を試みた。

図5 LiH、FeとAlH3の混合粉末を5 GPa、600℃で水素化させた際の放射光その場観察の結果。挿図は理論予測されたLi3AlFeH8の結晶構造を示す。
LiH、FeとAlH3をモル比3:1:1で混合した粉末を5 GPa、600℃で水素化することでLi3AlFeH8が合成できることを確認した。放射光その場観察の結果を図5に示す。出発物質の組成については、Li4FeH6の場合と同様にLi余剰の条件でも実験を行ったが明確な差が現れなかったため、本稿では上記の組成の出発物質を用いた際の結果を示した。試料を水素流体中に保持すると約20分で丸印(図5)で示した面間隔位置に新しいブラッグピークが現れた。これらのピークは時間の経過と共に強度増加を示したが、約300分経過後にほぼ一定の値となった。これらのピークは理論予測されたLi3AlFeH8の結晶構造で指数付けすることができ、目的とする水素化物が得られていることが確認された。しかし、Li3AlFeH8のピーク強度の増加が終了した時点、すなわち混合粉末の水素化反応が終了した時点でも、未反応の鉄からのピーク、および、同定できない未知構造相からのピークが観察され、単相のLi3AlFeH8は得られていないことも確認された。未反応の鉄の体積分率はピークの強度比から10%以下と見積もられた。単相のLi3AlFeH8の合成条件を探索するため、5 GPaで温度を変えて合成を試みたが、800℃以上の高温で別の相がより安定となり、Li3AlFeH8単相を得ることはできなかった。
さらに圧力を変えて合成条件の最適化を試みたが、Li3AlFeH8単相を得ることはできなかった。4 GPa以下の圧力領域ではLi3AlFeH8は生成しないことが分かったため、6 GPa以上の高圧領域で反応過程を調べた。図6に9 GPaで水素化した混合粉末を常温常圧下に回収した後に粉末X線回折測定した結果を示す。9 GPaでのLi3AlFeH8の最大収率は800℃で得られたが、残念ながらその収率は5 GPaのそれよりも低かった。また850℃より高温では5 GPaで観察された相とは別の高温相が得られることが分かった。この高温相に着目すると比較的単純な構造を有していることが予想されたため、結晶構造の解析を試みた。

図6 LiH、FeとAlH3の混合粉末を9 GPaで水素化し、常温常圧下に回収した試料の粉末X線回折測定結果の比較。挿図は理論予測されたLiAlFeH6の結晶構造。一番上のプロファイルは理論予測から計算された回折プロファイル(LiAlFeH6)を示す。
観察された高温相のピークは六方晶の単位格子で指数付け可能であることが分かった。格子定数は、a = 4.464、c = 8.765 Åであった。次にこの得られた格子体積と構成イオンの体積の関係[16][16] T. Sato, S. Takagi, S. Deledda, B. C. Hauback and S.-I. Orimo: Sci. Rep. 6 (2016) 23592.から、化学組成をLiAlFeH6と推定した。この組成の水素化物について第一原理計算による構造最適化を行い、図6挿図に示す結晶構造を有するLiAlFeH6が熱力学的に安定に存在できることを明らかにした。予想された結晶構造から粉末X線回折プロファイルを計算し、実験結果と比較したところ、非常に良く一致することが分かった。以上の結果から9 GPa、850℃以上ではLiAlFeH6が合成できることが分かった。
5. まとめ
熱力学的に有利な高温高圧法を用いて、新規水素化物合成を行った結果を紹介した。ここでは合成条件の探索、最適化、および、反応過程を調べるために、放射光その場観察が効率的に利用されている。さらに合成予測や生成物の評価に理論計算が非常に強力なツールとなっている。最近筆者らのグループでは、高温高圧下での重水素化反応の様子を中性子回折によりその場観察することにも成功しており[17][17] A. Machida, H. Saitoh, H. Sugimoto, T. Hattori, A. Sano-Furukawa, N. Endo, Y. Katayama, R. Iizuka, T. Sato, M. Matsuo, S. Orimo and K. Aoki: Nat. Commun. 5 (2014) 5063.、これにより反応過程における水素そのものの位置情報も得られるようになっている。今後これらの技術の組み合わせでさらに新規水素化物の合成研究が加速するものと期待する。
謝辞
本研究は科研費基盤研究(課題番号:25220911、25420725)、光・量子融合連携研究開発プログラム、および、東北大学金属材料研究所における共同利用研究(16K0079、17K0026)のもとで実施した。本研究はSPring-8 BL14B1にて実施した(課題番号:2013B3602、2013B3614、2014A3602、2014B3602、2014A3614)。図中で示した結晶構造はVESTAにより描画した[18][18] K. Momma and F. Izumi: J. Appl. Crystallogr. 41 (2008) 653.。
参考文献
[1] Y. Fukai and N. Okuma: Jpn. J. Appl. Phys. 32 (1993) L1256.
[2] Y. Fukai: The Metal-Hydrogen System, Second (Springer, Berlin, 2005).
[3] D. Kyoi, N. Kitamura and T. Sakai: 高圧力の科学と技術 15 (2005) 317.
[4] K. Puhakainen, E. Stoyanov, M. J. Evans, K. Leinenweber and U. Häussermann: J. Solid State Chem. 183 (2010) 1785.
[5] E. Rönnebro: J. Phys. Chem. Solids 71 (2010) 1154.
[6] H. Saitoh, A. Machida and K. Aoki: Chinese Sci. Bull. 59 (2014) 5290.
[7] H. Saitoh, S. Takagi, M. Matsuo, Y. Iijima, N. Endo, K. Aoki and S. Orimo: APL Mater. 2 (2014) 076103.
[8] K. Yvon: Chim. Int. J. Chem. 52 (1998) 613.
[9] M. Matsuo, H. Saitoh, A. Machida, R. Sato, S. Takagi, K. Miwa, T. Watanuki, Y. Katayama, K. Aoki and S. Orimo: RSC Adv. 3 (2013) 1013.
[10] T. D. Humphries, S. Takagi, G. Li, M. Matsuo, T. Sato, M. H. Sørby, S. Deledda, B. C. Hauback and S. I. Orimo: J. Alloys Compd. 645 (2015) S347.
[11] S. Takagi, Y. Iijima, T. Sato, H. Saitoh, K. Ikeda, T. Otomo, K. Miwa, T. Ikeshoji, K. Aoki and S. Orimo: Angew. Chemie Int. Ed. 54 (2015) 5650.
[12] S. Takagi, Y. Iijima, T. Sato, H. Saitoh, K. Ikeda, T. Otomo, K. Miwa, T. Ikeshoji and S. Orimo: Sci. Rep. 7 (2017) 44253.
[13] S. Takagi, T. Ikeshoji, T. Sato, K. Aoki and S. Orimo: 日本金属学会誌 77 (2013) 604.
[14] H. Saitoh, S. Takagi, T. Sato, Y. Iijima and S. Orimo: Int. J. Hydrogen Energy 42 (2017) 22489.
[15] S. Takagi, T. D. Humphries, K. Miwa and S. I. Orimo: Appl. Phys. Lett. 104 (2014) 203901.
[16] T. Sato, S. Takagi, S. Deledda, B. C. Hauback and S.-I. Orimo: Sci. Rep. 6 (2016) 23592.
[17] A. Machida, H. Saitoh, H. Sugimoto, T. Hattori, A. Sano-Furukawa, N. Endo, Y. Katayama, R. Iizuka, T. Sato, M. Matsuo, S. Orimo and K. Aoki: Nat. Commun. 5 (2014) 5063.
[18] K. Momma and F. Izumi: J. Appl. Crystallogr. 41 (2008) 653.
(国)量子科学技術研究開発機構 量子ビーム科学研究部門
〒679-5148 兵庫県佐用郡佐用町光都1-1-1
TEL : 0791-58-1014
e-mail : cyto@spring8.or.jp
東北大学 金属材料研究所
〒980-8577 宮城県仙台市青葉区片平2-1-1
TEL : 022-215-2094
e-mail : shigeyuki.takagi@imr.tohoku.ac.jp
東北大学 金属材料研究所
〒980-8577 宮城県仙台市青葉区片平2-1-1
TEL : 022-215-2094
e-mail : toyoto@imr.tohoku.ac.jp
東北大学 金属材料研究所
〒980-8577 宮城県仙台市青葉区片平2-1-1
TEL : 022-215-2094
e-mail : yiijima@imr.tohoku.ac.jp
東北大学 金属材料研究所/材料科学高等研究所
〒980-8577 宮城県仙台市青葉区片平2-1-1
TEL : 022-215-2093
e-mail : orimo@imr.tohoku.ac.jp
BL11XU、BL14B1、BL22XUに設置のQST放射光実験装置のご利用を希望される方は、QST微細構造解析プラットフォーム事務局(ml-qst-nanoinfo[at]qst.go.jp)に御相談ください。
利用相談は随時無料で受け付けています。
装置の概要や利用方法については、JAEA・QST微細構造解析プラットフォームの専用ウェブサイトをご覧ください。
http://www.kansai.qst.go.jp/nano/








