Volume 22, No.1 Pages 3 - 7
1. 最近の研究から/FROM LATEST RESEARCH
(SPRUC 2016 Young Scientist Award受賞 研究報告)
オプトジェネティクスツールである光駆動性イオン輸送体の構造機能解析
Structural and Functional Analysis of Ion-Translocating Rhodopsins
スタンフォード大学 医学部 分子細胞生理学科 School of Medicine, Stanford University
- Abstract
- ヒトをはじめとする殆どあらゆる生物は光情報を利用して行動しているが、この光情報の受容は、多くの場合ロドプシンファミリータンパク質によって担われる。この中でも近年特に、イオン輸送体として働くロドプシンが、光によって細胞の膜電位を操作できるツールとして注目を集めている(オプトジェネティクス)。我々は、オプトジェネティクスツールとして最も広く利用されている光駆動性陽イオンチャネル、チャネルロドプシン(ChR)について、その立体構造を明らかにし分子機構の一端を解明した。また、得られた結晶構造を元に、異なる吸収波長特性を持つ変異型イオン輸送ロドプシンを創製する合理的設計法を提唱、実証した。更に、2013年に発見されたばかりの光駆動性Na+ポンプであるKrokinobacter rhodopsin 2(KR2)についてもその立体構造を明らかにし、光依存的Na+輸送の分子機構を解明するとともに、自然界からは発見されていない光駆動性K+ポンプを創製することに成功した。
1. 光駆動性陽イオンチャネルであるChRの構造機能解析
ChRは、2002年にPeter Hegemann博士らによって発見された光駆動性陽イオンチャネルであり、オプトジェネティクスの強力なツールとして、その発見以来注目を集め続けている。ChRは他の微生物型ロドプシンと同様、シッフ塩基を介して共有結合したall-transレチナール(ATR)を発色団として持っている。光を吸収すると、このATRが13-cis型に異性化され、チャネルが開くことが知られていたが、その分子機構は勿論、イオン透過経路の位置すら不明であった。そこで我々は、ChRの立体構造をX線結晶構造解析の手法を用いて明らかにし、その分子機構に迫ることを試みた。はじめに、既知のChRやその変異体、キメラを含む十数種のChRについて発現スクリーニングを行い、X線結晶構造解析に適したChlamydomonas reinhardtii由来ChR1、ChR2のキメラ(C1C2)を見出した。このC1C2を発現精製し、近年注目を浴びている脂質キュービック相(LCP)法を用いて結晶化を行うことで、C1C2の閉状態(暗状態)における立体構造を2.3 Å分解能で決定した。位相決定は水銀原子の異常分散を利用した多波長異常分散法によって行うことができたが、これはLCPから得られた結晶について、新規に位相決定を行うことができた初の例であった。またこの過程で、副産物としてLCP法に最適化された結晶化スクリーニングキットのデザイン、開発を行うことができた(Molecular Dimensions社より商品名MemMesoとして販売中)。
得られたC1C2の結晶構造を、現在までに最も研究が進んでいる微生物型ロドプシン、すなわち光駆動性H+ポンプであるバクテリオロドプシン(BR)の結晶構造と比較したところ、一次構造における両者の相同性は15%程度と低いにも関わらず、その構造はATRの結合位置を含めて、非常に良く一致していることが判明した(図1)。しかし一方で、大きく2つの顕著な違いが存在していた。1つ目はC1C2が細胞外、細胞内に特有のドメイン構造を有していたことである(図1)。構造既知の微生物型ロドプシンは、どれも7回膜貫通ヘリックス(TM)と短いループ構造から構成されていたが、C1C2はそれに加えてN末端側に40残基程度、C末端側に30残基程度の小さなドメイン構造を有していた。特に、その細胞外ドメインは隣接する分子と3箇所のジスルフィド結合を含む強固な相互作用を形成しており、これによってC1C2は2量体構造を形成していた(図2)。これは、他の微生物型ロドプシンが3量体や5、6量体を形成するのとは対照的であり、2量体構造を形成する微生物型ロドプシンとしては初めての例となった。2つ目は、C1C2のTM1、2がBRと比較してそれぞれ3 Å、4.1 Åほど外側に傾いていた点である(図2)。TM1、2が外側に傾くことによって、C1C2のTM1、2、3、7によって囲まれた領域にはBRと比較して大きな空間が形成されていた。更に、我々がC1C2の立体構造を元にその表面電荷を計算したところ、C1C2のTM1、2、3、7によって囲まれたこの領域は強い負電荷を帯びていることが判明した(図3)。そのため我々は、このC1C2特有の負電荷を帯びた領域こそがイオンの透過に重要なのではないかと考え、経路上に存在するアミノ酸残基の変異体を複数作製し、そのチャネル活性を測定した。結果、変異体のチャネル活性はどれも低下しており、また変異体によってはイオンの選択性までもが変化するということを見出すことができた。これはChRのイオン透過経路がTM1、2、3、7によって囲まれた領域に存在しているという考えを強くサポートするものであり、「ChRのイオン透過経路は単量体の中に存在するのか、多量体の中心に存在するのか」という10年近くに渡って続けられてきた議論に事実上の決着をつけるものであった。
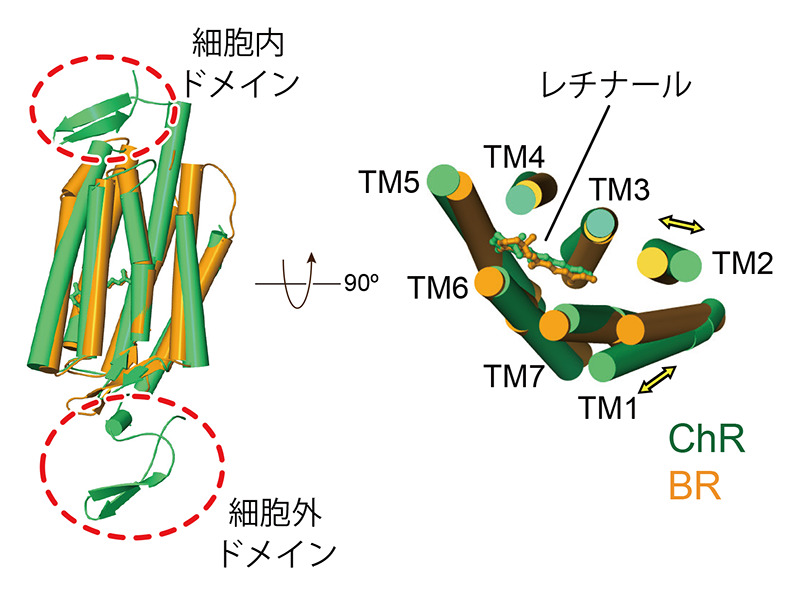
図1 C1C2とBRの構造比較。

図2 C1C2(2量体)の全体構造。
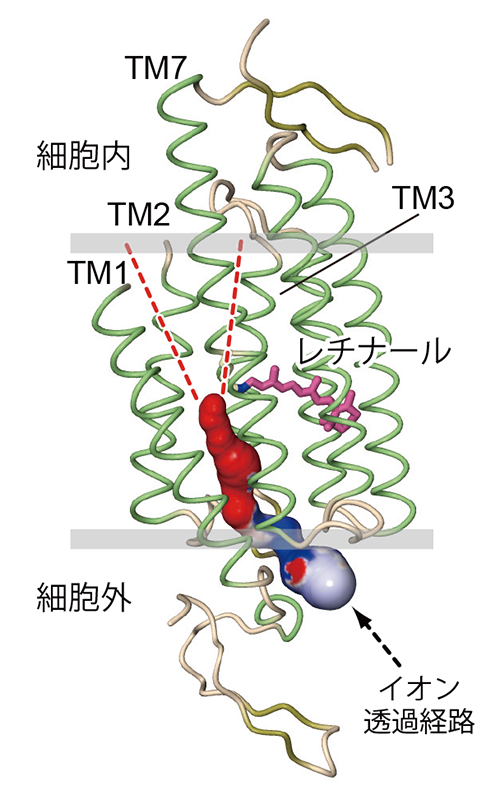
図3 C1C2のイオン透過経路。赤破線は予想される細胞内側のイオン透過経路を示している。
以上の結果は、ChRの作動メカニズムについての理解を深め、更には、立体構造を元にツールとしてより有用な変異型ChRを設計するための道を示したという点で評価され、Nature誌のArticleに掲載された[1][1] H. E. Kato, F. Zhang, O. Yizhar, C. Ramakrishnan, T. Nishizawa et al.: Nature 482 (2012) 369-374.。なお、本研究が行われた2年後には、当時の共同研究者であったKarl Deisseroth博士ら、Peter Hegemann博士らが、我々の見出したイオン透過経路上に変異を導入することで、実際に“光駆動性陰イオンチャネル”を創製することに成功している[2,3][2] A. Berndt, S. Y. Lee, C. Ramakrishnan and K. Deisseroth: Science 344 (2014) 420-424.
[3] J. Wietek, J. S. Wiegert, N. Adeishvili, F. Schneider, H. Watanabe et al.: Science 344 (2014) 409-412.。
2. 短波長励起型イオン輸送ロドプシンを創製する合理的設計法の提唱と実証
励起波長を短波長側や長波長側にシフトさせたイオン輸送ロドプシンを作成することができれば、両者を組み合わせることで、異なる光を用いて異なる神経細胞群の活動をコントロールするといった、発展的なオプトジェネティクス実験が可能になる。ロドプシンタンパク質の吸収波長は一般に3つの要因、すなわち、(1) シッフ塩基のカウンターイオンとH+化シッフ塩基との距離、(2) レチナール分子の平面性、(3) レチナール分子周辺の極性アミノ酸とレチナール分子間の静電相互作用、によって決定されると考えられている。(1)、(3)のパラメータを変化させることで微生物型ロドプシンの吸収波長をシフトさせる試みは何例も報告されていたが、(2)のパラメータを変化させる試みは殆ど行われていない。そこで、吸収波長シフト変異体の設計コンセプトとして新しい枠組みを提供するためにも、我々は、特にATRの平面性を変化させるような変異を導入することによって短波長励起型ChRを達成しようと考えた。
前項で得られた立体構造を用いてATRの結合ポケットを解析し、特にThr198、Gly202の側鎖の大きさと形状が、ATRのβイオノン環の向きを決定していると考えた。そこで、βイオノン環の向きを大きく回転させる狙いで、この2残基に変異を導入し、変異体のチャネル活性と作動スペクトルを測定した。その結果、この変異体はチャネル活性を保持しながらも作動スペクトルが20 nm程度短波長シフトしていることが判明した。そこで、この変異体を発現精製し、精製タンパクを用いて吸収スペクトルの測定と結晶化を試みた。結果、この変異体は吸収スペクトルにおいても20 nm程度の短波長シフトを実現しており、結晶構造中においても確かにATRのβイオノン環が140°程度回転していることが明らかになった(図4)。
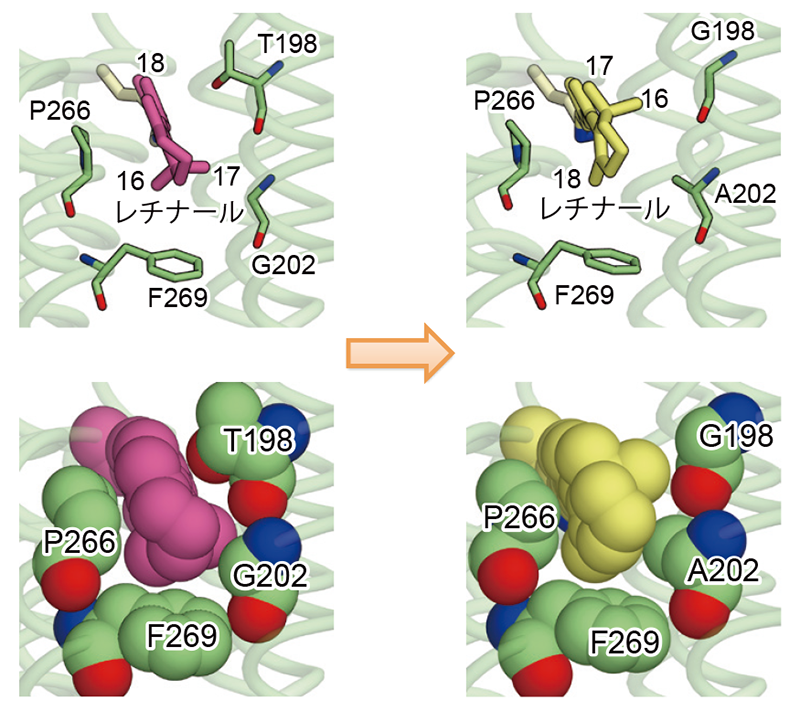
図4 (左)C1C2と(右)T198A/G202A変異体の結晶構造におけるレチナール結合部位。C16、C17、C18を含むβイオノン環がポリエン鎖に対して回転しているのがわかる。
更に我々は、同様の設計思想が別のイオン輸送型ロドプシンにも適用できるのではないかと考え、異なる3種のイオン輸送型ロドプシンにも同様の変異を導入した。結果は驚くべきものであり、3種全てのロドプシンにおいて、その変異体はイオン輸送活性を保持したまま、40~80 nm程度の短波長シフトを示した。特にこのうち、オプトジェネティクスツールとしても用いられているArchaerhodopsin-3(AR3)については、先述した「レチナール分子周辺の極性アミノ酸とレチナール分子間の静電相互作用」を変化させる変異と組み合わせることで、100 nmという波長シフトを達成することができた。これは、合理的設計法によって達成されたロドプシンタンパク質の吸収波長シフトとしては最大のものであった。
以上の結果は、「ATRのβイオノン環結合ポケットを形成する2アミノ酸に変異を導入することで、イオン輸送活性を損なわずにあらゆるロドプシンタンパク質の吸収波長を短波長側にシフトさせることができる」という仮説を強く支持するものであり、ロドプシンの吸収波長決定メカニズムに対する理解を深めたという点だけでなく、既知の長波長シフト変異体と組み合わせることで今後様々なアプリケーションを可能にしてくれることが期待されるという点で評価され、Nature Communications誌に掲載された[4][4] H. E. Kato, M. Kamiya, S. Sugo, J. Ito, R. Taniguchi et al.: Nat. Commun. 6 (2015) 7177.。
3. 光駆動性Na+ポンプであるKR2の構造機能解析
KR2(Krokinobacter rhodopsin 2)は、2013年に海洋微生物Krokinobacter eikastusから発見されたばかりの光駆動性Na+ポンプであり、初のNa+ポンプ型ロドプシンとして着目されている。分光学的解析から、KR2がATRの異性化やH+シッフ塩基の脱H+化を伴う中間体(M中間体)を通じてNa+を輸送することが報告されていたが、そのゲーティングやイオン選択の分子機構については不明であった。また、陽イオンを細胞内に輸送することで神経細胞を興奮させることができる(=興奮性オプトジェネティクスツール)ChRとは対照的に、KR2は陽イオンであるNa+を細胞外に輸送する。そのため、KR2は神経活動を抑制するツール(抑制性オプトジェネティクスツール)としても期待されていた。抑制性オプトジェネティクスツールとしては、現在まで主に内向きCl-ポンプであるハロロドプシン(HR)、外向きH+ポンプであるAR3が用いられているが、どちらもCl-濃度変化やpH変化に伴う毒性や望まぬ副作用が報告されている[5][5] M. Mahn, M. Prigge, S. Ron, R. Levy and O. Yizhar: Nat. Neurosci. 19 (2016) 554-556.。その点で、Na+を輸送するKR2は、HRやAR3に変わる第3の抑制性ツールとして使用できる可能性があった。そこで、我々は光駆動性Na+ポンプの作動メカニズムについての理解を深めるため、そしてオプトジェネティクスツールへの適用可能性を調べるため、KR2の結晶構造解析、並びにほ乳類神経細胞や線虫を用いたオプトジェネティクス実験を試みた。
はじめに、KR2のN、C末端の配列を最適化した上でこれを培養精製し、LCP法を用いて結晶化を行い、2.3 Åという高分解能で酸性条件、中性条件におけるKR2の立体構造を決定することに成功した(図5)。BRを用いた先行研究において「酸性条件下におけるイオン輸送型ロドプシンの構造は特定の中間体(M中間体)下のそれと類似している」ことが指摘されていたため[6][6] H. Okumura, M. Murakami and T. Kouyama: J. Mol. Biol. 351 (2005) 481-495.、我々は酸性、中性条件におけるKR2の構造を比較することでKR2によるNa+輸送の分子機構に迫ることを考えた。酸性、中性条件におけるKR2の構造を比較したところ、全体構造に大きな差異は見られなかったが、シッフ塩基の近傍に位置するAsp116の向きに顕著な違いが見られた。中性条件下ではAsp116の側鎖がシッフ塩基の方向を向いている一方、酸性条件下ではこれがフリップし、シッフ塩基とは反対の位置に存在するAsn112、Ser70と水素結合を形成していたのである(図6)。このことは、Asp116がM中間体においてシッフ塩基からH+を受け取り、また受け取ったH+をシッフ塩基から遠ざけていることを示唆していた。シッフ塩基はKR2を含め、あらゆるイオン輸送型ロドプシンのイオン輸送経路の中心に位置しているため、シッフ塩基に結合したH+は陽イオンの輸送においてエネルギー的な障壁となりうる。そのため、Asp116のH+化、およびその側鎖の構造変化は、イオン輸送経路からH+を一時的に隔離することでNa+の輸送を可能にしているのではないかと考えられた(図7)。既に分光学的、生化学的手法を用いた分析により、Asp116がシッフ塩基からH+を受け取ること、そのH+移動がNa+輸送に必須であることが示されていた[7][7] K. Inoue, H. Ono, R. Abe-Yoshizumi, S. Yoshizawa, H. Ito et al.: Nat. Commun. 4 (2013) 1678.。そのため我々は、Asp116へのH+移動だけではなく、続く側鎖の構造変化もまた重要であることを示すため、H+化されたAsp116が水素結合を形成するAsn112、Ser70の変異体を複数作成し、そのNa+輸送能を調べた。その結果、D112N、S70Tといった、Asp116との水素結合を維持できる変異体はNa+輸送能を保持している一方で、D112A、S70Aといった変異体ではNa+輸送能が完全に失われることが判明した。このことは、Asp116のH+化、側鎖の構造変化の両方がNa+輸送に必須であることを強く示唆しており、先述した我々のゲーティングモデルを支持していた。
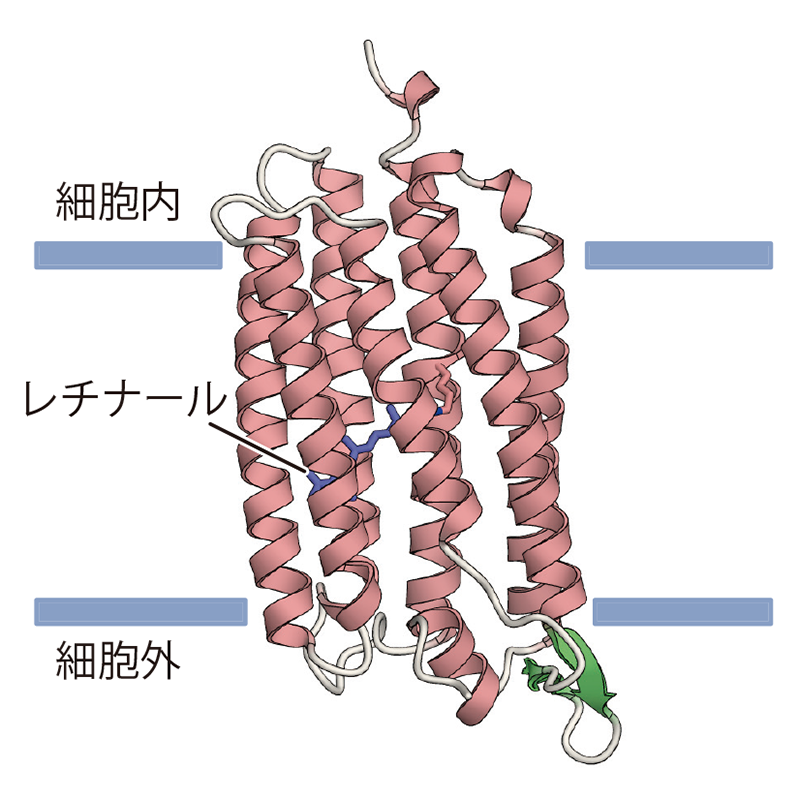
図5 KR2(単量体)の全体構造。

図6 (左)中性条件、(右)酸性条件におけるKR2のシッフ塩基周辺構造。黒破線は水素結合を示す。
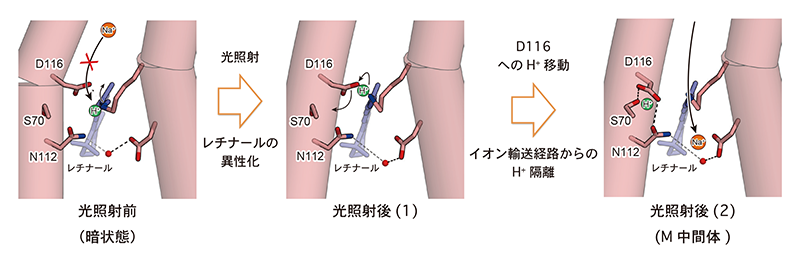
図7 KR2によるNa+輸送モデル。レチナールの異性化に伴いシッフ塩基に結合したH+がAsp116に受け渡され、H+化されたAsp116はAsn112とSer70と水素結合を形成することでNa+輸送に必要なエネルギー障壁を下げる。
KR2はNa+に対する高いイオン選択性を持っており、生理的条件下ではK+やCa2+といった他の陽イオンを輸送しない。しかし、Asp116の構造変化を中心とした我々のゲーティングモデルではKR2が陽イオンを輸送することを説明できてもNa+に対して高い選択性を示すことは説明できなかった。そこで我々は、KR2はイオン輸送経路の中心であるシッフ塩基近傍とは別の場所にNa+を選択する構造基盤を有しているのではないかと考えた。我々は、輸送経路を構成しているTM1、2、3、7の細胞内側のアミノ酸残基に変異を導入し、そのイオン輸送能と選択性を測定した。その結果、N61、G263に変異を導入することによりKR2がNa+だけではなくK+を輸送するようになることが判明した。中でも特筆すべきことは、N61P/G263Wの二重変異体がNa+よりもK+を選択的に輸送したことである。これは、我々がKR2の構造を元に光駆動性K+輸送体を創製したということに他ならず、未だ自然界より発見されていない輸送体を作成することができたというのは意義深いことであった。
最後に我々は、KR2が抑制性のオプトジェネティクスツールとして利用可能であるかを検証した。KR2を発現させたラットの大脳皮質神経細胞を注入電流により強制的に興奮させ、これに緑色光を照射したところ、KR2の働きによって神経細胞の興奮が完全に抑制されることがわかった。また、線虫の運動神経にKR2を発現させ、光照射の前後で線虫の移動速度を測定したところ、KR2由来の電流によって神経細胞の活動が抑制された結果、線虫の運動行動が抑制されることが判明した。
以上の結果は、KR2によるゲーティング機構を明らかにしたのみならず、これがオプトジェネティクスツールとして利用可能であることを示した点、更には立体構造情報を元に自然界には存在しなかった光駆動性K+輸送体を創製した点などから評価され、Nature誌のArticleに掲載された[8][8] H. E. Kato, K. Inoue, R. Abe-Yoshizumi, Y. Kato, H. Ono et al.: Nature 521 (2015) 48-53.。
謝辞
本研究の1章はStanford大学のKarl Deisseroth教授ら、名古屋大学のAndrés Maturana准教授ら、京都大学の林重彦教授ら、SPring-8の平田邦生博士、Humboldt大学のPeter Hegemann教授らとの共同研究、2章は京都大学の林重彦教授ら、名古屋大学のAndrés Maturana准教授ら、SPring-8の平田邦生博士、名古屋大学の山中章弘教授ら、岡山大学の須藤雄気教授らとの共同研究、3章は名古屋工業大学の神取秀樹教授ら、東北大学の八尾寛教授ら、名古屋大学のAndrés Maturana准教授ら、東京大学の木暮一啓教授ら、SPring-8の山下恵太郎博士、東京大学の飯野雄一教授らとの共同研究である。また、X線回折像の取得は、1章のChRのNative dataを除き、全てSPring-8のBL32XUにおいて行った(1章のChRのNative dataはSLS X06SAにて取得した)。この場を借りて深くお礼申し上げる。
参考文献
[1] H. E. Kato, F. Zhang, O. Yizhar, C. Ramakrishnan, T. Nishizawa et al.: Nature 482 (2012) 369-374.
[2] A. Berndt, S. Y. Lee, C. Ramakrishnan and K. Deisseroth: Science 344 (2014) 420-424.
[3] J. Wietek, J. S. Wiegert, N. Adeishvili, F. Schneider, H. Watanabe et al.: Science 344 (2014) 409-412.
[4] H. E. Kato, M. Kamiya, S. Sugo, J. Ito, R. Taniguchi et al.: Nat. Commun. 6 (2015) 7177.
[5] M. Mahn, M. Prigge, S. Ron, R. Levy and O. Yizhar: Nat. Neurosci. 19 (2016) 554-556.
[6] H. Okumura, M. Murakami and T. Kouyama: J. Mol. Biol. 351 (2005) 481-495.
[7] K. Inoue, H. Ono, R. Abe-Yoshizumi, S. Yoshizawa, H. Ito et al.: Nat. Commun. 4 (2013) 1678.
[8] H. E. Kato, K. Inoue, R. Abe-Yoshizumi, Y. Kato, H. Ono et al.: Nature 521 (2015) 48-53.
Stanford University, School of Medicine, Department of Molecular and Cellular Physiology
163B Beckman Center, 279 Campus Drive, Stanford, CA, 94305, USA
TEL : (+1) 650-441-9956
e-mail : hekato@stanford.edu








