Volume 21, No.4 Pages 267 - 271
1. 最近の研究から/FROM LATEST RESEARCH
長期利用課題報告
膜能動輸送体の結晶学的研究
Crystallographic Studies of Active Membrane Transporters
東京大学 分子細胞生物学研究所 Institute of Molecular and Cellular Biosciences, The University of Tokyo
- Abstract
- 細胞内外のイオン濃度勾配は、神経の電気信号や浸透圧調節、物質輸送のためのポテンシャルエネルギーに使われ、生命活動の基盤に必須のものである。ナトリウムポンプは、ATP1分子当たり3個のNa+を細胞内から細胞外へ、2個のK+を細胞外から細胞内へ能動輸送し、イオン濃度勾配を形成する膜蛋白質である。我々は、2009年にK+と結合した状態のナトリウムポンプの構造を決定したが、今回、Na+と結合した状態の構造を2.8 Å分解能で決定し、3個のNa+が結合した様子を詳細に明らかにすることに成功した。その結果、どのようにしてナトリウムポンプがNa+を選択的に輸送できるのか、その巧妙な仕組みを明らかにすることができた。
1. はじめに
2013A期からBL41XUを利用して、長期利用課題「膜能動輸送体の結晶学的研究」を遂行した。この長期利用課題は、ポンプ蛋白質のイオン能動輸送機構の原子構造に基づいた完全な理解を目指すもので、具体的には以下の4つのテーマからなる。(i) 10年以上にわたって追及してきた筋小胞体カルシウムポンプの反応サイクルの全ての中間体の結晶構造を明らかにすること、また今やカルシウムポンプの大量発現・精製が可能になったので、その変異体、調節蛋白質との複合体、心筋カルシウムポンプの構造解析を進めること、 (ii) 医学的にはより重要で、激しい国際競争が続いているナトリウムポンプの反応中間体や薬剤複合体の結晶解析を進めること、(iii) 植物のプロトンポンプであり、ATPの代わりにピロ燐酸をエネルギー源とするH+-PPaseの構造研究を進めること、(iv) コントラスト変調法や重原子同型置換法を用いて膜蛋白質結晶の脂質二重膜を可視化すること、である。この4つのテーマに関していずれも大きな進展があったが、(ii)に関してNa+が結合した状態のナトリウムポンプの構造をNature誌に発表したので[1][1] R. Kanai, H. Ogawa, B. Vilsen, F. Cornelius and C. Toyoshima: Nature 502 (2013) 201-206.、本稿ではその解説を行うことにしたい。
2. ナトリウムポンプとは
全ての細胞は脂質二重膜で外界と仕切られており、イオンは脂質二重膜をほとんど透過できないので、細胞内外のイオン組成は大きく異なる。例えば、Na+は細胞外に豊富(細胞内:5~15 mM、細胞外:145 mM)に存在し、K+は細胞内に多く存在する(細胞内:140 mM、細胞外:5 mM)。細胞内外のイオン濃度勾配は神経の電気信号や浸透圧調節、細胞内外への物質輸送のためのポテンシャルエネルギーとして使われ、生命活動の基盤に必須である。そのイオン濃度勾配の形成を担うのがポンプ蛋白質である。ナトリウムポンプ(Na+,K+-ATPase)は先に触れたNa+とK+の濃度勾配を形成するポンプ蛋白質で、筋収縮に重要な筋小胞体のCa2+の濃度勾配を形成するカルシウムポンプや胃の酸性pHを形成するプロトンポンプなどと同じP型ATPaseファミリーに属する。
P型ATPaseは、濃度勾配に逆らって物質を輸送するためにエネルギーを必要とする。そのエネルギーの源としては生体エネルギーの通貨であるATP(アデノシン三燐酸)が使われる。ナトリウムポンプはATP1分子当たり3個のNa+を細胞内から細胞外へ、2個のK+を細胞外から細胞内へ濃度勾配に逆らって輸送する(図1a)。イオン輸送の反応サイクルは、イオンの結合親和性が異なる2つの状態(E1、E2と呼ぶ。)から説明される。E1状態ではNa+に対して高親和性で、イオン結合サイトは細胞質側を向いており、細胞外側ゲートは閉じている。この状態では細胞質側ゲートは開いているので、ナトリウムポンプは細胞質にあるNa+と結合する。この時、ATPも結合すると、ATPのγ位の燐酸基はAsp残基に転移され(燐酸基転移反応)、細胞質側ゲートが閉じる。ナトリウムポンプからADPが遊離すると、直ちにE2状態(イオン結合サイトが細胞外側を向き、Na+に対して低親和性で相対的にK+には高親和性な状態)に変化し、同時に細胞外側ゲートが開く。こうしてNa+は細胞外へ放出され、空いたイオン結合サイトにK+が結合する。すると、今度は燐酸化Aspが加水分解され(脱燐酸化反応)、細胞外側ゲートは閉じる。燐酸が遊離し、再びATPが結合すると、細胞質側ゲートが開くと同時にE1状態に戻り、K+は細胞内へ放出される。
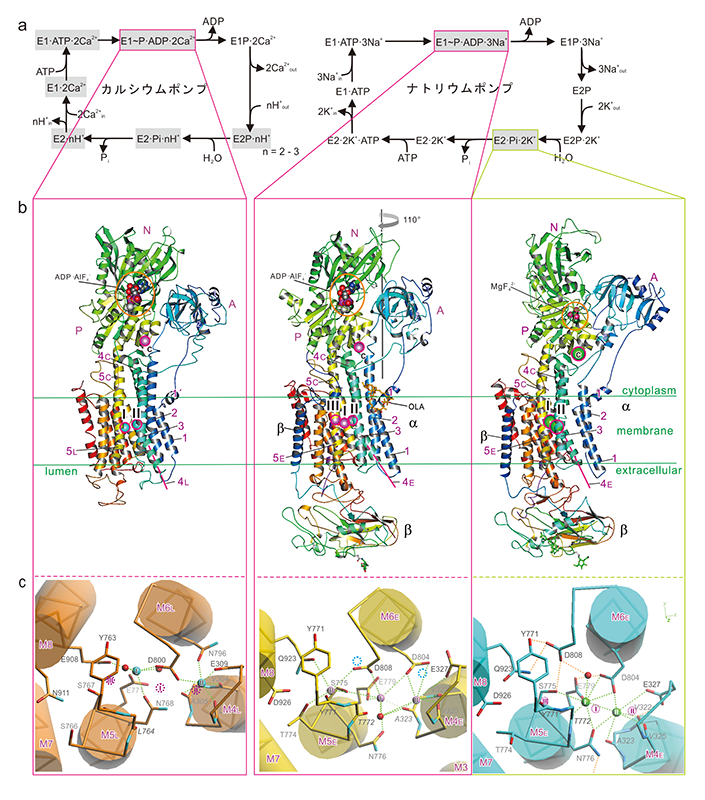
図1 (a) ナトリウムポンプとカルシウムポンプの反応サイクル。(b) 今回決定したE1~P∙ADP∙3Na+状態(中央)と既に明らかになっているE2∙Pi∙2K+状態(右)のナトリウムポンプ、E1~P∙ADP∙2Ca2+状態のカルシウムポンプ(左)の全体構造。膜貫通領域に輸送のためのイオン結合サイト(I~III)がある他に、細胞質側のP-ドメインには安定化に関わる1価陽イオン結合サイト(C)がある。10本ある膜貫通ヘリックス(M1-M10)のうち、M1-M5は1-5でラベルした。ヘリックス番号後ろの“C”は細胞質側、“E”は細胞外側、“L”は筋小胞体内腔側を示す。この向きではFXYDはαサブユニットの裏側に来るため見えない。(c) 膜貫通領域のイオン結合サイトを細胞質側から見た図。Na+, K+, Ca2+、水分子をそれぞれピンク、緑、シアン、赤色の球で示す。紫の点線の円はナトリウムポンプのNa+結合サイトを、シアンの点線の円はカルシウムポンプのCa2+結合サイトを表している。
ナトリウムポンプは、200年以上前から心不全の治療薬として使用されているジギタリス類の標的蛋白質であり、また近年では多くの神経疾患やアルツハイマーとの深い関連も示唆されている。従って、ナトリウムポンプの構造研究は疾患のメカニズムの理解や薬剤開発に極めて重要である。ナトリウムポンプはNa+,K+-ATPaseとも呼ばれるが、実はK+の代わりに様々な1価の陽イオンを細胞内に運ぶことができ、Na+や有機陽イオンさえも運ぶことができる。従って、K+はナトリウムポンプが働く上で必須ではない。一方、Na+の代わりに細胞外へ運べるのはLi+とH+だけである。このようなことからNa+,K+-ATPaseは本質的にはナトリウムポンプである。興味深いのは、E1状態であってもNa+に対する結合親和性は数mMで低いにもかかわらず、厳密にNa+を選別し、かつ3個のNa+が結合した時にのみ燐酸基転移反応が進行して、細胞質側ゲートは閉じる。これまでにナトリウムポンプのE2状態の結晶構造は既に明らかにされているが[2-5][2] J. P. Morth et al.: Nature 450 (2007) 1043-1049.
[3] T. Shinoda, H. Ogawa, F. Cornelius and C. Toyoshima: Nature 459 (2009) 446-450.
[4] H. Ogawa, T. Shinoda, F. Cornelius and C. Toyoshima: Proc. Natl. Acad. Sci. USA 106 (2009) 13742-13747.
[5] H. Ogawa, F. Cornelius, A. Hirata and C. Toyoshima: Nat. Commun. 6 (2015) 8004.、ナトリウムポンプの本質というべきE1状態の構造は報告されていない。一体、3個のNa+結合サイトはどのようなものであろうか?類似のカルシウムポンプは3個のNa+の代わりに2個のCa2+を運ぶ。Ca2+が結合したE1状態のカルシウムポンプの構造は既に明らかになっており、Ca2+に配位するアミノ酸残基はナトリウムポンプでも見事に保存されている。従って、ナトリウムポンプの3個のNa+結合サイトのうちの2個は、カルシウムポンプのCa2+結合サイトと似ていると予測される。しかし、それらのイオン選択性は全く異なり、しかもカルシウムポンプのCa2+の結合親和性は0.1~1 μM程度で極めて高い。なぜ、このような性質の違いが生じるのであろうか?そして、3個目のイオン結合サイトはどこにあるのだろうか?
そこで我々はNa+、ADP、燐酸アナログ(AlF4-。Al3+を中心に4個のF-が平面四角形に配置したもので、遷移状態の燐酸基アナログ。)存在下でE1~P∙ADP∙3Na+状態(3個のNa+が結合し、ATPからγ位の燐酸基がAsp残基に転移される直前の状態で、細胞質側ゲートは閉じている。)のナトリウムポンプを結晶化し、SPring-8のビームラインBL41XUにて2.8 Åの回折データを収集、構造決定に成功した。その結果、ナトリウムポンプはNa+を選択的かつ効率的に運ぶために驚くべき様々な仕組みを備えることが分かった。そして、それはカルシウムポンプのCa2+を運ぶ仕組みとは全く異なっていた。
3. ナトリウムポンプE1~P∙ADP∙3Na+状態の結晶構造解析
図1bには今回明らかにしたE1~P∙ADP∙3Na+状態のナトリウムポンプの全体構造を示す。ナトリウムポンプはカルシウムポンプと相同であるαサブユニット、高度に糖鎖修飾されたβサブユニット、組織特異的調節因子FXYD蛋白質の3つからなる、分子量およそ160 kDaの巨大膜蛋白質複合体である。単量体であるカルシウムポンプに比べて複雑で、しかも脂質として、phosphatidylserineやコレステロールを必要とするなど、結晶化はカルシウムポンプよりもはるかに困難であり、構造決定にはおよそ3年を要した。図1bに示すようにαサブユニットは3つ(A:アクチュエーター、N:ヌクレオチド結合、P:燐酸化)の細胞質ドメインと10本の膜貫通ヘリックス(M1-10)からなる。βサブユニットは細胞質側の短いN末端領域と1本の膜貫通ヘリックス、細胞外側ドメインからなる。FXYD蛋白質も1本の膜貫通ヘリックスを持ち、その前後に数10残基からなるN末端、C末端領域を持つ。
さて、Na+結合サイトに注目すると、カルシウムポンプの2個のCa2+結合サイトI、IIに相当するNa+結合サイトI、IIが存在し、そのNa+結合のcavityの一番奥にサイトIIIが位置していた(図1c, 2)。このNa+結合サイトの構造を詳細に解析すると、3つの重要な特徴が明らかになった。①Na+結合サイトは小さく、かつ揺らぎが小さくなるようにデザインされており、小さなイオン、すなわちNa+(イオン半径 = 0.95 Å。K+は1.33 Å。)しか入れない。②3つのNa+結合サイトはNa+同士でないと結合できないように近接して配置されている。すなわち、K+ではサイズが大きいために、Ca2+では静電的な反発力のためにNa+のように近接して結合できない。ATP1分子当たり3個のNa+を運ぶのは単に効率のためだけでなく選択性のためでもある。③E2状態のK+の結合と同様、最初のNa+はM5ヘリックス(以下、M5と記す。)のほどけた部分に結合する(サイトIII)。M5はポンプ蛋白質の背骨であり、3つある細胞質ドメインの配置を制御している。正しい大きさであるNa+が結合した時だけM5C(M5は膜中央付近でほどけており、M5の細胞質側半分をM5Cと呼ぶ。)の傾きは正しくなり、ATPからの燐酸基転移が可能なように細胞質ドメインが配置する。ドメイン間のヒンジ部分にリガンドが結合した時にのみ反応が起こるようにするのがアロステリック制御の主要な形であるが、ここではそれが正しい大きさのイオンの結合という極限の形で行われ、高い効率と特異性が生み出されていることが明らかになった。また、カルシウムポンプにはない、長いC末端領域とβサブユニットがM5の傾きの精確な制御に貢献していることも示された。
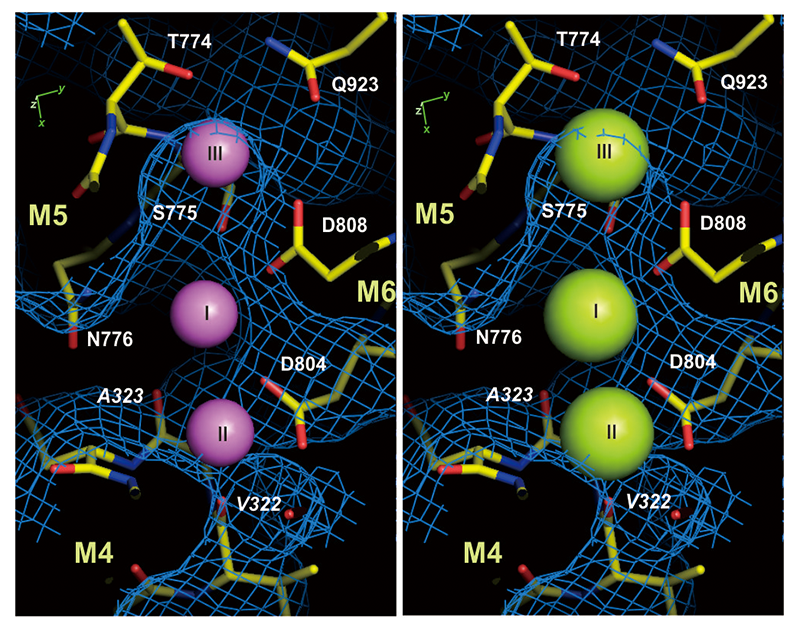
図2 Na+結合サイトのcavityを細胞質側から見た図。青のネットはNa+がアクセスできる蛋白質表面を表す。(左)ピンクの球は正しい大きさで表示したNa+。(右)仮想的にNa+の代わりにK+を置き、K+のイオン半径で表示(緑の球)。Na+はcavityに収まるのに対し、K+は特にサイトII、IIIからはみ出すことが分かる。
ナトリウムポンプではカルシウムポンプに比べて、より多くの主鎖カルボニルがイオン結合サイトに寄与している。しかも、カルシウムポンプでCa2+結合サイトIIに寄与しているM4E(M4も膜中央付近でほどけており、M4の細胞外側半分をM4Eと呼ぶ。ただし、筋小胞体カルシウムポンプは筋小胞体膜に局在し、細胞外ではなく、筋小胞体内腔側を向いているため、M4Lと呼ぶ。)の主鎖カルボニルがナトリウムポンプではNa+結合サイトIとII両方に寄与している。その結果、カルシウムポンプのCa2+結合サイトはヘリックスバンドルの中央にあるのに比べて、ナトリウムポンプのNa+結合サイトはM4E、M5方向にずれている(図1c)のだが、単にそれだけではない。1つは、側鎖に比べて揺らぎが小さい主鎖カルボニルの寄与は、イオン結合サイトのサイズを厳密に制御するのに適していることである。もう1つは、M4EにあるAla323の主鎖カルボニルが、サイトIのNa+結合に寄与することでサイトIIがサイトIに近接したところに形成されることである。
このサイトIとサイトIIの近接は、Ala323のサイトIのNa+結合だけでなく、M4Eが膜に平行な方向により傾いていることにもよる(図3)。これはナトリウムポンプではM4EとM5Eの間でより大きな側鎖の疎水性残基(Phe316、Phe783)同士がコンタクトしているからである。
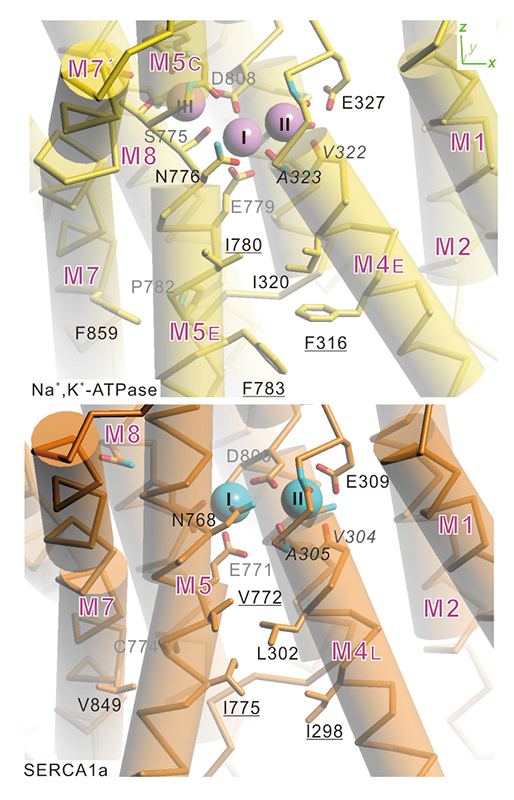
図3 ナトリウムポンプ(上:黄)とカルシウムポンプ(下:オレンジ)の膜貫通領域のイオン結合サイトとM4の傾きの違い。膜に平行に見たもの。ナトリウムポンプのM5は膜中央付近でほどけており、M5CとM5Eに分かれているのに対し、カルシウムポンプのM5は曲がっているものの、連続的な1本のヘリックスである。ナトリウムポンプのM4EとM5の間ではPhe316、Phe783などの大きな側鎖を持つアミノ酸残基がコンタクトしており、M4Eはカルシウムポンプに比べて傾き、サイトIとIIを接近させている。
M6にあるAsp804側鎖はサイトIとサイトIIのNa+に、M5のSer775側鎖とM6のAsp808側鎖はサイトIとサイトIIIのNa+に配位している(図1c)。1個の側鎖が2個のイオン結合に寄与するのは特徴①のイオン結合サイトの大きさを制御し、揺らぎを小さくするのに重要であるだけでなく、3個のNa+結合が段階的に、かつ協調的に起きる仕組みを説明するものである(図4)。すなわち、サイトIIIにNa+がやって来ると、Ser775側鎖とAsp808側鎖が配位すると同時に、サイトIが形成される。そこへ2個目のNa+がやって来ると、Asp804側鎖やAla323主鎖カルボニルが配位して、サイトIIが形成される。そして、3個目のNa+がサイトIIに結合すると、M4Cの位置が変わり、Pドメインが曲がってAsp残基は燐酸化されると考えられる。このようにナトリウムポンプは驚くべき緻密な仕組みでNa+を厳密に選別し、効率的に輸送することが明らかになった。
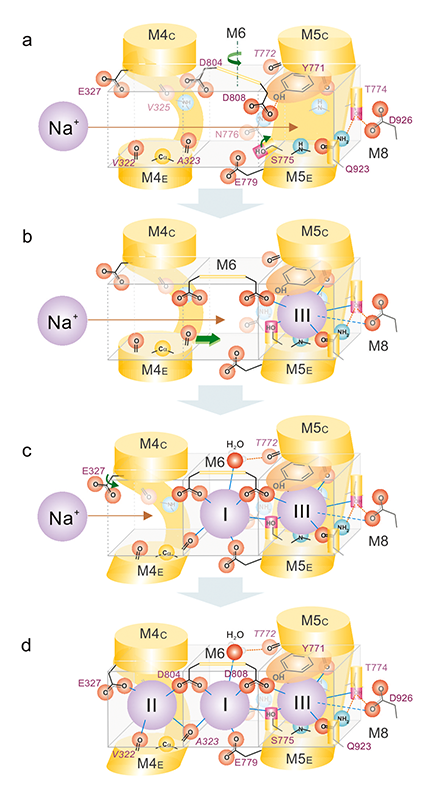
図4 ナトリウムポンプによる段階的、協調的なNa+結合のメカニズム。
謝辞
本研究の回折データは全てSPring-8 BL41XUを利用して得られたものである。ビームラインスタッフの長谷川和也博士、奥村英夫博士にはこの場を借りて深くお礼申し上げる。
参考文献
[1] R. Kanai, H. Ogawa, B. Vilsen, F. Cornelius and C. Toyoshima: Nature 502 (2013) 201-206.
[2] J. P. Morth et al.: Nature 450 (2007) 1043-1049.
[3] T. Shinoda, H. Ogawa, F. Cornelius and C. Toyoshima: Nature 459 (2009) 446-450.
[4] H. Ogawa, T. Shinoda, F. Cornelius and C. Toyoshima: Proc. Natl. Acad. Sci. USA 106 (2009) 13742-13747.
[5] H. Ogawa, F. Cornelius, A. Hirata and C. Toyoshima: Nat. Commun. 6 (2015) 8004.
東京大学 分子細胞生物学研究所
〒113-0032 東京都文京区弥生1-1-1
TEL : 03-5841-8942
e-mail : ryuta-kanai@iam.u-tokyo.ac.jp
東京大学 分子細胞生物学研究所
〒113-0032 東京都文京区弥生1-1-1
TEL : 03-5841-1916
e-mail : haru@iam.u-tokyo.ac.jp
東京大学 分子細胞生物学研究所
〒113-0032 東京都文京区弥生1-1-1
TEL : 03-5841-8492
e-mail : ct@iam.u-tokyo.ac.jp








