Volume 21, No.1 Pages 10 - 15
2. ビームライン/BEAMLINES
共用タンパク質結晶解析ビームラインBL38B1・BL41XUの高度化
Upgrade of the Public Protein Crystallography Beamline BL38B1 & BL41XU
(公財)高輝度光科学研究センター タンパク質結晶解析推進室 Protein Crystal Analysis Division, JASRI
- Abstract
- JASRIタンパク質結晶解析推進室では共用タンパク質結晶解析ビームラインBL38B1・BL41XUの高度化・維持管理・ユーザー支援に加えて理研ビームラインBL26B1の共用枠の利用支援を行っている。近年、構造生命科学分野では、解析対象となる試料の高難度化が進む一方で、構造決定の迅速化も求められている。そこで、我々は、2013年から2015年にかけてBL38B1・BL41XUの高度化を進めてきた。BL38B1ではミニビームシステムの導入・回折計の改造による性能アップを図る一方で、独自開発した湿度調整と水溶性ポリマーを使用した結晶マウント法(HAG法)の利用促進を図るための高度化を進めた。BL41XUでは、6.5~17.7 keVのX線を用いる通常モードの集光光学系・回折計・検出器を入れ替える抜本的な改造を行うとともに、20~35 keVのX線を使用する高エネルギーモードについてもその環境整備を進めた。
1. はじめに
SPring-8には7本のタンパク質結晶解析ビームライン(MXビームライン)が存在する。この内の2本が共用ビームラインで、JASRIのタンパク質結晶解析推進室が高度化・維持管理およびユーザー支援を行っている。
共用ビームラインの特徴は、アカデミックユーザーに加え、海外のユーザー・産業利用(成果専有)などユーザー層が広いことである。そのため、測定の対象となる試料は、ルーチン的にデータ測定が可能な良質な結晶から、測定条件設定がデータ精度に直結する高難度試料まで幅が広い。このような試料に対応するため、偏向電磁石ビームラインBL38B1は主として比較的回折能の良い結晶からのデータ測定、アンジュレータビームラインBL41XUは微小結晶・低品質結晶などの難易度の高い試料の測定を行うことができるように環境整備を進めてきた。本稿では、2013年から2015年にかけて行ったBL38B1とBL41XUの高度化について報告する。
2. BL38B1の高度化
偏向電磁石を光源とするBL38B1は、安定性の高いビームを利用して、効率的かつ高精度なタンパク質結晶の回折データ測定が可能である。それに加えて、試料の化学状態をモニタするオンライン顕微分光装置[1][1] N. Shimizu et al.: J. Synchrotron Rad. 20 (2013) 948-952.と組み合わせた回折データ測定や、独自開発した湿度調整と水溶性ポリマーを使用した結晶マウント法(HAG法)[2][2] S. Baba et al.: Acta Cryst. D69 (2013) 1839-1849.を利用できることが大きな特徴である。今回の高度化においては、測定対象を広げるためのビーム性能の向上・回折計の高度化に加えて、HAG法の利用促進を図るための高度化を行った。
2.1 ミニビームシステムの導入
BL38B1の集光光学系は疑似トロイダルミラー1枚を用いたシンプルなものである。この光学系では、試料位置で100 (H) × 200 (V) µm2、フォトンフラックス9.5 × 1010 (photons/s@1 Å)のビームが得られる。これを4象限スリットでビーム整形することで、30 × 30 × 30 µm3程度の大きさの結晶でも回折実験が十分可能であったが、さらに微小な試料に対応するために、試料の直前にピンホールを置いてビーム整形するミニビームシステム[3][3] R. F. Fischetti et al.: J. Synchrotron Rad. 16 (2009) 217-225.を導入した(図1)。この機構で整形したX線の光子密度はビームサイズに関わらず、1 × 1012 (photons/s/mm2/100 mA@1 Å)以上であり、ユーザーはビームサイズを結晶に合わせて選択することで、試料に当たらない余分なX線由来のバックグラウンドを低減した高精度な実験を行うことが可能となった。また、大きな結晶においても品質の良い部分のみにX線を照射することができるようになった。
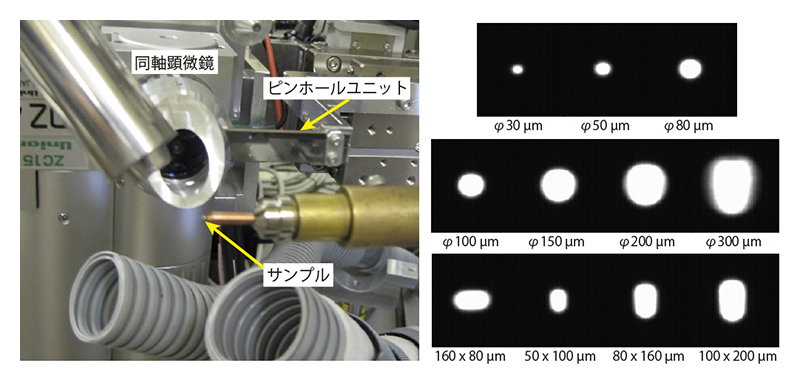
図1 BL38B1に導入したミニビームシステム(左)とこれを用いて得られるビームの形状(右)
ピンホールユニットには1枚のタンタルの板に種々のサイズの穴が空いている。これを光軸上に入れることで様々なビームサイズを得る。
2.2 回折計の高度化
ビーム性能の向上に合わせて回折計の高度化も行った。
これまで利用していた実験定盤は、検出器搭載部と回折計設置部が一体となっていたため、カメラ長を変更するために検出器を移動した際に定盤がたわみ、試料位置でビームのずれが起きた。また、実験定盤の構造強度不足のため、吹き付け低温装置を運転するとその振動が定盤にのることが問題となっていた。これらの問題はミニビームシステムの導入により、より深刻になった。
そこで、検出器定盤と分離した新たな回折計定盤を設計・製作して設置した(図2)。この定盤の吹き付け低温装置支持部は、石定盤を用いて振動対策を施した。これにより振動は見られなくなった。また、検出器部を別の定盤に分離したため、たわみの問題も解決した。さらに、新しい回折計定盤では試料周りにこれまで以上に大きなスペースを取ることができるように設計したため、HAG法で用いる装置の設置が容易になった。

図2 BL38B1の回折計
また、既設のX線減衰用アッテネーターユニットでは、選択可能な減衰率が限られており(Al厚を50 µm刻みで設定)、波長1.5 Åを超えるような長波長側では選択可能な減衰率の間隔が開きすぎて、適切な減衰率を選択できなかった。そこで、新たに3連の省スペース型アッテネーターユニットを導入することで、長波長側でも適切な減衰率(Al: 10 µm, 25~4000 µm間で25 µm刻みで設定)が選択可能になった。
2.3 高感度CCD検出器の導入
より高精度な実験を可能とするために、高感度CCD検出器MX225HE(Rayonix社)を導入した。標準試料を用いたテストデータ測定では、従来の検出器(ADSC社製Q315r)に比べてバックグラウンドノイズが低下しており、回折分解能が0.1 Å程度向上した。検出器面積は315 × 315 mm2から225 × 225 mm2に小さくなったが、最短カメラ長を55 mmまで短くしたことで、測定可能な最大分解能を従来と同程度にすることができた(波長0.8 ÅのX線を用いた場合、0.75 Å分解能まで測定可能)。
2.4 HAG法の高度化
タンパク質結晶の回折データ測定は、X線照射損傷を低減するため100 Kの極低温下で行う。そのためには、結晶を抗凍結剤に浸けて氷の生成を防ぐ必要があるが、品質を損なうことなく結晶を凍結することができる抗凍結剤条件を見つけるのに試行錯誤することがしばしばある。我々が開発したHAG法は、抗凍結剤が不要、あるいは必要としてもごく微量で十分であり、これまで困難であった試料でも容易に凍結できる新しい手法である。
湿度調整気流を吹き付けながら実験を行うHAG法では、この気流を極低温気流に瞬時に切り替えることで結晶の凍結を行う。高度化においてはこの切り替えを自動化する機構を開発し(図3)、BL調整ソフトウェアBeamline Operating Scheduling Software(BOSS)にその機能を装備した。

図3 HAG法利用時の試料周辺部の写真(左)および、湿度調整に使用する調湿装置HUM1(リガク社製)
また、これまで調湿装置の連続運転時間は20時間に満たなかった。そこで、3シフト以上(24時間以上)での運用に対応するため、貯水タンクの大容量化をしつつ、温度・湿度ともに記録可能な新型の調湿装置を導入した。現在、運用に向けてテストを進めている。
3. BL41XUの高度化
BL41XUはSPring-8の運用開始当初から利用されているビームラインである。挿入光源の高強度ビームを利用できることから、膜タンパク質など良質な結晶を得ることが難しい試料の構造決定に貢献してきた[4][4] K. Hasegawa et al.: J. Synchrotron Rad. 20 (2013) 910-913.。しかし、近年ビームラインに持ち込まれる試料の微小化・低品質化がますます進んでいる。このような試料から高精度かつ迅速に構造決定を行うためには、ビーム性能のさらなる向上と、その性能を最大限に生かすための回折計や高速検出器の導入が必要であった。そこで、2014年1~3月の長期点検調整期間を利用して、集光光学系・回折計・検出器を入れ替える大きな改造を行い、2014年5月からユーザー利用を開始した。高度化は6.5~17.7 keVのX線を用いる通常モードだけでなく、20~35 keVのX線を使用する高エネルギーモードについても実施した。
3.1 新しい集光光学系の導入
新しい光学系の設計にあたっては、世界最高レベルのフォトンフラックスを用いて高精度回折データを行えるようにすることと、ユーザーの持ち込む様々な試料に合わせてビームサイズを広い範囲で変更できるようにすることを念頭に置き、目標性能をフォトンフラックス1013 (photons/s)台、ビームサイズを5~50 µmに設定した。
そこでJASRI光源・光学系部門 光学系グループと共同で光学系の仕様策定と設計を進め、図4に示すような、第1水平集光ミラーとKBミラーを組み合わせた水平2段集光光学系を導入した。3枚のミラーには何れも曲率固定のミラーを用いている。ビームサイズの変更を、(1)仮想光源のサイズ変更、(2)試料位置のデフォーカス点への移動、(3)縦集光ミラーの角度変更の組み合わせで行うことが、この光学系の大きな特徴である。
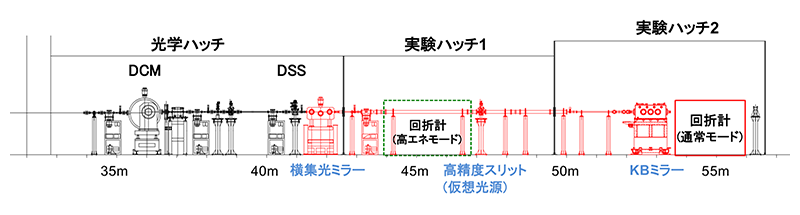
図4 高度化後のBL41XUのレイアウト
改造後に導入したコンポーネントを赤色で示す。通常モードは水平2段集光光学系を使用し、実験ハッチ2を用いて実験を行う。高エネルギーモードは実験ハッチ1を用いて実験を行う。
コミッショニングの結果、波長1 Åの標準的なセッティングにおいてサイズ20 (H) × 2 (V) µm2、フォトンフラックス4 × 1013 (photons/s)のビームが得られた。また仮想光源スリットの開口の変更・試料位置の変更・縦集光ミラーの角度変更を組み合わせることで、2 × 2 µm2~35 (H) × 50 (V) µm2の間でビームサイズを変えることができた。この時のフォトンフラックスは、それぞれ2 × 1012と4 × 1013 (photons/s@1 Å)である。強度・サイズともに目標とするビーム性能を達成することができたといえる。
通常のユーザー利用では、波長を大きく変更しても安定したビームを利用できるよう、最高強度1 × 1013 (photons/s@1 Å)、エネルギー6.5~17.7 keV、ビームサイズ4 (H) × 5 (V) µm2~22 (H) × 45 (V) µm2としている。これ以外のビームサイズやさらに高強度のビームを必要とする測定にも応じている。
3.2 新しい回折計の導入
図5はBL41XUに新しく導入した回折計である。ビームの微小化にともない、振動が回折データ精度に与える影響がより深刻になることから、回折計には耐振動性にすぐれた石定盤を利用した。

図5 新しく導入した回折計と検出器
試料をデフォーカス位置に移動して大きなビームを利用するため、回折計定盤のテーブル面は赤矢印で示すように光軸に沿って並進することが可能である。
この定盤上に構築した回折計は、入射系装置、試料周辺装置、サンプルチェンジャー、ゴニオメーターから構成される。入射系装置は、アッテネーター、シャッター、4象限スリット、および強度モニタから構成され、真空チャンバー内に収納されている。試料周辺装置は、試料観察用同軸顕微鏡、上流光学系からの寄生散乱を抑制するコリメータ、ビームストップなどから構成されている。また、試料位置のビームを確認するための蛍光体および強度モニタも備え付けており、必要に応じて遠隔操作で出し入れすることができる。
サンプルチェンジャーについては、測定の高速化に備えて収納できるサンプル数の大容量化を図り、従来2個であったサンプルカセットの数を、2014年5月には4個に倍増した(カセット1個あたり16サンプルを充填可能)。さらに2015年9月には8個のカセットを装填できるように改良した。これにより、ほとんどのユーザーは、ビームタイムの最初にカセットを装填すれば、実験終了まで交換の必要がなくなった。なお、サンプルチェンジャーの利用率は従来50%程度であった。今回の高度化にともない、ハッチへの出入りによる温度変動の抑制と機器トラブル防止のため、全ユーザーに利用をお願いしている。
3.3 新しい検出器の導入
新しく導入した検出器は、DECTRIS社製のPILATUS3 6Mで、最高100 Hzで連続的に画像を読み取ることができる。そのため、シャッターを開いたままゴニオメーターを定速回転させ、連続的に回折画像を読み取る「シャッターレス測定」が可能である。これは回折画像の動画を撮るような測定方法で、従来のように検出器読み取りにともなう余分な時間がないため、測定速度が速い。これに加えて、シャッターとゴニオメーターの同期が不要でデータ精度が向上するメリットがある。この効果は、一枚の画像あたりのゴニオメーター回転角を小さくした高S/Nデータ測定(微小角振動法)において特に大きい。ある膜タンパク質結晶を用いたデータ測定では、角度ステップ0.3°、露光時間0.1秒、回折画像数450枚の条件で、わずか45秒で良質なデータを得ることができた。
また、光学顕微鏡では視認が困難な試料の位置決めにも威力を発揮している。このような試料では、試料ホルダ内の全領域をX線で走査し、各領域の回折点の数やその強度から、結晶の位置を特定する。これまで利用していたCCD検出器ではこの種の実験は困難だったが、現在は0.5 × 0.5 mm2の領域をわずか3分足らずで走査できるようになった。
3.4 高エネルギーモード
BL41XUは、20~35 keVの高エネルギーX線が利用できる世界でも数の少ない(国内では唯一の)MXビームラインである。水素を可視化する超高分解能データ測定[5][5] K. Takeda et al.: Nihon Kessho Gakkaishi 52 (2010) 14-18.や、この波長域に吸収端を持つ核種の位置の同定とそれを利用した位相決定[6][6] K. Takeda et al.: J. Appl. Cryst. 37 (2004) 925-933.など、他のビームラインで行うことのできない特徴的な研究に用いられてきており、その利用環境の高度化も重要であった。
高度化前は、両モードで共通の光学系・回折計を用いていた。モードの切り替えの際には、集光ミラーの角度を2 mrad程度変更し、その光軸の変化に追従するために回折計を縦横に30 mm程移動させていた。高度化後は、両モードに対してそれぞれ最適化した光学系・回折計を導入することと、モード切り替え時の設定変更を最小限にするため、実験ハッチ1に高エネルギーモード専用の実験環境を設置した(図4、6)。集光光学素子として屈折レンズ、検出器としてCMOSフラットパネルを使用している。

図6 高エネルギーモード用回折計
通常モード使用時は光軸からずらすように待避する。入射系装置内には、シャッター、アッテネーター、強度モニタの他、屈折レンズが収納されている。
高エネルギーモードの立ち上げは、通常モードの立ち上げが一段落した2014年後半より進めてきた。2015B期にファーストユーザーを迎え、0.45 Åを超える超高分解能データの測定に成功している。
4. まとめ
BL38B1ではミニビームシステムにより、試料に合わせたビームサイズの変更範囲を拡大し、より多くの測定対象での利用が進んだ。現在、さらなるビーム性能の向上を図るために、光源・光学系部門 光学系グループの協力のもとで非対称結晶を用いた分光器の導入を進めている。独自開発したHAG法の利用は年々増え、今では5割以上のユーザーが利用している。また、2015年11月からは理研ビームラインBL26B1でも利用可能になっている。
BL41XUでは、高度化により標準的な測定時間が10分から3分に短縮され、測定の効率が飛躍的に向上した。一例として6時間のビームタイムで47セットのデータを取得した研究グループもある。これを踏まえて2015A期より最小4時間でのビーム配分を行っている。また、ビーム性能の向上によりこれまで困難であった5 µm程度の結晶からデータ測定ができるようになった。このほか、サイズの大きなビームと大きな結晶を組み合わせた高難度試料の高分解能測定も試みられている。高度化から2年が経ち、著名な雑誌に成果が掲載され始めており、高度化の効果が現れつつあるといえる[7-9][7] D. Zhang et al.: Nature 520 (2015) 317-321.
[8] H. Nishimasu et al.: Cell 162 (2015) 1113-1126.
[9] N. Nomura et al.: Nature 526 (2015) 397-401.。
タンパク質結晶解析推進室では、このような高度化・技術開発に加えて、本分野のユーザーの利用形態に合わせるために2015A期より課題運用制度も変更し、成果の増大を図っている[10][10] http://www.spring8.or.jp/ja/users/proposals/call_for/protein_16a/。また、より多くのユーザーがSPring-8のMXビームラインにアクセスできるようにするために、2015A期より理研ビームラインBL26B1の共同利用枠を20%から80%に増やし、その利用支援も行っている。
5. 謝辞
BL41XUの集光光学系の設計・立ち上げに際しては、光源・光学系部門 大橋治彦博士、仙波泰徳博士、湯本博勝博士にご支援・ご協力をいただきました。BL38B1・BL41XUの高度化にともなう機器制御システムの更新にあたっては制御・情報部門 古川行人TLにご支援・ご協力をいただきました。BL41XUの改造では竹下邦和BL装置責任者にご支援・ご協力をいただきました。理化学研究所 山本雅貴博士、平田邦生博士にはBL41XUの高度化の全般にわたりご支援・ご協力をいただきました。
BL41XUの高度化の一部は、文部科学省「創薬等支援技術基盤プラットフォーム」の助成を受けています。BL38B1の高度化については2014A1850、2014B1965、2015A1994の課題を利用しました。BL41XUの高度化には2014A1464、2014B1450、2014B2058、2015A1094、2015A2063、2015B2094の課題を利用しました。
参考文献
[1] N. Shimizu et al.: J. Synchrotron Rad. 20 (2013) 948-952.
[2] S. Baba et al.: Acta Cryst. D69 (2013) 1839-1849.
[3] R. F. Fischetti et al.: J. Synchrotron Rad. 16 (2009) 217-225.
[4] K. Hasegawa et al.: J. Synchrotron Rad. 20 (2013) 910-913.
[5] K. Takeda et al.: Nihon Kessho Gakkaishi 52 (2010) 14-18.
[6] K. Takeda et al.: J. Appl. Cryst. 37 (2004) 925-933.
[7] D. Zhang et al.: Nature 520 (2015) 317-321.
[8] H. Nishimasu et al.: Cell 162 (2015) 1113-1126.
[9] N. Nomura et al.: Nature 526 (2015) 397-401.
[10] http://www.spring8.or.jp/ja/users/proposals/call_for/protein_16a/
(公財)高輝度光科学研究センター タンパク質結晶解析推進室
〒679-5198 兵庫県佐用郡佐用町光都1-1-1
TEL : 0791-58-0833
e-mail : kazuya@spring8.or.jp
(公財)高輝度光科学研究センター タンパク質結晶解析推進室
〒679-5198 兵庫県佐用郡佐用町光都1-1-1
TEL : 0791-58-0833
e-mail : baba@spring8.or.jp








