Volume 20, No.4 Pages 324 - 327
1. 最近の研究から/FROM LATEST RESEARCH
グリースマトリックス法による連続フェムト秒結晶構造解析
Grease Matrix Method for Serial Femtosecond Crystallography
国立研究開発法人理化学研究所 放射光科学総合研究センター SACLA利用技術開拓グループ SACLA Science Research Group, RIKEN SPring-8 Center
- Abstract
- X線自由電子レーザーを用いた連続フェムト秒結晶構造解析は、これまで課題だったタンパク質試料の放射線損傷の問題を回避することができ、またナノメートル~マイクロメートルサイズのタンパク質微小結晶からの構造決定を可能にする。しかしながら、これまでタンパク質結晶を連続的にX線レーザーの照射ポイントに供給するには液状の試料を速い流速で吐出するため(液体ジェット法)、結果として大量の試料が必要であった。我々はX線自由電子レーザー施設SACLAを用い、タンパク質結晶を高粘度物質のグリースに混ぜることで低速で試料を押し出すサンプル供給法「グリースマトリックス法」の開発に成功した。本手法では、必要な試料が1 mg以下と従来の液体ジェット法の1/10~1/100程度であり、試料タンパク質が少量でも結晶構造を決定することができる。
1. はじめに
原子分解能でのタンパク質三次元立体構造はタンパク質の機能を理解する上で重要な情報源の一つである。その立体構造を高分解能で決定する方法としては、タンパク質結晶を用いたX線結晶構造解析が適している。大型放射光施設の光を用いる場合、一般に約30 µm以上のタンパク質結晶が必要である。しかしながら、現状の結晶化手法では30 µm以上の大きなタンパク質結晶を得るのは容易ではない。特に創薬などの研究用途で重要なヒトを含む動物由来のタンパク質は、結晶化に使用できる十分な量を得るのが難しく、析出する結晶も回折実験に適した十分なサイズに成長しにくい。また、回折実験においては、タンパク質結晶に放射線損傷を与えてしまうことも大きな問題であった。
X線自由電子レーザー(XFEL:X-ray Free-Electron Laser)の光は、SPring-8の放射光より10億倍もピーク輝度が高いため、ナノメートル~マイクロメートルサイズのタンパク質微小結晶での構造解析ができる。現在、稼働中のXFEL施設は、理研の「SACLA(SPring-8 Angstrom Compact Free Electron Laser)」と米国のSLAC国立加速器研究所の「LCLS(Linac Coherent Light Source)」があり、また欧州やアジアの国々でXFEL施設の建設計画が進行中である。
SACLAの10フェムト秒以下という超短時間でのX線レーザーの照射により、タンパク質が壊れる前に微結晶からの回折イメージを検出できる(diffraction-before-destructionと呼ばれている)。このXFELの特性を利用した主なタンパク質の構造決定法として、連続フェムト秒結晶構造解析(SFX:Serial Femtosecond Crystallography)[1][1] H. N. Chapman, P. Fromme, A. Barty, T. A. White, R. A. Kirian et al.: Nature 470 (2011) 73-77.が注目されている(図1a)。SFXでは、主にジェットインジェクターと呼ばれる装置から噴出した多数の微小結晶を含む液体にX線レーザーを照射し、各結晶からの回折データを連続的に収集する(液体ジェット法)。SFXは常温で実験を行えるため、従来の100 K程度の低温条件下で行う回折実験とは異なり、生理条件(生体内)に近い条件で構造を得ることができる。

図1 連続フェムト秒結晶構造解析(SFX)、およびグリースマトリックス法。(a) SFX概念図。X線レーザーの照射ポイントにタンパク質微結晶を連続的に供給する。(b) グリースマトリックス法では、タンパク質結晶含有グリースをインジェクターから低速で押し出す。
しかしながら、液体ジェット法によりタンパク質結晶を連続的にX線レーザーの照射ポイントに供給するには、安定したサンプルストリームを保つために流速を速くしなければならなく、結果として大量の試料が必要であった。また、高濃度塩を含む試料では実験中にインジェクターノズル付近に塩結晶が析出し、サンプルストリームの妨げになることが問題であった。本稿ではこれら問題を解決するために開発した「グリースマトリックス法」を紹介する。
2. 実験手法、および結果
生体膜に存在する膜タンパク質をターゲットとしてSFXを行う場合、脂質キュービック相(LCP:Lipidic Cubic Phase)法と呼ばれる結晶化法が適している。LCPの高粘度環境下にあるタンパク質結晶をそのままサンプルインジェクターからゆっくり押し出すことで、非常に少量の試料で構造決定に必要なデータを収集できる[2][2] U. Weierstall, D. James, C. Wang, T. A. White, D. Wang et al.: Nature Communications 5 (2014) 3309.。しかしながら、全てのタンパク質結晶をLCP法で得るのは困難であり、LCP法以外の結晶化法から得た結晶でもSFX実験ができる結晶供給手法の開発が必要であった。
そこで我々は、結晶輸送媒体としての高粘度物質とタンパク質微結晶を混ぜ合わせることで、X線レーザーの照射ポイントに低速で安定して結晶を供給できる手法を検討した。その際、高粘度物質に必要とされる以下の条件を考慮した。
①タンパク質結晶と混合しても結晶に損傷を与えないこと。
②高濃度の塩や高粘度の試薬を含む微小結晶溶液と混合してもインジェクターから安定に試料を流せること。
③高粘度物質由来の回折バックグラウンドノイズが低いこと。
④インジェクターノズルでの目詰まりを起こさないために、高粘度物質内で微結晶が凝集せず均一に分散すること。
我々は、これらの条件を満たす高粘度物質を調査した結果、タンパク質結晶の輸送媒体として鉱物油ベースのグリース(#761, AZ Co.)が利用できることを見出し、これをインジェクターに充填して測定する方法「グリースマトリックス法」[3][3] M. Sugahara, E. Mizohata, E. Nango, M. Suzuki, T. Tanaka et al.: Nature Methods 12 (2015) 61-63.を開発した(図1b)。タンパク質X線結晶構造解析において、オイルはタンパク質結晶の汎用的クライオプロテクタントとしてよく用いられており、多くの場合タンパク質結晶に損傷を与えないことが知られている。したがって、SFXにおける汎用的結晶輸送媒体としてのグリースの利用が期待できる。
今回、リゾチーム、グルコースイソメラーゼ、ソーマチン、および脂肪酸結合タンパク質(FABP3)の4種類の水溶性タンパク質の結晶(サイズ約7~30 µm、その一例 図2)を用い、グリースマトリックス法を利用したSFX実験をSACLAのビームラインBL3にて行った。測定はチャンバー、シリンジインジェクター、および検出器を統合したシステムであるDAPHNIS[4][4] K. Tono, E. Nango, M. Sugahara, C. Song, J. Park et al.: Journal of Synchrotron Radiation 22 (2015) 532-537.を用いて行った。測定波長1.24 Å、繰り返し周波数30 Hz、チャンバー内温度21~24℃、湿度2~9%で測定を行った。各サンプル30 µl程度を内径110 µmのシリンジニードルから吐出させ、約1時間の測定時間で約10万枚のイメージを収集した(サンプル流速0.46~0.48 µl/min)。我々はグリースマトリックス法を用いることで、良質回折イメージを得ることができた(図3)。それらイメージはSFXデータを処理するためのプログラムCrystFEL[5][5] T. A. White, R. A. Kirian, A. V. Martin, A. Aquila, K. Nass et al.: J. Appl. Cryst. 45 (2012) 335-341.を使用し、最終的に各サンプルで1万~3万枚の指数付け可能な回折イメージを得た。

図2 SFXで使用したリゾチーム結晶の写真。SACLAでのSFX実験では、一般にサイズ10~30 µmのタンパク質結晶を使用する。
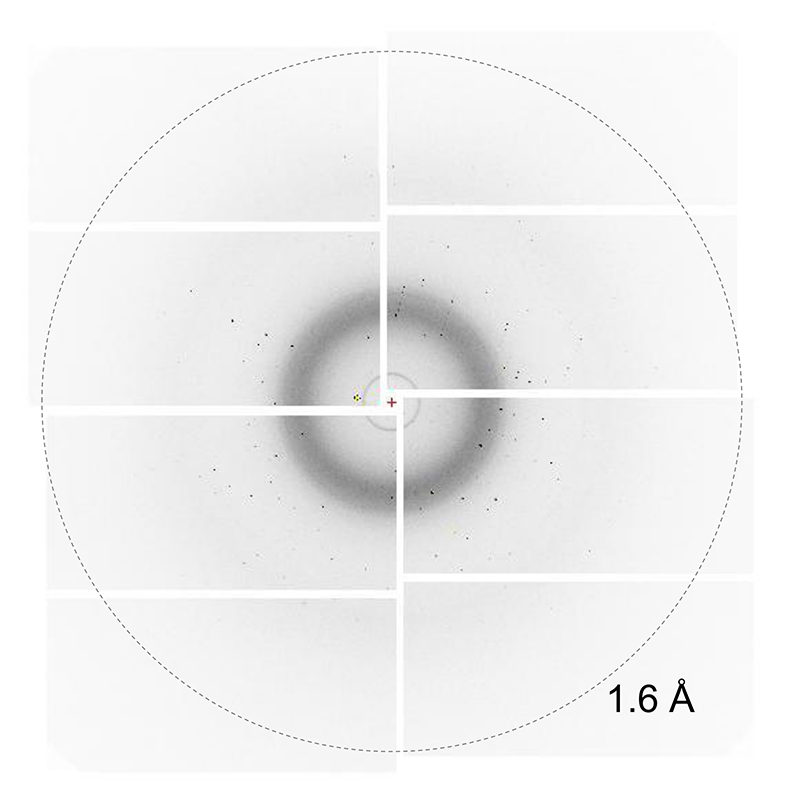
図3 グリースマトリックス法を利用したSFXより得られたリゾチーム結晶からの回折イメージの一例。
各タンパク質サンプルにおいて、結晶構造の評価に十分な回折分解能2 Å以上の回折データセットの収集に成功し、それらタンパク質結晶構造を決定した。その一例としてリゾチームの結晶構造を図4に示した。SFX実験による構造決定で使用した各試料タンパク質は1 mg以下であり、従来の液体ジェット法に比べ1/10~1/100の少量化に成功した。また内径110 µmのシリンジニードルを使用した場合、測定に最適なサンプルの結晶密度は107個/mlであった。使用した各サンプルは高濃度塩、もしくは高濃度のポリエチレングリコールを含んでいるが、本グリースマトリックス法においてはそれら溶液の組成に大きく影響されることなく安定にサンプルを流すことができた。
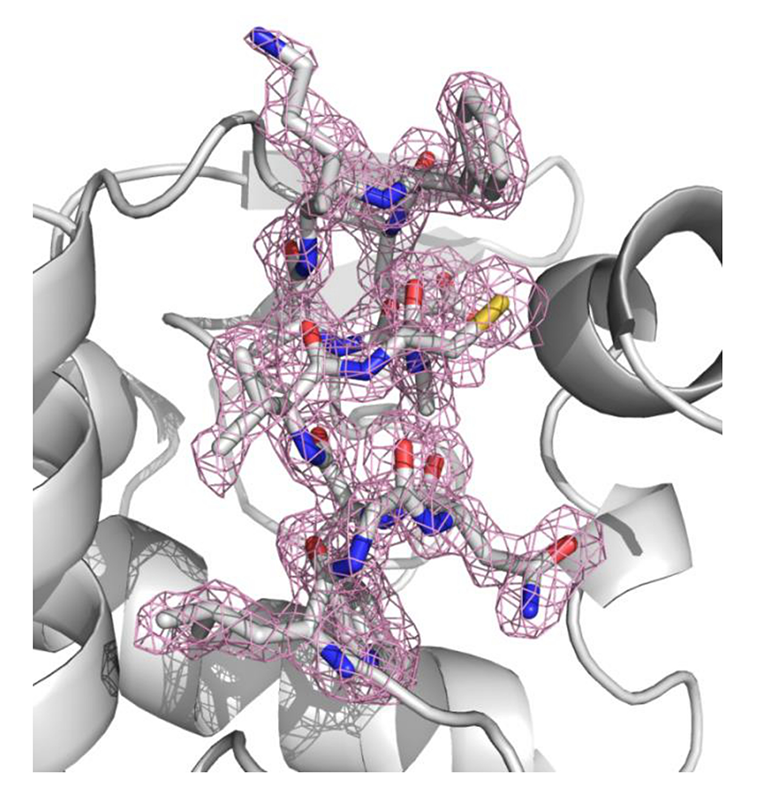
図4 SFXにより決定した2.0 Å回折分解能でのリゾチームの結晶構造。図中のピンク色のメッシュは電子密度(2FO-FCマップ、1.0 σレベル)、メッシュ内スティックモデルの青色は窒素原子、赤色は酸素原子、灰色は炭素原子、および黄色は硫黄原子を示す。
次に、結晶サイズ7~10 µmのリゾチーム結晶を用い、内径50 µmのシリンジニードルからのサンプル吐出を行った。その結果、内径50 µmのニードルでも安定にタンパク質結晶をX線レーザー照射ポイントに供給することができ、内径110 µmのニードル使用時と同様に、回折分解能2.0 Åのデータ収集に成功した。細い径のニードルの使用はサンプル消費量の大幅な低減に加えて、グリース由来の回折バックグラウンドノイズを低減する。
現在、さらなるSN比向上を目指して、よりバックグラウンドノイズの低い結晶輸送媒体を調査している。その一例として、鉱物油ベースのグリースと比較して、より低いバックグラウンドノイズの合成グリース(Super Lube, #21030, Synco Chemical Co.)を導入したSFX実験を進めている。
3. まとめ
我々はSACLA利用研究課題において、タンパク質結晶を高粘度物質のグリースに混ぜることで低速で試料を押し出すサンプル供給法「グリースマトリックス法」の開発に成功した。本手法では、必要な試料が1 mg以下と従来の液体ジェット法の1/10~1/100程度であり、少量のタンパク質での結晶構造解析を可能にした。これまで、グリースマトリックス法を利用することで、20種以上のタンパク質サンプルからの良質回折データ収集に成功している。本手法は少ないサンプル消費量で、一定速度で安定したサンプル供給が可能であるため、今後、SACLAの10フェムト秒以下という超短時間のX線レーザーパルスを用いたSFXにより、酵素反応などに伴う一連の構造変化が起きるフェムト秒~ピコ秒間の反応過程等の観察が期待できる。また、本研究で開発したグリースマトリックス法を用いたSFXは、タンパク質結晶のみを研究対象として限定するものではなく、有機、無機物質を問わず幅広い研究分野への応用が期待できる。
本研究はX線自由電子レーザー施設重点戦略課題推進事業「創薬ターゲット蛋白質の迅速構造解析法の開発」(代表:岩田想)により、SACLA 2012B8036、2013A8039、2013A8040、2013B8044、2013B8045、2014A8032課題にて実施された。
参考文献
[1] H. N. Chapman, P. Fromme, A. Barty, T. A. White, R. A. Kirian et al.: Nature 470 (2011) 73-77.
[2] U. Weierstall, D. James, C. Wang, T. A. White, D. Wang et al.: Nature Communications 5 (2014) 3309.
[3] M. Sugahara, E. Mizohata, E. Nango, M. Suzuki, T. Tanaka et al.: Nature Methods 12 (2015) 61-63.
[4] K. Tono, E. Nango, M. Sugahara, C. Song, J. Park et al.: Journal of Synchrotron Radiation 22 (2015) 532-537.
[5] T. A. White, R. A. Kirian, A. V. Martin, A. Aquila, K. Nass et al.: J. Appl. Cryst. 45 (2012) 335-341.
国立研究開発法人理化学研究所 放射光科学総合研究センター SACLA利用技術開拓グループ
〒679-5148 兵庫県佐用郡佐用町光都1-1-1
TEL : 0791-58-2871
e-mail : msuga@spring8.or.jp
国立研究開発法人理化学研究所 放射光科学総合研究センター SACLA利用技術開拓グループ
〒679-5148 兵庫県佐用郡佐用町光都1-1-1
TEL : 0791-58-2871
e-mail : nango@spring8.or.jp








