Volume 20, No.3 Pages 237 - 240
1. 最近の研究から/FROM LATEST RESEARCH
X線自由電子レーザーを用いた生きた細胞のナノイメージング
Live Cell Nano-Imaging Using X-ray Free-Electron Laser
[1]北海道大学 電子科学研究所 Research Institute for Electronic Science, Hokkaido University、[2](公財)高輝度光科学研究センター XFEL 利用研究推進室 XFEL Utilization Division, JASRI、[3]台湾中央研究院 物理研究所 Institute of Physics, Academia Sinica
- Abstract
- SACLAが発生する極めて短い発光時間のコヒーレントX線を利用して、生きた細胞を、放射線損傷なく、ナノイメージングすることに成功した。実験ではパルス状コヒーレントX線溶液散乱(PCXSS)法と名付けた独自構築したコヒーレントX線イメージング手法を用いた。PCXSS法では、溶液試料を独自開発したマイクロ液体封入アレイ(MLEA)チップ中に、環境を制御して保持する。SACLAを用いた生きた細胞のPCXSS測定により、高密度のDNAの存在を示唆する内部構造などが定量的にイメージングされた。PCXSS法は生物試料のみならず、溶液中で機能する物質材料のナノレベル観察にも極めて有効である。
1. はじめに
生物試料に対する電子顕微鏡やX線顕微鏡による高分解能イメージングにおいては、放射線照射による試料損傷が、空間分解能を制限する要因として大きな問題となってきた。放射線損傷を低減するために、これまで、試料を極低温に保つ対策が広く行われてきた。X線自由電子レーザー(XFEL)の発光時間(パルス幅)は、フェムト秒(10-15秒)オーダーと、試料の放射線損傷が顕著に起こる時間スケールよりも短い。このため、従来技術では不可能であった、放射線損傷のない測定が可能となる[1][1] R. Neutze, R. Wouts, D. van der Spoel, E. Weckert and J. Hajdu: Nature 406 (2000) 752-757.。すなわち、XFELは、試料を時間的に「凍らせる」ことにより、放射線損傷の問題を根源的に解決する道を切り拓いたのである。
生物試料のイメージングでは、画像コントラスト(内部構造の見やすさ)も重要な要素である。細胞などの生物試料の観察では、しばしば、試料を重金属などで染色して画像コントラストを人為的に高めることが行われている。しかし、この方法では、染色した特定の構造は画像コントラストが強調されて見えるが、それ以外の構造を見ることは困難である。また、染色が生物試料の構造に影響を与えることもしばしばである。
細胞などの生物試料を高い画像コントラストで観察できるコヒーレント回折イメージング(CDI)は、回折顕微法とも呼ばれ、SPring-8などの第3世代の放射光を用いて発展してきた[2-5][2] J. Miao, P. Charalambous, J. Kirz and D. Sayre: Nature 400 (1999) 342-344.
[3] 西野吉則、石川哲也:放射光 19 (2006) 3-14.
[4] J. Miao, K. O. Hodgson, T. Ishikawa, C. A. Larabell, M. A. LeGros and Y. Nishino: Proc. Natl Acad. Sci. USA 100 (2003) 110-112.
[5] Y. Nishino, Y. Takahashi, N. Imamoto, T. Ishikawa and K. Maeshima: Phys. Rev. Lett. 102 (2009) 018101.。CDIでは、対物レンズを用いず、測定したコヒーレント回折パターンから計算機を用いて試料像を得る。回折現象を利用するが、従来の結晶構造解析とは異なり、結晶以外の試料もイメージングできるのが特徴である。
CDIとXFELを組み合わせることにより、生物試料を放射線損傷なく、高い画像コントラストでナノイメージングできる。我々は世界に先駆けて、XFELの新たな可能性を示す、生きた細胞のナノイメージング実験に成功した[6][6] T. Kimura, Y. Joti, A. Shibuya, C. Song, S. Kim, K. Tono, M. Yabashi, M. Tamakoshi, T. Moriya, T. Oshima, T. Ishikawa, Y. Bessho and Y. Nishino: Nat. Commun. 5 (2014) 3052.。
2. パルス状コヒーレントX線溶液散乱(PCXSS)
我々は、XFEL回折を用いて生物試料などを溶液中の自然に近い状態で高分解能イメージングできるパルス状コヒーレントX線溶液散乱(PCXSS: Pulsed Coherent X-ray Solution Scattering)法の構築を進めている[6,7][6] T. Kimura, Y. Joti, A. Shibuya, C. Song, S. Kim, K. Tono, M. Yabashi, M. Tamakoshi, T. Moriya, T. Oshima, T. Ishikawa, Y. Bessho and Y. Nishino: Nat. Commun. 5 (2014) 3052.
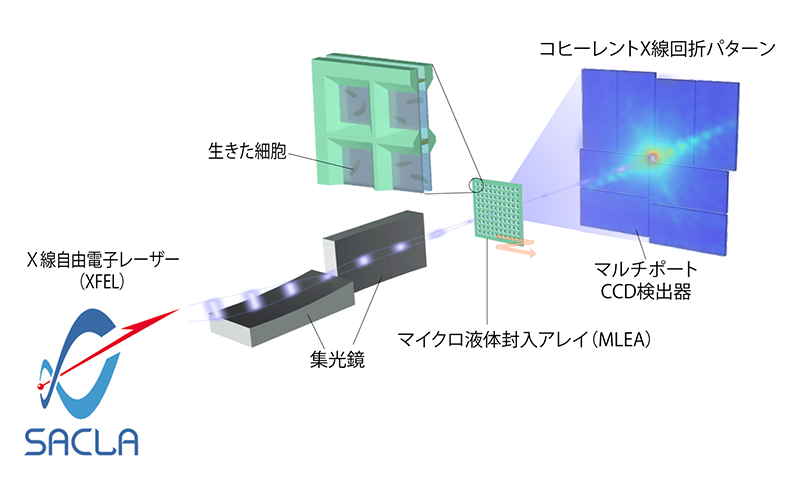
[7] J. Pérez and Y. Nishino: Curr. Opin. Struct. Biol. 22 (2012) 670-678.。ちなみに、PCXSSは、「パックス」と発音する。図1にPCXSSの概念図を示す。
図1 パルス状X線溶液散乱(PCXSS)の概念図
PCXSSでは、マイクロ液体封入アレイ(MLEA: Micro-Liquid Enclosure Array)という独自開発した微小サイズの溶液槽の中に、自然に近い状態で試料を保持する。図2(a)に、我々が開発したMLEAチップを示す。MLEAチップでは、2枚の窒化ケイ素薄膜の間に溶液試料をサンドイッチして、溶液試料を真空から隔てる。MLEAチップの窒化ケイ素薄膜は、XFELのシングルショットで壊れてしまうため、多数のマイクロ液体封入セルを2次元配置する。MLEAチップは、北海道大学オープンファシリティを用いたフォトリソグラフィーにより作製した。
図2 MLEAチップへの生細胞封入実験
XFELを用いたCDI測定では、飛翔した試料ビームを用いる研究グループも存在するが、その場合、XFELのパルスとパルスの間に反応領域を通過した試料は、測定に用いられず無駄になる。これに対して、MLEAチップを用いると、XFELのシングルショット当たりに必要な試料の量は、XFELの繰り返し周波数に依らないため、微量な溶液試料を有効に測定に用いることができる。また、飛翔した試料では、試料環境の制御も困難である。
我々の実験では、Microbacterium lacticumという、牛乳中に生息する熱に強いサブミクロンサイズのグラム陽性菌を用いた。耐熱菌による生乳の汚染は農業において大きな問題となるが、サブミクロンサイズのM. lacticumは、光学顕微鏡での観察は困難なため、細胞生物学的な知見はほとんど得られていない。
我々は、PCXSS実験に先立ち、MLEAチップに生細胞を封入し長時間保持できることを、蛍光顕微鏡を用いて確認した。細胞の生死を確かめることのできる蛍光試薬を用いてM. lacticum細胞を観察した結果を図2(b)、(c)に示す。この蛍光試薬を用いると、生細胞は緑色に発光し、死細胞は赤色に発光する。MLEAチップに生細胞を封入後に、チップを真空中に置き、1時間後に観察しても、99%以上の細胞が生きていることを確認した。これにより、MLEAチップが、XFELを用いた生細胞イメージングにおける試料保持に必要な性能を有することが示された。
3. PCXSS法による生細胞ナノイメージング
PCXSS実験は、SACLAのBL3において行った。光子エネルギー5.5 keVのXFELを、K−Bミラー(1 µmコヒーレント集光装置)を用いて1.5 µm × 2.0 µm(半値全幅)のスポットサイズに集光し、汎用コヒーレントイメージング装置(MAXIC: Multiple Application X-ray Imaging Chamber)内に設置したMLEAチップ中の溶液試料に照射した。MAXIC内には、上流の光学系からの寄生散乱を除去するため、試料上流に2段の4象限スリットを設置した。さらに、我々の実験により、20 µm程の開口を持つMLEAチップの個々のマイクロ液体封入セルが、試料位置でのガードスリットの役割を果たし、上流の光学系からの寄生散乱を低減する事が示された。
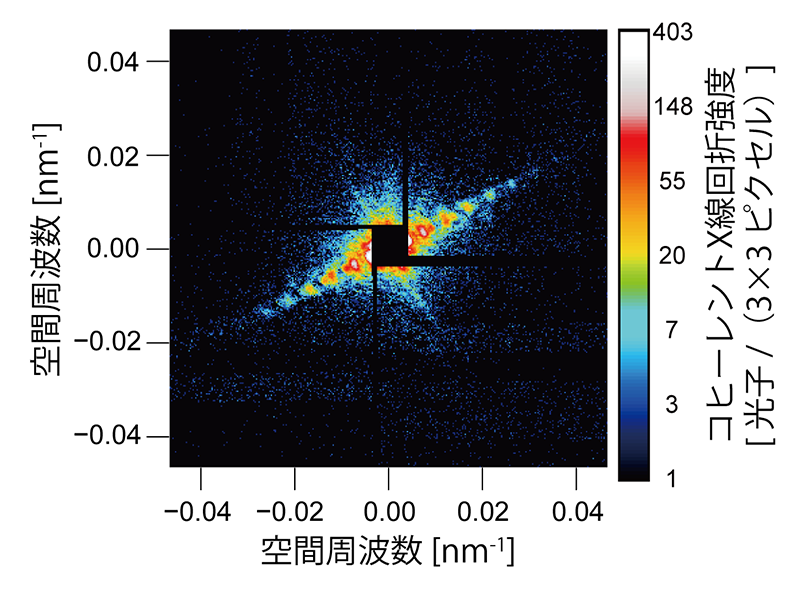
図3にXFELのシングルショットで測定した、放射線損傷のない生きたM. lacticum細胞のコヒーレントX線回折パターンを示す。測定では、試料の下流2.319 mに設置したMultiPort Charge-Coupled Device(MPCCD)のオクタルセンサーを用いた。測定したコヒーレントX線回折パターンには、明瞭な干渉縞が1方向に延びている。干渉縞の間隔から、試料の幅が194 nmであることが分かる。また、干渉縞の最大散乱角から、全周期分解能は28 nmと見積もられる。
図3 生きたM. lacticum細胞にXFELを1パルス当てた際のコヒーレントX線回折パターン
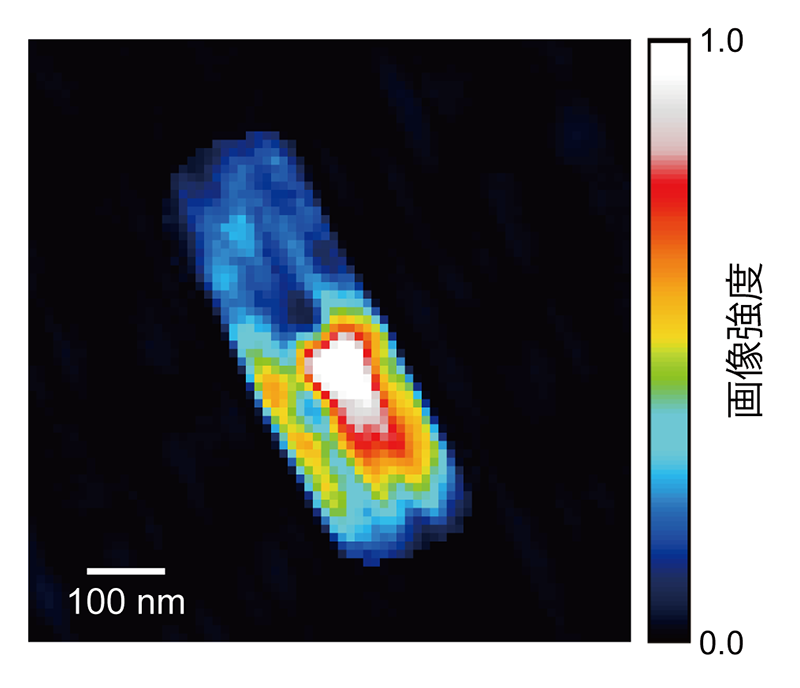
コヒーレントX線回折パターンからの試料像再構成は、Shrink-Wrap、Relaxed Averaged Alternating Reflections(RAAR)アルゴリズムやNoise-Tolerant Hybrid Input-Output(HIO)アルゴリズムを用いて行った。図4に再構成したM. lacticum細胞の像を示す。再構成像は幅およそ194 nm、長さおよそ570 nmのロッド形状で、典型的なM. lacticum細胞のサイズや形状と一致する。位相回復伝達関数(PRTF: Phase Retrieval Transfer Function)を用いて評価した、再構成像の全周期分解能は干渉縞方向でおよそ37 nmである。
図4 XFELで観察した生きたM. lacticum細胞
再構成像において、細胞全体に亘って不均一な内部構造が観察された。細胞下部のイメージ強度が高い部分はダンベル型をしている。このイメージ強度が高い部分には電子密度の高いDNAなどの物質が存在することが示唆される。実際に、細胞の上部がタンパク質で構成され、細胞の下部が核酸で構成されていると単純に仮定し計算すると、それぞれの部分のイメージ強度の差をほぼ説明することができる。
4. まとめ
我々の研究により、PCXSS法が、生きた細胞内部の自然な構造を、重金属等による染色の必要なく、ナノスケールで明らかにできる能力を持つことが示された。現在、細胞の複数のスナップショット像からダイナミクス情報を得るべく、科研費基盤(S)の研究を推進している。また、今後XFELのパルス当たりのフルエンスが飛躍的に増大すれば、PCXSS法は溶液中の生体分子のイメージングにも適用できる。重要なテーマとして、結晶化が難しい生体超分子複合体や天然変性タンパク質などのイメージングが挙げられる。
PCXSS法は、生物試料のみならず、溶液中でのみ構造を保ち、機能を発揮できる物質材料のナノレベル観察にも大きな可能性がある。PCXSS法の物質科学への応用に関して、我々は、産業応用も含め、様々なグループとの共同研究を推進している[8][8] R. Iida, H. Kawamura, K. Niikura, T. Kimura, S. Sekiguchi, Y. Joti, Y. Bessho, H. Mitomo, Y. Nishino and K. Ijiro: Langmuir 31 (2015) 4054-4062.。
謝辞
本研究は、国立研究開発法人理化学研究所の石川哲也センター長、矢橋牧名グループディレクター、Changyong Songチームリーダー、Sangsoo Kim博士、(公財)高輝度光科学研究センターの登野健介チームリーダー、共和化工株式会社環境微生物学研究所の大島泰郎所長、森屋利幸博士、東京薬科大学の玉腰雅忠准教授との共同研究である。
PCXSS測定は、SACLA課題番号2012A8034、2012B8039、2013A8046で行った。PCXSS測定における、SACLAスタッフの支援に感謝する。MLEAチップ作製における、文部科学省ナノテクノロジープラットフォーム事業の支援に感謝する。MLEA組み立てジグは、北海道大学電子科学研究所技術部と共同で開発した。
本研究は、外部資金として、文部科学省X線自由電子レーザー重点戦略研究課題、JST CREST、科研費、物質・デバイス領域共同研究拠点等の支援を受けて実施した。
参考文献
[1] R. Neutze, R. Wouts, D. van der Spoel, E. Weckert and J. Hajdu: Nature 406 (2000) 752-757.
[2] J. Miao, P. Charalambous, J. Kirz and D. Sayre: Nature 400 (1999) 342-344.
[3] 西野吉則、石川哲也:放射光 19 (2006) 3-14.
[4] J. Miao, K. O. Hodgson, T. Ishikawa, C. A. Larabell, M. A. LeGros and Y. Nishino: Proc. Natl Acad. Sci. USA 100 (2003) 110-112.
[5] Y. Nishino, Y. Takahashi, N. Imamoto, T. Ishikawa and K. Maeshima: Phys. Rev. Lett. 102 (2009) 018101.
[6] T. Kimura, Y. Joti, A. Shibuya, C. Song, S. Kim, K. Tono, M. Yabashi, M. Tamakoshi, T. Moriya, T. Oshima, T. Ishikawa, Y. Bessho and Y. Nishino: Nat. Commun. 5 (2014) 3052.
[7] J. Pérez and Y. Nishino: Curr. Opin. Struct. Biol. 22 (2012) 670-678.
[8] R. Iida, H. Kawamura, K. Niikura, T. Kimura, S. Sekiguchi, Y. Joti, Y. Bessho, H. Mitomo, Y. Nishino and K. Ijiro: Langmuir 31 (2015) 4054-4062.
北海道大学 電子科学研究所
〒001-0021 北海道札幌市北区北21条西10丁目
TEL : 011-706-9354
e-mail : yoshinori.nishino@es.hokudai.ac.jp
北海道大学 電子科学研究所
〒001-0021 北海道札幌市北区北21条西10丁目
TEL : 011-706-9342
e-mail : takashi.kimura@es.hokudai.ac.jp
(公財)高輝度光科学研究センター XFEL利用研究推進室
〒679-5198 兵庫県佐用郡佐用町光都1-1-1
TEL : 0791-58-0992
e-mail : joti@spring8.or.jp
台湾中央研究院 物理研究所
128 Sec. 2, Academia Rd., Nankang, Taipei 11529, Taiwan
TEL : +886-2-2789-8934
e-mail : bessho@phys.sinica.edu.tw