Volume 15, No.4 Pages 247 - 251
1. 最近の研究から/FROM LATEST RESEARCH
剛直高分子の希薄溶液に対する放射光小角X線散乱
Synchrotron Radiation Small-angle X-ray Scattering for Rigid Polymers in Dilute Solution
1.はじめに
溶液や固体中における高分子1本鎖の形態は究極的にはそれらの物性(粘弾性や液晶性等)と深く関わっているため、高分子鎖の形態を正確に知ることは、高分子の構造・物性相関の理解の助けとなり、ひいては新規な高分子材料開発の設計指針にもなりうる。ポリエチレンをはじめとする屈曲性の高い高分子では分子鎖の内部回転ポテンシャルを精密に見積もることによって、かなり正確にその分子形態を予測することができる反面、剛直性が高くなるに従い、要求されるポテンシャルの精度も飛躍的に上昇し、正確な形態の予測は困難になる。このような場合には分子の全体構造も測定できる散乱法などの高分子希薄溶液物性からのアプローチが依然有効である。みみず鎖が適用できる場合、高分子鎖を特性化する量は高分子の剛直性(Kuhnの統計セグメント長λ-1)とらせん構造(繰り返し単位当たりのらせんのピッチh)である。本稿では、高分子の化学構造や溶媒と、溶液中における高分子の形態との相関をより精密に知るために著者らが行っている研究の内、高分子内および高分子-溶媒間の相互作用(水素結合や静電的相互作用等)が比較的剛直な高分子の形態にどのように影響するのかについてSPring-8のBL40B2を用いて行ったものを中心に紹介する。高分子の散乱関数を決定するためには溶液の散乱関数から溶媒の散乱関数を差し引く必要があるが、1分子の形態を知るためには希薄溶液を用いる必要があるためこの差は非常に小さい。このため、光源および検出器には高い輝度および安定性が求められ、放射光を用いた実験が、その高精度化には極めて重要であった。
2.アミロース誘導体
これまでの高分子希薄溶液物性の研究には、いわゆるビニルポリマーの研究例が最も多い。しかしながらこれらの高分子にはタクシティシーなどで表現される立体構造の不均一性があり、高分子の局所の化学構造と分子形態を比較する上での議論をあいまいにする。そこで本研究では1次構造が均一である多糖誘導体を中心に研究を始めた。特に酵素合成されたアミロースは、極めて制御された1次構造を持ち、分子量分布も狭い試料の合成が可能であるため、分子量分布を嫌う溶液研究にも都合がよい。また各種イソシアネートとの反応はほぼ定量的に進行するため、側鎖の異なる高分子試料を容易に調製可能である。得られたアミロースカルバメート誘導体には糖ユニット当たり3対のNH基とC=O基があるため、高分子内および高分子-溶媒間の分子内水素結合が高分子の形態に及ぼす影響について調べるのに適切である。ここでは最近我々が研究した多糖誘導体の内、その分子形態の溶媒依存性が高分子内の分子内水素結合数の違いのみによって説明できるアミロースアルキルカルバメート誘導体と高分子に水素結合した溶媒分子が高分子の局所形態にも影響を及ぼすアミロースフェニルカルバメート誘導体類について概説する。
(ア)分子形態が主に高分子内水素結合により決まる系-アミローストリス(n-ブチルカルバメート)(ATBC)[1,2][1] K. Terao, M. Murashima, S. Kitamura, T. Norisuye et al.: Macromolecules 43 (2010) 1061-1068.
[2] Y. Sano, K. Terao, S. Kitamura, T. Norisuye et al.: Polymer 51 (2010) 4243-4248.
最近我々は分子量200万程度のATBCがテトラヒドロフラン中でメタノール中の約7倍の固有粘度を持つことを見出した。この固有粘度の強い溶媒依存性は高分子の剛直性或いはらせん構造の違いによる。そこで小角散乱のデータを光散乱・粘度法のそれと併用してみみず鎖モデルで解析し、λ-1とhを精密に分離評価した。
ここで、溶液散乱関数の見方についておさらいする。図1(a)の赤の実線は円筒みみず鎖の理論値のHoltzerプロットを示す。一点鎖線は分子の直径dを無視した場合(d = 0)である。赤の矢印のあたりの水平領域の高さは1分子の経路に沿った長さ(経路長)Lの逆数に比例し、実線が一点鎖線に比べて緩やかに下がってゆくのは分子の太さのためである。図に示すような中央部分の平坦領域が見られる場合、かなり正確に経路長(さらにはh)を決定することが可能となる。他方、低角側での散乱強度がrod limit(青の破線)に比べて高くなるのは分子の屈曲性に基づくもので、この領域の散乱関数からλ-1を分離評価できる。図1の(b)(c)に分子量約5万のATBC試料のTHF中およびメタノール(MeOH)中の散乱関数を示す。後者のみの低角側にピークがみられることから前者の剛直性が後者に比べ著しく高いことが、さらには、前者の平坦領域が後者のそれよりも約2割高いことからTHF中でMeOH中に比べて主鎖軸方向に20%程度縮んだ剛直らせん構造を持つことがわかる。
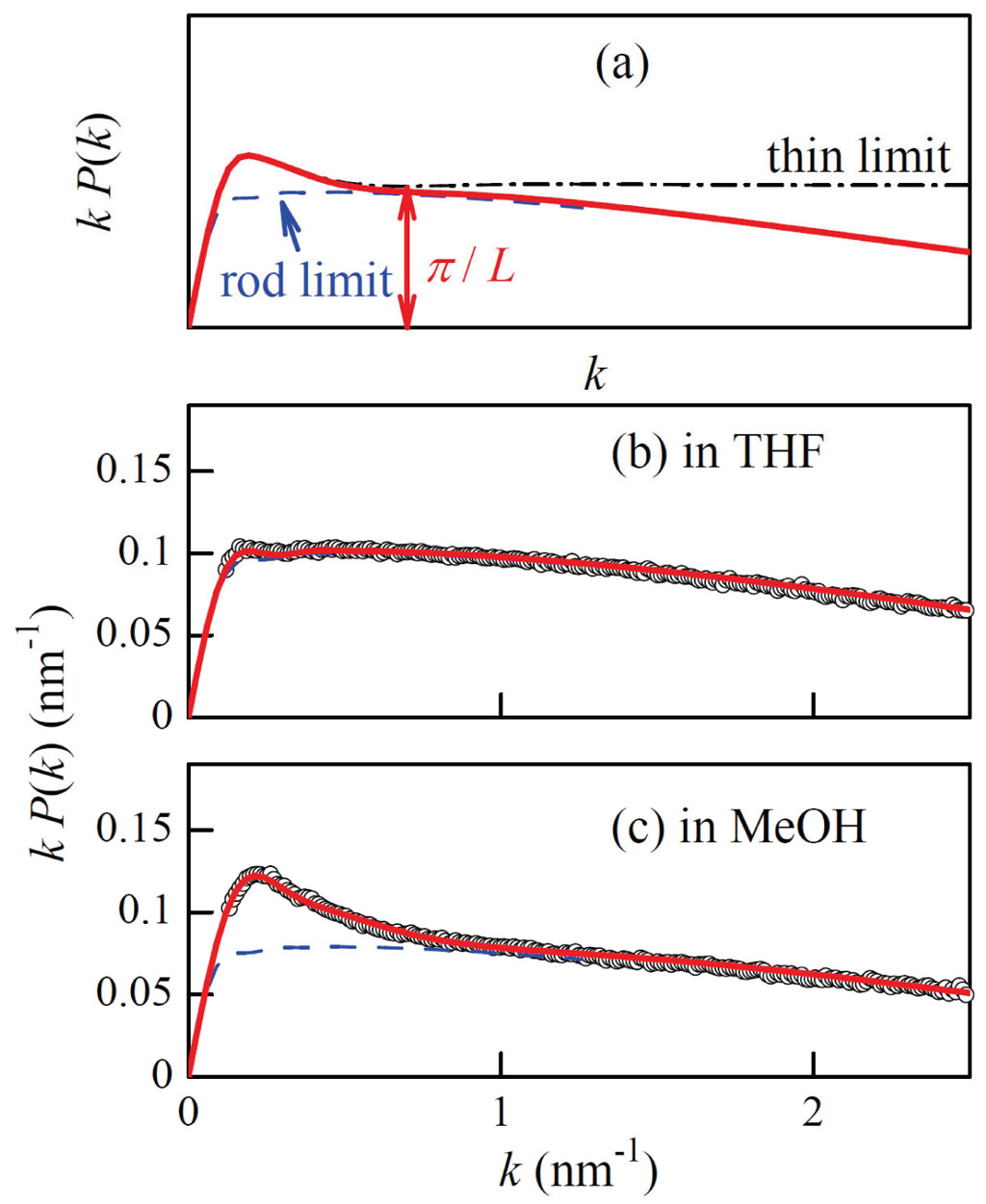
図1 SAXS測定より得られる粒子散乱関数P(k)のHoltzer Plot。(a) 半屈曲性高分子にみられる散乱関数の例。(b) 分子量約5万のATBC試料のTHF中におけるP(k)。(c) 同試料のメタノール中でのデータ。共に文献[1][1] K. Terao, M. Murashima, S. Kitamura and T. Norisuye et al.: Macromolecules 43 (2010) 1061-1068.より。
分子鎖形態と分子内水素結合との相関について調べるために、全9種の溶媒中におけるλ-1、h、および赤外吸収より見積もられる分子内水素結合率を決定した。理論との比較より、この高分子は図2左に示す剛直らせん鎖を安定化させている水素結合の一部が切断された構造を持つこと、その高分子内水素結合数は溶媒に強く依存し、メタノール中では、ほぼすべての分子内水素結合が切断されていることがわかった。すなわち、この高分子の溶液中におけるコンホメーションには分子内水素結合が大きな役割を果たし、その溶媒依存性も分子内水素結合率の変化のみで説明できることを見出した。
(イ)主鎖の形態が溶媒との水素結合に強く影響される系-アミロースフェニルカルバメート誘導体[3-5][3] K. Terao, T. Fujii, M. Tsuda, S. Kitamura and T. Norisuye: Polym. J. 41 (2009) 201-207.
[4] T. Fujii, K. Terao, M. Tsuda, S. Kitamura and T. Norisuye: Biopolymers 91 (2009) 729-736.
[5] M. Tsuda, K. Terao, S. Kitamura, T. Sato et al.: Macromolecules 43 (2010) 5779-5784.
図2の立体構造をもう一度見てみよう。青や赤で表現される窒素原子や酸素原子はその外側を取り巻いているアルキル基よりも、らせんの中心軸の近傍に位置していることがわかる。アルキル基をかさ高いフェニル基で置換した場合、極性基は、その周りにフェニル基が密に存在することになるので、置換基に囲まれた狭い空間に存在することは容易に予測できる。これらの誘導体類は光学活性物質の分離に広く用いられているが、これは極性基周りのキラルなナノ空孔のサイズが、その分離に適しているためであると考えられている[6][6] T. Ikai and Y. Okamoto: Chem. Rev. 109 (2009) 6077-6101.。裏を返せばこれらの極性基にナノ空孔程度のサイズの分子が水素結合することにより、高分子の局所形態に影響しても不思議ではない。本研究では、アミローストリス(フェニルカルバメート)(ATPC)に対し、サイズの異なるケトン-エステルを溶媒とした場合とこれらの極性基とは強い相互作用はしないと考えられる1,4-ジオキサン中における分子の形態を前項のものと同様の手法で決定した。ケトン・エステル中では分子サイズ(あるいは溶媒のモル体積)の上昇に従って、主鎖が引き伸ばされ剛直性も増加することを見出した。このことはキラルなナノ空孔のサイズが溶媒分子程度であることの有力な根拠となりうるであろう。さらに、かさ高い置換基を持つアミローストリス(3,5-ジメチルフェニルカルバメート)(ADMPC)の場合、hの溶媒依存性はむしろ小さくなり、溶媒分子サイズの増加に伴う剛直性の増加がATPCと比べて極めて顕著になることがわかった(図3)。後者の高分子の局所らせん構造は、溶媒分子の水素結合によってあまり変化せず、代わりに剛直性の増加として表れたと考えられる。ADMPCはATPCよりも優れた光学分割能を持つとされるが、この理由として前者のらせん構造の安定性の高さを挙げることもできる。
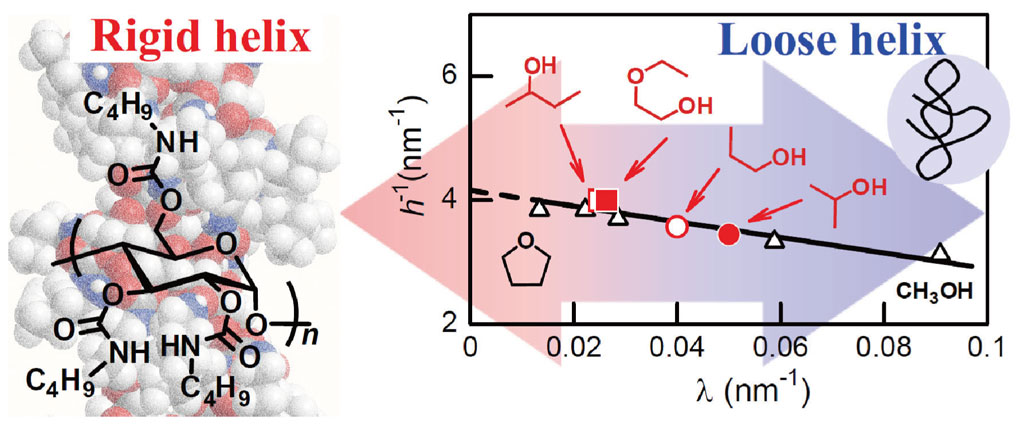
図2 ATBC鎖に予測される剛直らせん構造(左)とみみず鎖パラメータの溶媒依存性(右)[2][2] Y. Sano, K. Terao, S. Kitamura, T. Norisuye et al.: Polymer 51 (2010) 4243-4248.。
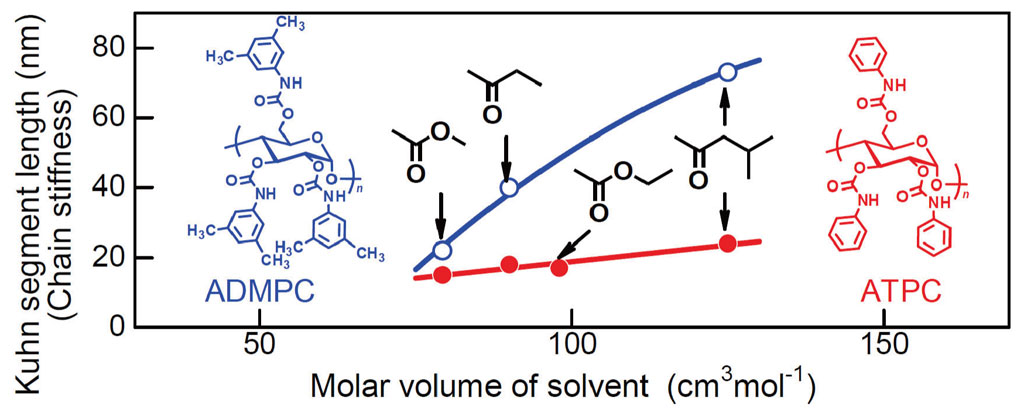
図3 ATPC鎖とADMPC鎖の剛直性パラメータの溶媒依存性。
3.溶液中で可逆的な3重らせん-1本鎖転移を示すコラーゲンモデルペプチド[7][7] K. Terao, K. Mizuno, K. Okuyama, T. Norisuye, H. P. Bächinger et al.: Macromolecules 41 (2008) 7203-7210.
(Gly-Pro-Pro)(Gly:グリシン、Pro:プロリン)という繰り返し単位を持つモデルペプチドは水やアルコールなどの溶液中で可逆的な1本鎖-3重らせんのコンホメーション転移を示すためコラーゲンのモデルとして古くから多くの研究例があり、その結晶構造は精密に決定されている。我々はまずこれらの分子の溶液中の形態が結晶構造に対応していることを調べるために、3重らせんモデルペプチドの小角X線散乱測定を行った。図4左に示す(Gly-Hyp-Hyp)9の散乱関数はk < 1.7 nm-1の領域で長さ8.1 nm直径1.5 nmの剛直円筒(図中の赤の実線)でよく再現されるが、それ以上のkの領域では計算値とのずれが大きくなる。結晶構造から得られた原子配置[8][8] M. Schumacher, K. Mizuno and H. P. Bächinger: J. Biol. Chem. 280 (2005) 20397-20403.より計算した散乱関数(図中の青の実線)は全領域の散乱関数を大体再現することから溶液中の3重らせん構造が結晶中とほぼ変わらないことが確認された。ただし、低角領域をよく見ると実験値は青の実線よりも幾分小さい。この原因として溶液中の熱揺らぎにより、分子が結晶中よりも幾分伸びた構造をとっていることが考えられる。図4右に3重らせんおよび1本鎖状態のコラーゲンモデルペプチドについて得られた回転半径を変性ペプチドについて報告されている値[9][9] J. E. Kohn et al.: Proc. Natl. Acad. Sci. U.S.A. 101 (2004) 12491-12496.と比較する。3重らせんに対応する点が明らかに上方にあるのに対し、1本鎖ペプチドの回転半径<S2>zは変性ペプチドのそれに一致する。散乱関数を組み合わせて決定した1本鎖のλ-1は2 ± 1 nmであった。本研究で用いたコラーゲンモデルペプチドはその2/3がペプチド鎖の内部回転を制限すると考えられるイミノ酸からなるが、分子の剛直性にイミノ酸の存在はほとんど影響しないことが明らかにされた。

図4 (左)コラーゲンモデルペプチド(Gly-Hyp-Hyp)9の3重らせんの散乱関数(○)と計算値との比較。青線:結晶構造(PDB 1YM8[8][8] M. Schumacher, K. Mizuno and H. P. Bächinger: J. Biol. Chem. 280 (2005) 20397-20403.)から計算される散乱関数。赤線:表中に示したサイズを持つ円柱の散乱関数。(右)ペプチドの回転半径の残基数依存性。△:3重らせんコラーゲンモデルペプチド[7][7] K. Terao, K. Mizuno, K. Okuyama, T. Norisuye, H. P. Bächinger et al.: Macromolecules 41 (2008) 7203-7210.。○:1本鎖モデルペプチド[7][7] K. Terao, K. Mizuno, K. Okuyama, T. Norisuye, H. P. Bächinger et al.: Macromolecules 41 (2008) 7203-7210.。+:変性(ランダムコイル)タンパク質[9][9] J. E. Kohn et al.: Proc. Natl. Acad. Sci. U.S.A. 101 (2004) 12491-12496.。
4.高密度櫛形高分子の溶液中の形態に対する側鎖の電荷の効果[10][10] E. Kanemaru, K. Terao, Y. Nakamura and T. Norisuye: Polymer 49 (2008) 4174-4179.
ここまでは主に高分子内、高分子間、および高分子−溶媒分子間の水素結合が分子を剛直にする例を紹介したが、側鎖間の立体的な反発も主鎖の剛直性に大きく寄与する場合もある。代表的な例は、ポリスチレンなどのマクロモノマーを単独重合して得られる高密度櫛形高分子・ポリマクロモノマーであり、側鎖長の増加に伴い、主鎖の剛直性は著しく高くなる。このポリマクロモノマーの側鎖に電荷をもたせた場合、側鎖近傍のイオン性基の密度は極めて高くなって対イオン凝縮が起こり、側鎖間の相互作用は必ずしも斥力的にはならない可能性が示唆されていた。イオン性基の有無が、主鎖の形態がどのように影響するのかについて知るためには、長さの等しい側鎖を持つ非電解質および電解質ポリマクロモノマーの剛直性を直接比較する必要があった。本研究では以前の研究[11][11] K. Terao, Y. Nakamura and T. Norisuye: Macromolecules 32 (1999) 711-716.で予め剛直性を精密に決定してあるポリスチレンポリマクロモノマー(側鎖重合度15)の側鎖をスルホン化し、その主鎖の剛直性を決めた。図5に得られた回転半径の分子量依存性を示す。電解質ポリマクロモノマーの回転半径は高分子量側で同じ主鎖重合度の非電解質ポリマクロモノマーのそれと比べ、2倍以上大きい。決定された電解質ポリマクロモノマーのλ-1は120 nmであり、非電解質のものの16 nmと比較して7.5倍も大きくなることがわかった。すなわち、極めて高い密度のイオン性基を持つ電解質ポリマクロモノマーの側鎖間には極めて強い静電反発が生じており、それが主鎖を著しく剛直化させることを明らかにした。
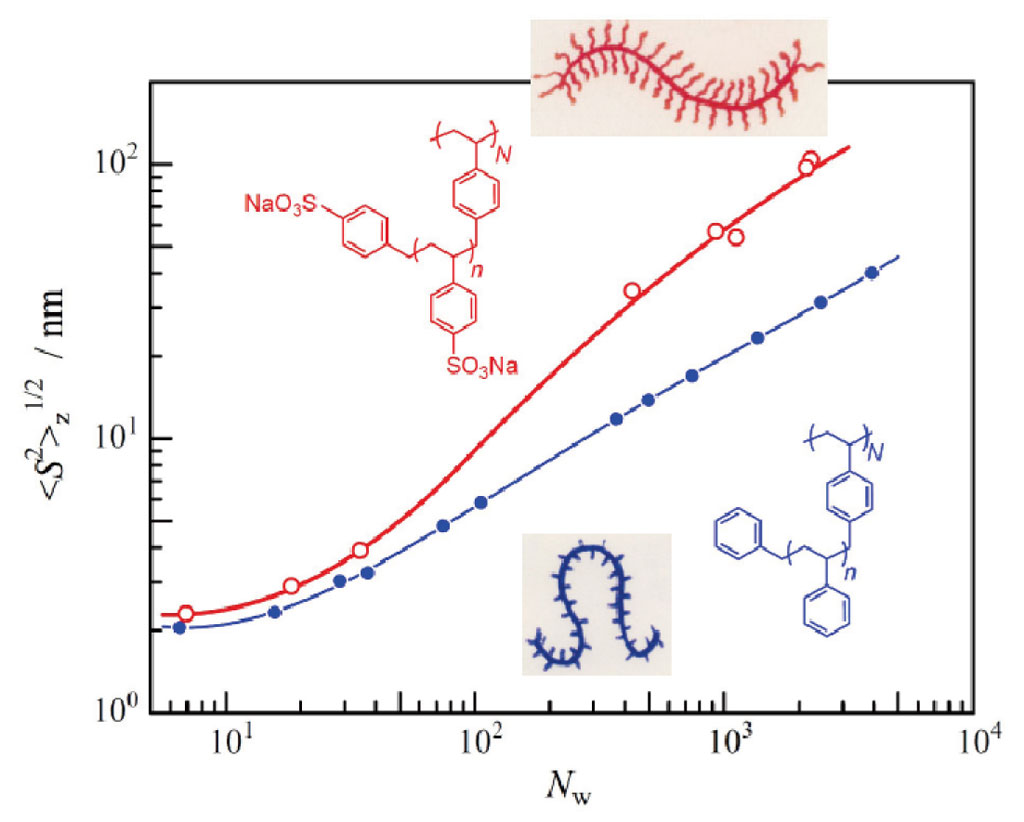
図5 同じ側鎖長(15ユニットのスチレンからなる)を持つ電解質ポリマクロモノマー(赤)と非電解質ポリマクロモノマー(青)の回転半径の主鎖重合度依存性。
5.おわりに
本稿では種々の相互作用が分子鎖の形態(特に剛直性やらせん構造)に強く影響する系を選び、実際にどのような相互作用がどのように分子形態に作用しうるのかということについていくつかの例を示した。これらにはすべて、SPring-8のSAXS測定を用いたデータの高精度化が必要であった。著者らは得られた分子形態の情報を基に、これらの高分子のリオトロピック液晶性や異なるトポロジー(環状など)をもつ高分子に関する研究に発展させている。希薄溶液中の分子形態と分子間相互作用を決定することにより、濃厚溶液の相挙動や粘性などがある程度正確に予測できることを考えると、希薄溶液中における分子形態の決定は材料開発の一つの指標としても有用となりうるはずである。しかしながら、現段階では分子量既知で分子量分布の狭い試料が要求されるなど、溶液中の分子形態の精密決定は多くの人にとってまだまだ敷居の高い手法ともいわれる。実際我々も一つの高分子の溶液中の形態を決定するのに1年以上を要することもしばしばである。現在いくつかのグループによって開発が行われている放射光小角X線散乱をサイズ排除クロマトグラフィーの検出器として用いる方法等を導入し、ユーザーが負担する人的・時間的なコストを大幅に下げることによって潜在的な需要を得ることが期待される。
謝辞
本稿で紹介した研究の放射光小角X線散乱測定はSPring-8のBL40B2にて行われた(課題番号2006A1055、2007A1034、2007A1556、2007B1084、2007B1296、2008A1313、2009A1049)。また、則末尚志名誉教授、奥山健二名誉教授、佐藤尚弘教授(以上大阪大学)、北村進一教授(大阪府立大学)、中村洋准教授(京都大学)をはじめとする共同研究者各位に深く感謝する。
参考文献
[1] K. Terao, M. Murashima, S. Kitamura, T. Norisuye et al.: Macromolecules 43 (2010) 1061-1068.
[2] Y. Sano, K. Terao, S. Kitamura, T. Norisuye et al.: Polymer 51 (2010) 4243-4248.
[3] K. Terao, T. Fujii, M. Tsuda, S. Kitamura and T. Norisuye: Polym. J. 41 (2009) 201-207.
[4] T. Fujii, K. Terao, M. Tsuda, S. Kitamura and T. Norisuye: Biopolymers 91 (2009) 729-736.
[5] M. Tsuda, K. Terao, S. Kitamura, T. Sato et al.: Macromolecules 43 (2010) 5779-5784.
[6] T. Ikai and Y. Okamoto: Chem. Rev. 109 (2009) 6077-6101.
[7] K. Terao, K. Mizuno, K. Okuyama, T. Norisuye, H. P. Bächinger et al.: Macromolecules 41 (2008) 7203-7210.
[8] M. Schumacher, K. Mizuno and H. P. Bächinger: J. Biol. Chem. 280 (2005) 20397-20403.
[9] J. E. Kohn et al.: Proc. Natl. Acad. Sci. U.S.A. 101 (2004) 12491-12496.
[10] E. Kanemaru, K. Terao, Y. Nakamura and T. Norisuye: Polymer 49 (2008) 4174-4179.
[11] K. Terao, Y. Nakamura and T. Norisuye: Macromolecules 32 (1999) 711-716.
寺尾 憲 TERAO Ken
大阪大学大学院 理学研究科 高分子科学専攻
〒560-0043 大阪府豊中市待兼山町1-1
TEL:06-6850-5459 FAX:06-6850-5461
e-mail:kterao@chem.sci.osaka-u.ac.jp








