Volume 15, No.2 Pages 59 - 63
1. 最近の研究から/FROM LATEST RESEARCH
長期利用課題報告2 超分子化学と放射光小角散乱
Long-term Proposal Report 2: Supermolecular Chemistry and Synchrotron Small Angle X-ray Scattering Application to In-site Structural Analysis of Drug Delivering Nano-Pericles in Solutions
北九州市立大学 国際環境工学部 Faculty of Environmental Engineering, The University of Kitakyushu
1.はじめに
生物の世界を分子レベルで眺めると、いくつもの分子が組み合わさって規則正しい構造や機能的な役割を担っていることが分かる。またこれらの分子の集団同士が複雑な相互作用を介して協同的に働いて生体機能を維持している。ひとつひとつの分子を形成している化学結合は共有結合である。共有結合は化学の分野では中心的な研究対象であり、化学を学ぶと共有結合で自然界の現象のすべてが説明できるような錯覚に陥る。しかし、生物の機能にかかわっている部分ではその役割は小さくはないが一部である。生体分子の規則正しい集合体や高次な機能は、共有結合以外の弱い結合力がいくつか複合的に作用することで実現されている。このような弱い結合力の協同的な現象を対象とし、特に合成化合物の世界で再現しようとするのがいわゆる超分子化学の目標の一つである。超分子化学が対象とする物質は低分子や高分子であるが、対象とする現象はそれらが集まった集合体が示す性質であり、大きさで言えば数十nmから1 µm弱におよぶ。その構造は、低分子の結晶構造のように決められた規則正しい構造をもっているわけでなく、階層的でありかつ時間的にも空間的にも揺らいでいる。超分子化学の分野は有機合成学者が先導的に研究を進めてきたが、彼らが分子設計の段階で想像している構造を実際に観測している例は限られている。このような系の構造解析を行うには、強力なX線を有する放射光を用いた小角散乱法が有力な手段である。
超分子化学の重要な応用の一つにナノサイズの粒子を用いた薬物運搬システム(DDS)がある。DDSとは、副作用が大きい、もしくは微量しか調整できないような薬剤を、目的とする部位まで選択的に輸送する方法をさす。DDSに求められる性質は、薬剤をナノサイズのカプセルに内包できる性質と薬剤の放出を制御する技術である。本稿では著者らのDDSナノ粒子に関する最近の研究を紹介する。
2.多糖核酸の複合体
我々はβ-1,3-グルカンと核酸が水素結合と疎水的相互作用を駆動力として化学量論的な高分子複合体を形成することを見出し、β-1,3-グルカンが抗原提示細胞に認識される性質を利用した核酸医薬のDDSへの応用を行っている[1-3][1] M. Mizu et al.: “A polysaccharide carrier for immunostimulatory CpG DNAs to enhance cytokine secretion.” J. Am. Chem. Soc. 126 (2004) 8372-8373.
[2] N. Shimada et al.: “Synthesis and in Vitro Characterization of Antigen-Conjugated Polysaccharide as a CpG DNA Carrier.” Bioconjug. Chem. 17 (2006) 1136-1140.
[3] N. Shimada et al.: “A Polysaccharide Carrier to Effectively Deliver Native Phosphodiester CpG DNA to APCs.” Bioconjug. Chem. 18 (2007) 1280-1286.。天然におけるβ-1,3-グルカンは3重螺旋の状態で存在し、この3重螺旋をDMSO等の極性有機溶媒に溶解すると螺旋が解けてランダムコイル状の単一鎖となる。この溶媒を水に戻すと3重螺旋の構造が再生される。この“Renature”の過程に核酸が存在すると、3重螺旋のうち一つの糖鎖が核酸によって置き換わることを利用して、アンチセンスDNAなどの核酸医薬を多糖と複合化させる。この反応は極めて定量的に進み、糖の繰り返し単位2 molに対して核酸塩基が3 mol反応する。すなわち、糖の主鎖のグルコース2分子が核酸塩基1分子と水素結合によって複合体を形成していると考えられる。結晶化度が極めて低い複合体しか得られないため、結晶構造解析は今のところ困難である。計算化学を用いて構造の検討を行った結果を図1に示す。シトシンのN3とN2が分子間水素結合に参加することで安定な多糖:核酸が2:1の螺旋を形成している。計算化学によると、複合体では多糖3重螺旋の連続した水素結合の一部が核酸塩基の水素結合部位で置換わっていることが分かる。このような複合体の構造を精密に議論することは、この多糖核酸複合体をDDSに応用する上でもきわめて重要である。
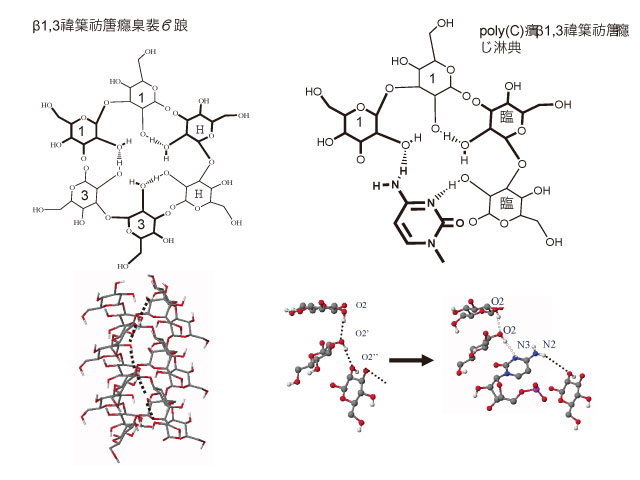
図1 β-1,3-グルカンの3重螺旋の構造(左)と多糖核酸複合体の構造(右)。図中、同じ数字は同一の鎖に属するグルコースであることを示している。上は3重螺旋の断面図であり、下の図は側面図である。点線は水素結合を示す。
結晶構造解析が困難なので、溶液物性を測定することで計算化学の結果を確かめることにした。β-1,3-グルカンの一種であるシゾフィラ(SPG)と1本鎖DNAであるアデニル酸の60量体(dA)60の複合体の慣性自乗半径〈S2〉と分子量Mwの関係を図2に示す。〈S2〉は高分子鎖の溶液中での広がりを示す物理量であり散乱強度の散乱角度依存性から求められる。ここでは、高分子量側は多角度光散乱法で、低分子量の試料はビームライン40B2でのX線小角散乱法で求めた。ここでは、3重螺旋のSPG(T-SPGと表記)を比較のために示した。T-SPGの水溶液中における〈S2〉とMwの関係は持続長200 nmで単位長さ当たりの分子量Ml = 1900のKratky-Porod鎖(半屈曲性高分子に対する統計力学的モデル)で記述できることが分かっている。持続長とは高分子鎖の曲げ弾性率に関係する量で分子の屈曲性の指標となり、大きいほど剛直である。計算化学から求めた複合体のMlは2500であり、持続長を60 nmとすると得られた複合体のデータは完全にKratky-Porod鎖で記述できる。2重鎖DNAの持続長が50〜60 nmであることを参考にすると、多糖核酸複合体はそれに近い剛直性を有していることが分かる。分子量が10万付近の広がりは持続長にほとんど依存せずMlだけで決まる。したがってこの領域で理論と実験が一致していることは、計算化学から得た単位長さあたりの分子量の結果が正しいこと、すなわち計算された構造が正しいことを示している。さらに短いカメラ長で複合体の断面からのX線小角散乱を測定した(図3)。無限に長く断面積がない仮想的I(q)〜q-1からずれるところから複合体の断面の直径が2.7 nmと求められた。この値は計算化学から得た2.9 nmとよく一致していた。これより、溶液中の複合体の形態は計算化学で予測したモデルでほぼ記述できると考えている。この測定にはビームライン40B2の4 mもしくは45XUの3.5 mのカメラで、波長0.1 nmを用いた。
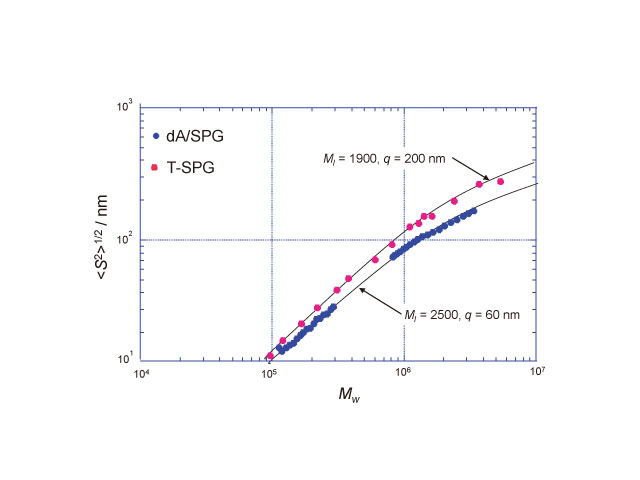
図2 β-1,3-グルカンの一種であるシゾフィラン(TSPG)の3重螺旋の広がりと分子量の関係。シゾフィランと核酸であるpoly(dA)から作った多糖核酸の複合体の広がりと分子量の関係。実線は図中に示したパラメータを有するKratky-Porod鎖から計算した理論値。
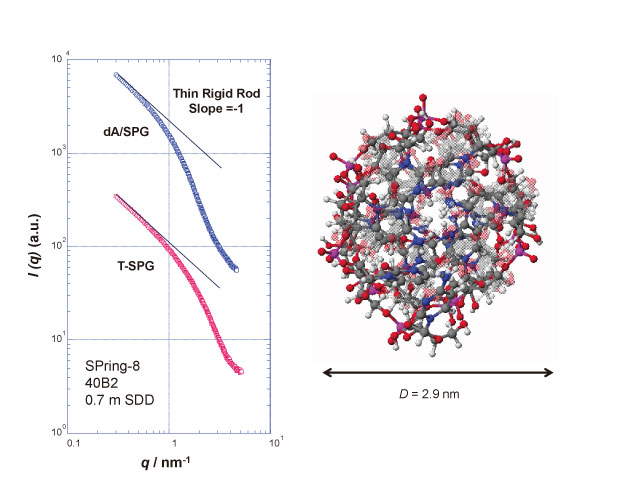
図3 シゾフィランの3重螺旋と複合体のX線小角散乱のプロファイルと、複合体の断面のモデル。
3.高分子ミセルに内包された疎水性薬剤
両親媒性の高分子が水溶液中で形成する高分子ミセルは疎水性の制癌剤のDDSとして臨床試験がすすんでいる。親水性鎖と疎水性鎖とからなるブロック共重合体は、水溶液中で自己集合体して、疎水部を内核、親水部を外殻とする会合体を形成する。このミセルは、その直径が20〜50 nm でありウイルスと同等のサイズである。高分子ミセルは低分子ミセルに比べてミセルを構築する高分子鎖のミセルからの解離速度が小さく、極めて高い構造安定性を実現することが可能である。また、内核は外界から隔絶された非水的ミクロ環境を構成し、疎水性物質を安定に保持できる。一方、外殻は親水性で、高分子ミセルの優れた安定性と溶解性を維持するのに役立つとともに生体親和性を発揮し、細網内皮系から認識を免れるのに役立っている。しかし、内核にどのように薬剤が内包されているかを詳細に調べた例はない。しかし、除放性などの分子設計を考える上では内核内部の薬剤の性質を実際に動物試験等で使用する濃度の希薄溶液中で検討することは大切である。このように希薄溶液からの散乱は強度が低く放射光の威力が発揮される分野である。慈恵医科大学の横山先生と共同で、ポリエチレングリコール(PEG)-ポリアスパラギン酸誘導体に合成レチノイドのひとつであるLE540を内包したミセルからの小角散乱を検討している。
PEGの分子量5.2 × 103(重合度で120)でポリアスパラギン酸誘導体が分子量4.6 × 103(重合度24)で82 mol%ベンジル化したブロックである試料に、レチノイド薬剤の一種であるLE540を添加していったときの高分子ミセルからの散乱を測定した結果を示す。測定はおもにビームライン40B2と45XUで行った。散乱強度は純水と分子量が既知のポリエチレングリコールで補正することでX線の絶対散乱強度に換算した。図4の左は全体の散乱プロファイルの変化であり、薬剤の添加ともに低角の散乱強度がわずかに低下するとともに、q = 0.6 nm-1あたりのプロファイルが変化している。この変化を2層からなる単純な球体モデルで解析すると、内核の半径が図5に示したようにS字型で増加していることが判明した。また高分子の会合数を計算すると約100であり、薬剤添加にともないわずかに増加した。会合数とLE540の密度から単純に核に薬剤が封入されたと仮定すると図の点線に従って内核の半径が増加するはずである。実験データはこの単純加算から大きくはずれており、LE540添加に従って内核の性質が大きく変化していることを示している。図4の右に溶液散乱の広角のデータを示す。ポリアスパラギン酸誘導体はこの領域に高分子のヘリックス間の干渉に起因する散乱を与える。このピークはLE540添加とともに減少しLE540添加5.8%以上ではほぼ消える。この薬剤添加量で内核の大きさが急激に増加する。このことからLE540が内核に内包されるとポリアスパラギン酸誘導体の高次構造を崩壊することがわかる。このようなLE540の内包過程を模式的に示したのが図5の左のモデルである。バルク状態のポリアスパラギン酸へLED540を10%添加しても結晶構造の変化は起きにくいと思われるので、この変化は半径6 nmといった微小空間での特徴的な現象であると推定される。
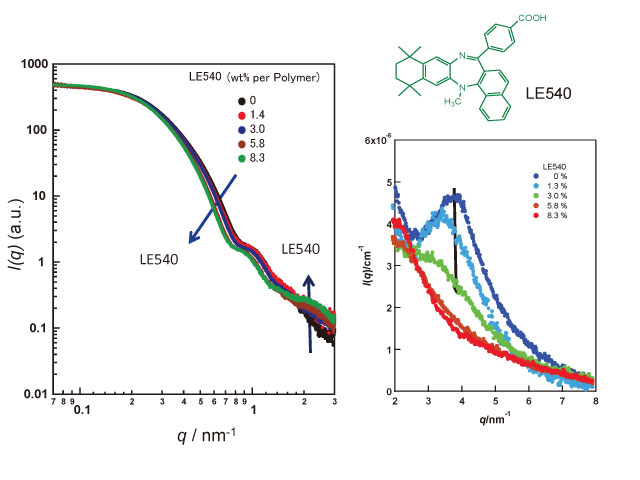
図4 高分子ミセルに薬剤LE540を添加した時のX線小角散乱プロファイルの変化。左図は小角領域の薬剤添加による変化を両対数プロットで、右図は広角領域における変化を示す。

図5 散乱を2層球体モデルで解析した場合の内核の半径の変化(右図)と、LE540を添加した場合に起こる変化を表した模式図(左)。
4.アニオン性脂質が形成する紐状ミセルの断面構造と持続長
親水基に電荷を持つイオン性界面活性剤は水中でイオン性ミセルを形成し、塩濃度の増加とともに球状から紐状へと変化することが知られている。このようなミセルは身近なところではシャンプーに使われ、またDNAとの複合体は遺伝子導入に使われる。典型的なイオン性界面活性剤としてLES(ラウリルエーテル硫酸ナトリウム)とAMPB(ヤシ脂肪酸アミドプロピルベタイン)をLES:AMPB = 5:3に混合した系を我々は扱っている[5,6][5] K. Eguch et al.: “Salt-Concentration Dependence of the Structure and Form Factors for the Wormlike-Micelle Made from LES/AMPB Dual-Surfactant in Aqueous Solution.” J. Appl. Crystallogr. 40 (2007) 264-268.
[6] K. Naruse et al.: “Flexibility and Cross-Sectional Structure of an Anionic Dual-Surfactant Wormlike Micelle Explored with Small-Angle X-ray Scattering Coupled with Contrast Variation Technique.” J. Phys. Chem. B 113 (2009) 10222–10229.。この系の散乱は溶媒と内層の電子密度の関係から定角で散乱強度が急激に低下するため、散乱測定のうえできわめて扱いづらい系である。中性子散乱法では同位体を用いたコントラスト変調法が構造決定に有効的に用いられているが、X線散乱においてはあまり例がない。我々は、界面活性剤の溶液にスクロースを添加することで、ミセルの構造変化をおこさないで溶媒の電子密度を自在に変化できる系を見出した。図6左にその一例を示す。スクロースの添加によって散乱関数は大きく変化するが、すべての散乱は同じ構造パラメータで記述することができる。2層ミセルの外層と溶媒の電子密度を一致させ内層だけからの散乱を測定し、Iqをqに対してプロットし、ミミズ鎖モデルの理論と比較することにより、ミセルの持続長を塩濃度の関数として得ることに成功した。
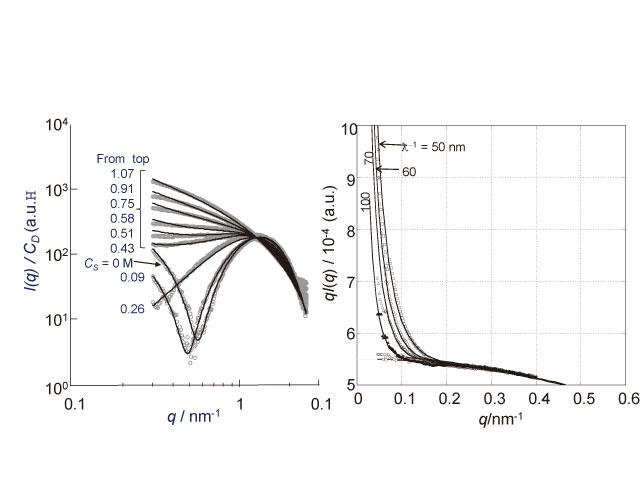
図6 シャンプーに使われる界面活性剤にスクロースを添加したときの散乱の変化(左)とミセル溶液のHoltzer Plotと理論との比較。理論は有限の断面を有するミミズ鎖モデルの散乱関数。
5.おわりに
分子が共有結合を介さないで弱い相互作用が協同的に働くことによってきわめて多種の構造を形成する。これらの構造は大きく揺らいでいるため、従来の意味での構造解析の手法では解析が困難な分野である。一方、高分子科学ではこのような「あいまい」な系を以前から扱っており、超分子化学の物理化学に高分子科学の概念が有効であることを本稿では示したつもりである。ここでは薬理効果などの機能のデータは示さなかったが、放射光で得られた精密な構造解析の結果を機能と相関して議論し、より高性能なDDSの開発につなげていけたらと考えている。
参考文献
[1] M. Mizu et al.: “A polysaccharide carrier for immunostimulatory CpG DNAs to enhance cytokine secretion.” J. Am. Chem. Soc. 126 (2004) 8372-8373.
[2] N. Shimada et al.: “Synthesis and in Vitro Characterization of Antigen-Conjugated Polysaccharide as a CpG DNA Carrier.” Bioconjug. Chem. 17 (2006) 1136-1140.
[3] N. Shimada et al.: “A Polysaccharide Carrier to Effectively Deliver Native Phosphodiester CpG DNA to APCs.” Bioconjug. Chem. 18 (2007) 1280-1286.
[4] I. Akiba et al.: “Encapsulation of a Hydrophobic Drug into Polymer-Micelle Core Explored with Synchrotron SAXS.” Langmuir, in press.
[5] K. Eguch et al.: “Salt-Concentration Dependence of the Structure and Form Factors for the Wormlike-Micelle Made from LES/AMPB Dual-Surfactant in Aqueous Solution.” J. Appl. Crystallogr. 40 (2007) 264-268.
[6] K. Naruse et al.: “Flexibility and Cross-Sectional Structure of an Anionic Dual-Surfactant Wormlike Micelle Explored with Small-Angle X-ray Scattering Coupled with Contrast Variation Technique.” J. Phys. Chem. B 113 (2009) 10222-10229.
櫻井 和朗 SAKURAI Kazuo
北九州市立大学 国際環境工学部 環境生命工学科
〒808-0135 北九州市若松区ひびきの1-1
TEL:093-695-3294 FAX:093-695-3390
e-mail:sakurai@env.kitakyu-u.ac.jp








