Volume 15, No.2 Pages 54 - 58
1. 最近の研究から/FROM LATEST RESEARCH
長期利用課題報告1 イオンポンプ蛋白質の結晶構造解析
Long-term Proposal Report 1: Crystal Structure Analysis of Ion Pump Proteins
東京大学 分子細胞生物学研究所 Institute of Molecular and Cellular Biosciences, The University of Tokyo
1.はじめに
2006B期から3年間「膜輸送体作動メカニズムの結晶学的解明」という長期課題を、東工大・村上グループとともにアンジュレータービームラインBL41XUを用いて遂行した。筆者(東大・豊島)グループはイオンポンプ蛋白質を、村上グループはバクテリアの多剤耐性に関係する薬剤排出トランスポーター(特に大腸菌AcrBとその類似体)を研究対象とした。本稿では、筆者がほぼ20年間取り組んでいるCa2+ポンプ[1-3][1] C. Toyoshima, M. Nakasako, H. Nomura and H. Ogawa: Nature 405 (2000) 647-655.
[2] C. Toyoshima, Y. Norimatsu, S. Iwasawa, T. Tsuda and H. Ogawa: Proc. Nat. Acad. Sci. USA. 104 (2007) 19831-19836.
[3] C. Toyoshima: Arch. Biochem. Biophys. 476 (2008) 3-11.と2005年以来取り組んでいるNa+, K+ポンプ[4,5][4] T. Shinoda, H. Ogawa, F. Cornelius and C. Toyoshima: “Crystal structure of the sodium-potassium pump at 2.4 Å resolution.” Nature 459 (2009) 446-450.
[5] H. Ogawa, T. Shinoda, F. Cornelius and C. Toyoshima: Proc. Nat. Acad. Sci. USA 106 (2009) 13742-13747.の結晶構造解析を簡単に紹介したい。
よく知られているように、細胞の内外でイオンの組成は異なっており、平衡にはない。それは、細胞がイオンを通さない脂質二重膜で外界から仕切られており、ポンプ蛋白質が常にイオンを汲み出し、汲み入れているからである。ポンプ蛋白質はATPを加水分解する酵素(ATPase)であり、ヒトは一日にその体重と同程度のATPを消費するが(もちろんリサイクルするので、排出するわけではない)、その1/4をポンプ蛋白質が使うとされる。つまり、ポンプ蛋白質が生命活動の基盤を維持しているといって過言ではない。
イオンの濃度差は膜電位を生み出し、細胞膜の内側の電位は外側より20〜120 mV低く保たれる。神経が興奮するという現象は、イオンがチャネル蛋白質を通して流入し、電位差が失われることに他ならない。この目的のためには1価の陽イオン(Na+やK+)が使われる。一方、2価の陽イオン(特にCa2+)は生体反応の制御に使われる。人体には約1.4 kgのカルシウムがあるが、大部分は骨や歯であり、制御に使われるカルシウムは10 gほどといわれる。しかし、この10 gは、生理的に極めて重要であり、筋肉の収縮と弛緩はその著しい例である。筋原繊維の周りには袋状の構造があり、カルシウムの貯蔵庫となっている。筋肉の収縮のために放出されたCa2+を貯蔵庫に汲み戻し、弛緩をもたらすのがCa2+ポンプの働きである。Ca2+の濃度差は実に1万倍にもなる。
2.技術的なこと
このような構造研究において、最大の難関はもちろん結晶化である。特に、膜蛋白質の場合は、本来脂質二重膜にあるものを界面活性剤で可溶化し、結晶化するわけで、界面活性剤の選択、脂質を加えるかどうか、加えるなら界面活性剤との比をどうするか、といった、水溶性蛋白質には無い問題がある。
膜蛋白質結晶化の初期には、脂質二重膜を構成する燐脂質は結晶化用試料から除くべきものとされた。それは、一つには脂質二重膜の中のような疎水的環境で蛋白質間の相互作用を強くするのと、膜外ドメインのように親水的な部分の相互作用を同時に強くするのは困難であるからだし、そもそも均一ではないからである。しかし、イオンポンプ蛋白質の場合は、燐脂質が無いと蛋白質が活性を失ってしまう。筆者らはCa2+ポンプ(Ca2+-ATPase)の最初の結晶構造を2000年に発表したが[1][1] C. Toyoshima, M. Nakasako, H. Nomura and H. Ogawa: Nature 405 (2000) 647-655.、これは、三次元結晶化において燐脂質を外から添加した最初の例となった。結晶化手法にしても、中間状態によっては、透析法、蒸気拡散法のどちらかでしか出来ないものもあり、試すべきパラメータは非常に多いと言わざるを得ない。しかも、膜蛋白質の場合、大きな結晶が出来ても、ろくに回折しないということはよくある。我々も二つの場合でそれを経験した。特に著しかったのはNa+, K+-ATPaseの場合である。
このNa+, K+-ATPase結晶は、Ca2+-ATPase結晶と遜色ない大きさ(1000 × 100 × 20 µm)に成長したが、そのままでは分解能は7 Å程度で、そこまでは回折強度は強いが、そこから先はパタリと無くなってしまうというものであった。分解能の改善のために試みられる方法として脱水和があり、膜蛋白質結晶での成功例もある。そのためには、通常沈殿剤の濃度を上げる。この場合、沈殿剤はPEG3000であり、透析法で結晶化しているため、結晶化溶液の他の成分は変化させずにPEGの濃度のみを上昇させることが出来る。この実験の結果、(i)格子長の変化はPEG濃度に応じて連続的である、(ii)PEG濃度の変化は余り遅いとうまくいかない、(iii)最終濃度が高すぎると格子はさらに縮まるが分解能は落ちることが判明した。
この結晶の場合、脂質二重膜に蛋白質が埋め込まれているため、二次元結晶が積み重なった形の三次元結晶となっている(I型結晶と呼ばれる。図1)。このような結晶の場合、脂質二重膜が蛋白質を横方向につなぐ効果を持つので、蛋白質間の接触は必ずしも必要ない。そのため、多数の紐が横に並んだようなもの(紐を束ねているのは脂質二重膜)になり、脂質二重膜の柔軟性のために、分解能は低くなるのが通例である。
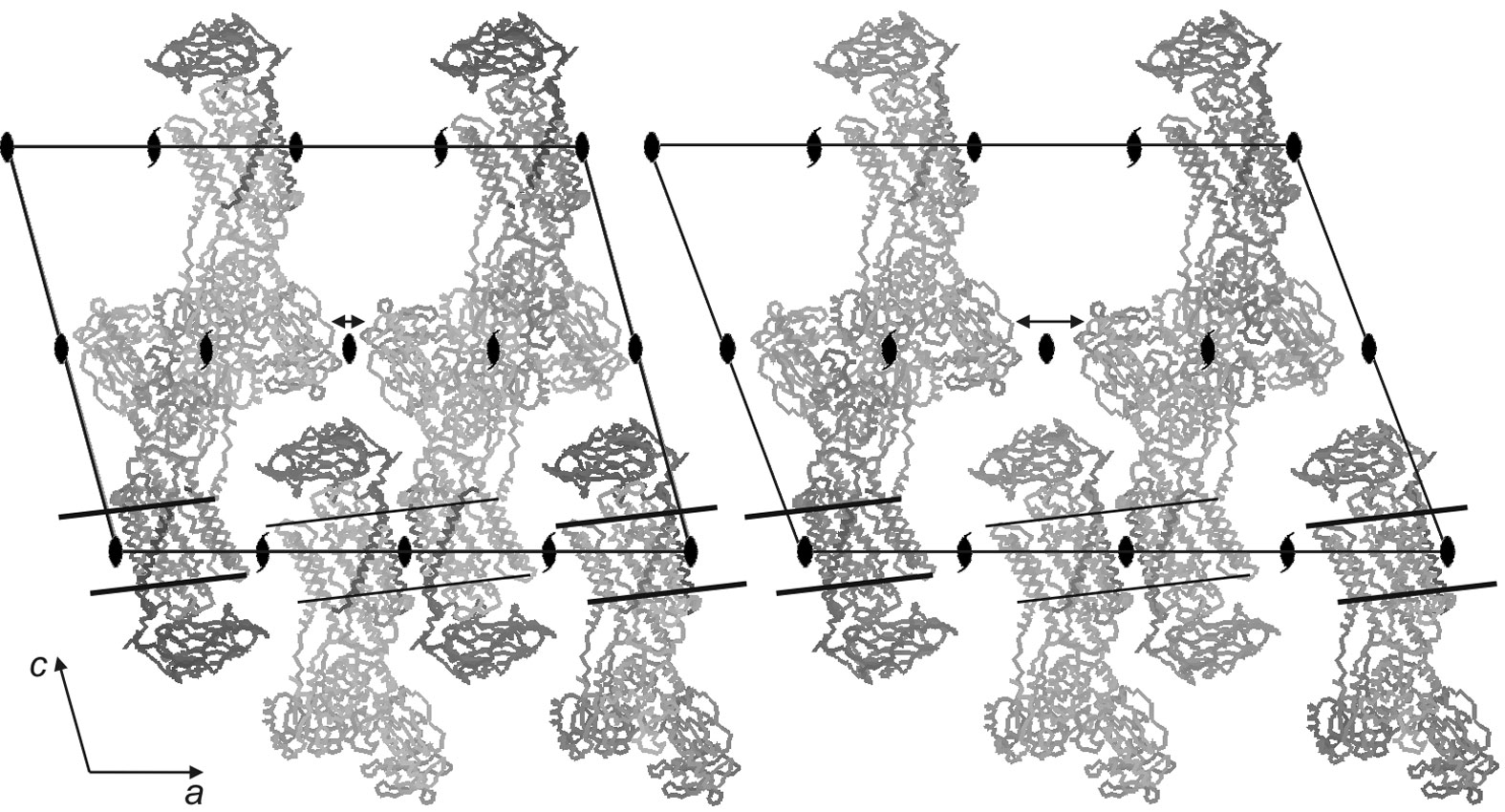
図1 Na+, K+-ATPaseのE2・2K+・MgF42-結晶における脱水和の効果。左、40% PEG3000による脱水和後。右、25% PEG3000。矢印は、分子間の隙間を示す。線は膜貫通へリックスの配置から予想される脂質二重膜の境界を示す。本結晶の空間群はC2であり、2回回転軸と2回螺旋軸の位置も示した。
PEG3000の濃度を結晶化条件の13%から40%に上げることによって、a軸の格子長が275 Åから224 Åまで50 Åも短くなり、分解能は2.4 Åまで向上した[4][4] T. Shinoda, H. Ogawa, F. Cornelius and C. Toyoshima: “Crystal structure of the sodium-potassium pump at 2.4 Å resolution.” Nature 459 (2009) 446-450.。この方向は結晶の最も薄い方向に相当するが、予想に反し脂質二重膜の膜面に沿った方向であり、脂質二重膜間の距離は変化しなかった。一方、さらに短く217 Åまで縮めても分解能の向上はみられなかった。この結果、格子長はばらついたが、重原子置換体によって位相を決定する際に、逆に同型性の良いものを選ぶことができ、有効ともいえた。
さて、分解能が向上した原因であるが、この結晶の場合は、Na+, K+-ATPaseのβサブユニットが糖鎖修飾を受けているためということも考えられる。しかし、格子の収縮は膜面に沿った方向に起こっていることから、脂質二重膜の歪みが重要である可能性が高い。実際、Na+, K+-ATPaseの膜貫通へリックスの位置からは、分子はab面に対し10°程度傾いている。この結晶の空間群はC2であるからab面中にb軸と平行に2回螺旋軸が存在するが(図1)、この傾きによって膜の高さが軸に沿って上下することを意味する。これは脂質二重膜に歪みをもたらすわけで、それがa軸方向のパッキングを緩くしている原因ではないだろうか。この点に関しては、本研究課題において新しい溶媒コントラスト変調法(溶媒の電子密度を変え、回折強度の変化から位相情報を得る手法)を開発し、脂質二重膜を可視化することに成功しているので、この結晶にも是非適用してみたい。
一方、データ収集も水溶性蛋白質以上に重要なステップである。X線照射による損傷は非常に大きいし、I型結晶の場合、薄い板状になる可能性は高い。本長期課題の期間中に、試料を連続的に移動しながらデータ収集をすることによって照射損傷を大幅に低減できるようになり、またdiffraction scanによってデータ収集の最適化を図ることができるようになった(我々の希望に応えて長谷川和也博士がビームラインの測定ソフトウェアBSSにこの機能を追加してくれた)。この結果、この結晶からはこれ以上は不可能というqualityでデータを収集できるようになった。実際、結晶の質はほぼ同一であるが、Ca2+-ATPaseのE1・2Ca2+結晶に関しては、これまでの2.4 Åから1.9 Åまで、分解能を向上させることが出来た。(これには、もちろん、清水伸隆博士を始めビームライン担当者や光源・光学部門のスタッフがBL41XUでのビームの質を格段に向上させたことによる効果も大きいと考えられる)。
図2に実際のデータ収集の例を示す。ここでは、Na+, K+-ATPaseの板状結晶を用い、50 µm角のビーム、gradual mode(何フレームかを露光する毎に試料を一定方向に5 µm移動させるモード。この場合、5フレーム毎に移動)で、板状結晶に対しほぼ垂直にX線が入射する方位からスタートし、平行、垂直と220°、440フレームのデータ収集を行った。Scalepackが吐き出す温度因子(B factor)は、板状結晶に平行にビームが入射する時やや高くなるが、2回目の垂直入射時(380フレーム付近)の温度因子は1回目よりもむしろ低くなった。この温度因子の変化は、この場合、回折点の形状の変化の反映と考えられ、平行入射の場合一方向にやや伸びるために、Scalepackは温度因子で補正するものと考えられる。すなわち、温度因子で判断する限り、照射損傷は問題にならない、という結論になった。
第2に、diffraction scanの実装である。これは、結晶の方位は変えず、水平・垂直方向に一定間隔で試料を移動させて露光し、結晶の位置や照射範囲を最適化しようというものである。ビームが細くなるに従い、結晶の位置精度に対する要求も厳しくなる。筆者らが扱っている結晶は、脂質二重膜に埋まった蛋白質(二次元結晶)が積層しているごく薄い板状結晶であるため、板に平行にX線が入射した場合、結晶にまったく当たらなくなる可能性があった。特に、E2(TG)結晶のように一軸が極端に長く(〜600 Å)、90°アームを使ってデータ収集を行う場合、窒素ガスによる冷却のためアームの収縮は避けられず、深刻な問題であった。また、我々の結晶の場合、板状結晶のためか、場所・方位による差が大きく、データ収集範囲・順序の設定は得られるデータに多大な影響を与えた。そのため、現在は、データ収集そのものよりも設定の方に(すなわちdiffraction scanに)時間がかかる。
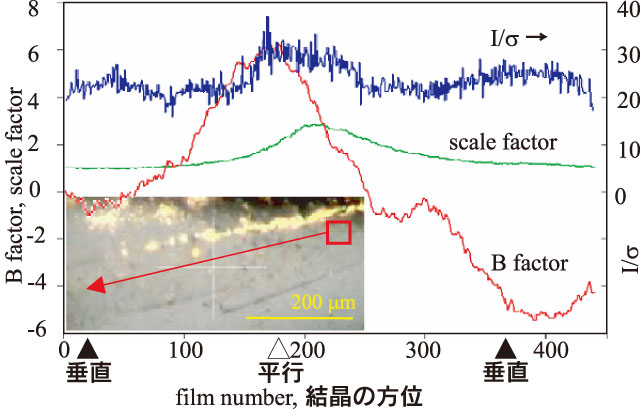
図2 Gradual modeによるNa+, K+-ATPase板状結晶のデータ収集とScalepackによる統計値の変化。写真はマウントされた結晶。赤四角はデータ収集開始点とビームサイズ(50 μm角)を示す。矢印は試料を移動させて照射領域を変化させた方向を示す。試料の回転軸は図の横軸と平行。「垂直」はX線が板状結晶の広い面に垂直に入射することに対応(紙面に垂直)。波長0.9 Å、カメラ長300 mm、振動角0.5°、露光時間0.7秒(アッテネーター無し)、440フレーム。結晶の空間群:C2、格子定数:a = 225.8、b = 51.0、c = 164.3 Å; β = 105.4°。分解能:2.6 Å。モザイク幅: 0.9〜1.3°。試料は100 Kに窒素ガスで冷却し、Rayonix MX225HE検出器を使用。2008年6月25日のデータ。
3.Ca2+ポンプの結晶構造解析
2000年にCa2+結合時の構造[1][1] C. Toyoshima, M. Nakasako, H. Nomura and H. Ogawa: Nature 405 (2000) 647-655.を発表して以来、本長期課題を開始した時点では6つの反応中間体の構造が決定されていた(図3)。ポンプ蛋白質は、運搬するイオンに対する結合部位の親和性と向きを変えて濃度勾配に逆らった輸送を実現する。高親和性で細胞質を向いている状態をE1、低親和性で反対(この場合、小胞体内腔)を向いている状態をE2と呼ぶ。また、反応サイクル中でポンプ蛋白質の保存されたアスパラギン酸残基(この場合Asp351)にATPから燐酸が渡され、燐酸化される(Pで表わす)。E1P状態では運搬されるイオンは膜のどちら側からもアクセスできず、隔離状態となる。ポンプ蛋白質からADPがはずれることによって構造変化が起き、運搬イオンに対する親和性が低下するとともに内腔側ゲートが開いてイオンが放出される。燐酸化アスパラギン酸の加水分解反応によって燐酸が外れ(E2P → E2)、ゲートは閉じる。すなわち、イオンの運搬はE1P → E2Pで成される[3][3] C. Toyoshima: Arch. Biochem. Biophys. 476 (2008) 3-11.。
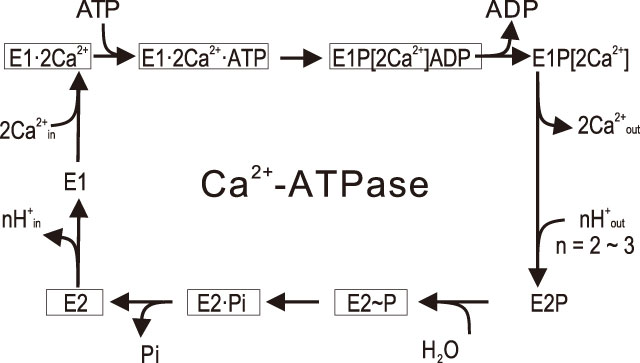
図3 Ca2+-ATPaseの反応サイクル(簡略版)。四角で囲んである状態は2006年10月には構造が発表されていたもの。[Ca2+]は閉塞状態を示す。
残された中間体のうち重要なものの一つはE2P基底状態であった。既にE2〜P遷移状態とE2・Pi product stateの構造は決定され、蛋白分解酵素による限定分解では基底状態と差がないものの、小胞体内腔側ゲートは基底状態でのみ開いていることがわかっていた。この構造はどのようなものか、また、何故、基底状態と遷移状態という、おそらくは極めて僅かな違いによってゲートの開閉が制御され得るのかを解明することが眼目であった[2][2] C. Toyoshima, Y. Norimatsu, S. Iwasawa, T. Tsuda and H. Ogawa: Proc. Nat. Acad. Sci. USA. 104 (2007) 19831-19836.。基底状態の燐酸アナログはBeF3−であり、その複合体の構造解析をE2(Ca2+に対し低親和性)状態を強力に安定化する阻害剤thapsigargin(TG)の有り無しで行った。
直前の状態であるE1P状態のアナログ(E1・2Ca2+・AlF4-・ADP)とE2〜P状態の間で、3つある細胞質ドメインの一つ、Aドメインは脂質二重膜に垂直な軸のまわりに115°回転する。これがゲートの開閉に変換されるはずである。一方、同じBeF3-との複合体でも、TGが有るとゲートは閉まってしまう。しかし、細胞質ドメインの構造は、TG有り無しでほとんど同じであることが生化学的にわかっていた。どうして、細胞質ドメインの構造は同じなのにゲートは開閉できるのか。ゲートの開閉とは、ごく小さな変化なのか。それともこの状態の構造は2つのかなり異なったコンフォメーションを許すような柔軟なものなのか。分子動力学のシミュレーションで明らかになった熱運動の大きさを考えると、ゲートの開閉というのは相当に大きな構造変化であると考えられた。それなら、2つのコンフォメーションを許すスイッチがあるはずだろうが、それは何なのか。
得られた構造は、このような疑問にみごとに答えるものであった。カルシウムに対する親和性を下げ、内腔側に押し出すためには、結合サイトIIを作っているM4へリックスをαへリックスの約一巻き分(〜5.5 Å)下げる、つまり、Aドメインの回転をM4へリックスの運動に変換する必要がある(図4)。構造からこのメカニズムを理解するのには相当の時間を要した。

図4 筋小胞体Ca2+-ATPaseのE1・2Ca2+・AlF4-・ADP(両方のゲート閉でCa2+閉塞)状態とE2・BeF3-(内腔側ゲート開)状態の結晶構造。I、IIは結合したCa2+。
110°の回転によってAドメインはPドメインの上にのり上げるような形になる。Pドメインはくさびのような形をしているので、もしPドメインが空間的に固定されているならAドメインの高さ(膜表面からの距離)は高くなるはずである。この結果、Aドメインの一端につながっている膜貫通へリックスM1は持ち上がるはずである。しかし、M1へリックスは膜内から出られないため、実際にはPドメインを傾けてM1ヘリックスが膜から出ないようにする(図5)。一方、M4ヘリックスは、Pドメインに組み込まれているため、この傾斜によって大きく(内腔側へ)下がる。これが膜内に結合したカルシウムを押し出す運動となる。すなわち、Pドメインがくさび形をしていることとM1へリックスが脂質二重膜におろした錨のように働くことが事の本質である。

図5 Ca2+-ATPase内腔側ゲートの開閉機構の模式図
このとき、Aドメインに直接つながっているM1−M3へリックスには、力がかかるはずで、Pドメインを傾斜させるのにかかる力(従って、M5を曲げる力)と競争になると予想される。Aドメインは、E2〜P遷移状態ではE2P基底状態よりさらに25°ほど回転している。この回転によってM1−M3へリックスをさらに上に持ち上げようとする力が働き、耐え切れなくなったM2へリックスは部分的にほどける。その結果、M1−M2で構成されるV字型構造が下がり、M4へリックスが横に開く隙間をなくし、M4へリックスの向きを変えることでゲートを閉める、というのがメカニズムである(図5)。つまり、M2へリックスの螺旋の巻き方がスイッチの役目を果たす。
それでは、基底状態と遷移状態間の25°の回転が何に依存しているかというと、Aドメインの回転によって、基底状態では燐酸化部位から完全に排除されていた水分子が1分子だけ入る隙間ができ、そこに導入された水分子がAドメインにあるTGESモチーフ中のグルタミン酸残基により活性化され、燐酸化アスパラギン酸を攻撃することによって加水分解反応が進行することである[3][3] C. Toyoshima: Arch. Biochem. Biophys. 476 (2008) 3-11.。実際、基底状態でTGを加えるとゲートは閉まるので、基底状態のAドメインの位置でゲートの開閉は起こりえると考えられる。それが、加水分解反応の進行によって閉まった状態(すなわち構造変化)が安定化されるのである。
4.ナトリウム・カリウムポンプの結晶構造解析
ほとんどの動物細胞で、細胞内のK+濃度は細胞外より50倍近く高く、Na+は10倍ほど低く保たれている。これは前述のようにNa+, K+-ATPaseの働きによるものだが、Na+, K+-ATPaseは単なるポンプではなく、細胞間接着や高血圧、多くの癌にも深く関わることが判ってきている。Na+, K+-ATPaseはα、βサブユニットと調節蛋白質であるFXYD蛋白質から成る。我々は、鮫直腸腺由来酵素の結晶化に取り組み、E2・2K+・MgF42−状態(E2・2K+・Pi状態のアナログ)のほぼ全構造を2.4 Å分解能で初めて決定できた(図6)[4][4] T. Shinoda, H. Ogawa, F. Cornelius and C. Toyoshima: “Crystal structure of the sodium-potassium pump at 2.4 Å resolution.” Nature 459 (2009) 446-450.。この結果、K+の配位に関する詳細が判明し、ほとんど同じ残基が使われているにもかかわらず、どうしてCa2+-ATPaseではK+を結合できないのか、また、K+結合に何故βサブユニットが必要かも本研究により解明できた。さらに、FXYD蛋白質のFXYDモチーフの構造的意味も明らかになった。βサブユニットの細胞外ドメインは細胞接着に関わる分子と良く似た構造をとっており、4箇所で糖鎖修飾を受けている可能性があるが、結晶化のために糖鎖を切断する必要は無く、そのうちの2箇所で1〜2残基を解像できた。図1、6から、糖鎖は分子間の間隙に収納されていることが分かる。
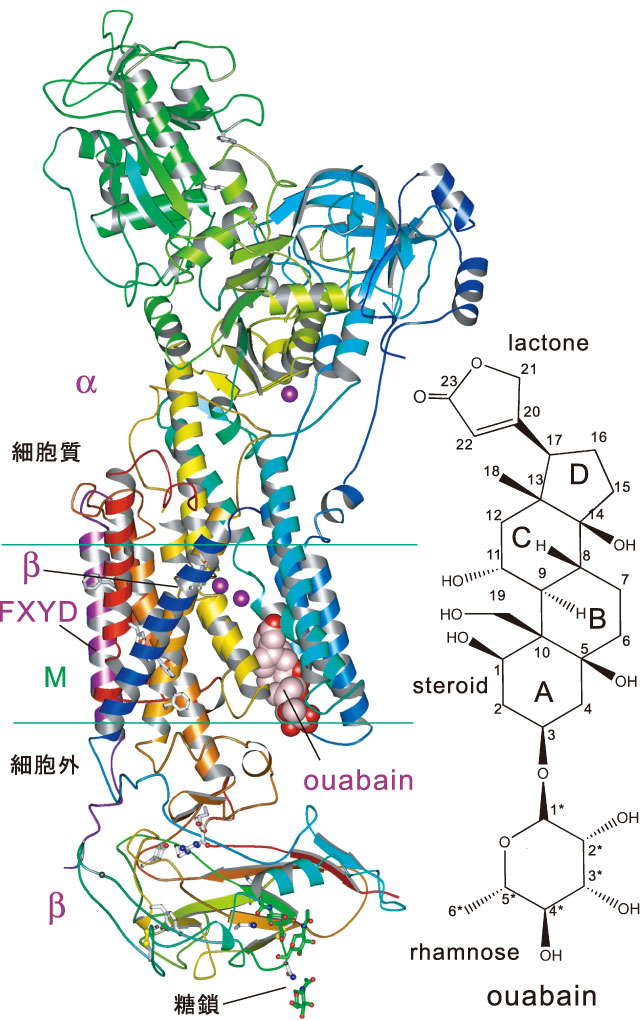
図6 Na+, K+-ATPase-ウアバイン複合体の結晶構造とウアバインの化学構造。E2・2K+・MgF42−状態。結合しているK+(紫色の小さい玉)とウアバインは空間充填モデルで示した。
Na+, K+-ATPaseは心臓病との関係でも極めて重要な蛋白質であり、医学的影響も絶大である。特に、ジギタリスやウアバインに代表される強心配糖体は2世紀以上に渡って治療薬として使われているが、Na+, K+-ATPaseの強力な阻害剤であるため危険でもある。E2・2K+・MgF42−結晶を用いて、ウアバインの結合様式とそれに伴う構造変化を決定できた(図6)[5][5] H. Ogawa, T. Shinoda, F. Cornelius and C. Toyoshima: Proc. Nat. Acad. Sci. USA 106 (2009) 13742-13747.。ウアバインはαサブユニットの細胞外側表面に結合するというモデルが流布していたが、実際は、膜貫通領域の奥深くまで挿入されており、細胞外側ゲートを閉じられなくすることが事の本質であることが判明した。この構造は、K+が結合しているために低親和状態ではあるが、高親和状態も結合の本質的な部分は同一と考えられるので、医学的にも大きな貢献が出来るであろう。
参考文献
[1] C. Toyoshima, M. Nakasako, H. Nomura and H. Ogawa: Nature 405 (2000) 647-655.
[2] C. Toyoshima, Y. Norimatsu, S. Iwasawa, T. Tsuda and H. Ogawa: Proc. Nat. Acad. Sci. USA. 104 (2007) 19831-19836.
[3] C. Toyoshima: Arch. Biochem. Biophys. 476 (2008) 3-11.
[4] T. Shinoda, H. Ogawa, F. Cornelius and C. Toyoshima: “Crystal structure of the sodium-potassium pump at 2.4 Å resolution.” Nature 459 (2009) 446-450.
[5] H. Ogawa, T. Shinoda, F. Cornelius and C. Toyoshima: Proc. Nat. Acad. Sci. USA 106 (2009) 13742-13747.
豊島 近 TOYOSHIMA Chikashi
東京大学 分子細胞生物学研究所
〒113-0032 東京都文京区弥生1-1-1
TEL:03-5841-8492 FAX:03-5841-8491
e-mail : ct@iam.u-tokyo.ac.jp








