Volume 12, No.3 Pages 283 - 286
3. 最近の研究から/FROM LATEST RESEARCH
多剤排出トランスポーターの立体構造と作動機能
Cristal Structure and Reaction Mechanism of Multidrug Efflux Transporter
大阪大学 産業科学研究所 The Institute of Scientific and Industrial Research,Osaka University
1.はじめに
化学療法に基づく現代医療における最も深刻な問題の一つに、薬が効かなくなる現象、つまり薬剤耐性化が挙げられる。一般には院内感染などに見られる病原性細菌による抗生物質耐性化や、末期がん、再発がんに見られる抗がん剤耐性化などとして知られている。最近でも多剤耐性緑膿菌による院内感染が報じられ、社会問題の一つとなっている。薬剤耐性化のメカニズムには幾つかが知られているが、ここで見られる多剤耐性化には細菌の細胞膜に存在する多剤排出トランスポーターという膜タンパク質が大きな役割を担っている。薬剤の多くは細胞の中に入るか細胞膜のごく近傍で効果を発揮するが、その薬剤の分子をこの多剤排出トランスポーターが、細胞内や細胞膜から能動的に排出することで多剤耐性化が起こる。
この問題が複雑なところは、一種類の多剤排出トランスポーターが、化学構造や作用機序の異なる多種多様な薬剤を排出することができる点である。つまり、一種類の膜タンパク質の働きにより多くの種類の薬剤がどれもこれも効かなくなるのである。生化学の世界では、酵素等あるタンパク質はある特定の基質にのみ作用すると考えられており、それらは時に"鍵と鍵穴"の関係に例えられるが、この多剤排出トランスポーターはその例外であり、極めて広い基質選択性を持つといえる。しかし、何でもかんでも排出してしまうという訳ではなく、細胞にとって異物となる薬剤などは排出するが、糖やアミノ酸などの細胞にとって有用な物質を誤って排出することはなく、異物のみを見分ける厳密さも兼ね備えているといえる。
この生物科学上では例外的な多剤排出トランスポーターの立体構造を解明し、どのような仕組みで、作用機序や化学構造の異なる多種多様な薬剤が基質として認識され、そして排除されるかが理解できれば、生化学の一般原則から逸脱するユニークな基質認識機構の理解に繋がるばかりでなく、薬剤排出トランスポーターで排出されないような新薬の開発や、排出トランスポーター阻害剤を開発することで、薬剤耐性化により有効性が低下してしまった薬剤に再び薬効を復活させるなど、多剤耐性化問題に対する本質的な解決策を与えるという応用面での展開も期待できる。
2.膜輸送体タンパク質(トランスポーター)
全ての生物は細胞から構成されている。そして全ての細胞の表面は細胞膜によって包まれている。細胞膜はリン脂質によって構成されるため、その中央付近は誘電率が極めて低く、イオンや極性物質を透過させることができない。そのため細胞膜は細胞と外界、つまり自己と非自己を隔てる障壁として働き、細胞質を外部環境と異なる状態に維持する。また細胞膜中や細胞膜表面には多くの膜タンパク質が存在し、種々の生理的に重要な反応を行っている。透過障壁である細胞膜を介した物質の輸送、すなわち膜輸送は極めて基本的な生理現象である。それは細胞膜に存在する種々のチャネル、ポンプや、トランスポーター(膜輸送体)と呼ばれる膜タンパク質を介して行われる。一般にチャネルとポンプは、イオンを輸送し、トランスポーターは栄養素や薬剤等の有機物質を輸送すると類別されている。また、チャネルは受動的なイオンの流入を司り、ポンプとトランスポーターは細胞のエネルギーを使って能動的輸送を行う。
例えば細胞の生育に必要な糖やアミノ酸などの有用物質を細胞内に積極的に取り込むためのトランスポーターは多く知られている。それによって輸送される糖などの親水性基質はトランスポーターの分子内部にある透過経路を経て細胞内に取り込まれるため、細胞膜を直接透過する必要がない。一方、疎水性の有機物質は単純拡散により細胞膜に分配され、その後細胞質に拡散してゆく事ができるため、細胞にとって異物となるような薬物や、毒物のような有害物質が細胞内に入ってきた場合、それらを細胞質から細胞外へと膜を介して排除するトランスポーターも多く存在する。これらは多剤排出トランスポーターと呼ばれ、今では細菌からヒトの細胞に至るまで広く生物界に分布する最も基本的な生体防御機構であると認知されている。
3.多剤排出トランスポーターの結晶構造解析
多剤排出トランスポーターのような膜タンパク質の立体構造を原子レベルで決定するためには、X線結晶構造解析が最も有力な手段の一つである。そのため先ず対象となるタンパク質を大量に純化し、結晶化する必要がある。膜タンパク質に関しては、疎水性の高さ故に結晶化が極めて困難とされ、さらにトランスポーターは、ある程度の大きさを持つ有機物質を輸送するという働きの上から分子ゆらぎが大きいとされ、結晶化は不可能ではないか?との悲観論が支配的で、著者らの研究以前には原子レベルでの構造解析例はただの一つも無かった。著者らは、院内感染等で問題となっている緑膿菌や、セラチア菌と同じくグラム陰性細菌であり、諸々の分子生物学的手法が確立している大腸菌をモデル細胞として捉え、大腸菌の持つ最も強力な薬剤排出トランスポーターであるAcrBタンパク質に着目し、結晶化および構造解析に着手した。AcrBは、抗生物質、消毒剤、抗がん剤、色素性毒素や、界面活性剤など、構造に関連性のない多種多様な物質を、膜を介したプロトン濃度勾配の駆動力を用いて細胞外へと排出する、大腸菌の持つ薬剤抵抗性の主因である。
私たちはSPring-8、BL44XUを用いた回折実験を経て2002年に世界初となる、大腸菌主要多剤排出トランスポーターAcrBの3.5Å分解能でのX線結晶構造解析に成功した[1]。アミノ酸約千個余りからなるAcrB分子は同じタンパク質分子3個が合体したもの(三量体)であることが明らかになったほか、12本ある膜貫通へリックスの配置や、基質取り込み口の発見、AcrA分子の結合部位など、多くの新しい知見を与えた。また共役して機能する外膜チャネルTolCとの直接的相互作用を示唆し、AcrA-AcrB-TolCの新規複合体モデルを提唱した[2](図1)。
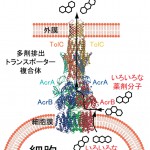
図1 多剤排出トランスポーター複合体の模式図
細胞膜を貫通するAcrBと細胞外膜を貫通するTolCと、それらを繋ぐAcrAは大きな分子複合体を形成し、細胞の中から、細胞外へ様々な薬剤を排出する。
多剤排出トランスポーターとして世界初の構造解析であるというばかりでなく、膜を介して分子を輸送する膜輸送体としても世界初の解析例となるこの成果は、英国科学誌ネイチャーに掲載され、同巻の表紙を飾り世界中から大きな注目を集めた。それからSPring-8、BL41XUを用いた長期利用課題による研究をつづけ、2006年8月、AcrB三量体と基質である抗生物質や、抗がん剤とをそれぞれ結合させた状態で構造解析を行う事に成功し、どのような仕組みでAcrB三量体が多種多様な薬剤を認識し、そしてそれらを排出するのかという作動メカニズムを2.8Å分解能の詳細な立体構造を基に明らかにした[3](図2)。これも世界初の多剤排出トランスポーターと薬剤の複合体の結晶構造解析例であり、ネイチャー誌のアーティクルとして取り上げられた。
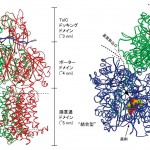
図2 大腸菌多剤排出トランスポーターAcrB・薬剤複合体の結晶構造
Aは細胞膜に対して横方向から観たところで、Bは細胞外から垂直方向に観たところ。三量体をそれぞれ異なる色で示した。青く描かれたモノマー中に在る空間充填図で描かれた分子は、結合する基質(抗生物質ミノサイクリン)を表す。薬剤は細胞膜の上辺りからAcrB分子内へ取り込まれ、結合した後、分子の頭頂部から排出され、TolC分子を経て細胞外へと排出される(左図矢印および図1参照)。
得られた構造は、2002年に解析したものと本質的に同じであった。しかし、詳細に三つのプロトマーの構造を比較することで、構造が異なる部分が幾つか存在し、AcrB三量体は非対称的であることが判明した。それらは、各々輸送サイクルにおける三種類の機能状態のうちの1つに対応していることが判った。それらは、ペリプラズム空間への薬剤の入り口が開いた構造(取込型)、内部に薬剤を結合させている構造(結合型)、外膜チャネルへとつながる薬剤の出口が開いた構造(排出型)、の三つである。基質は、結合型プロトマーの水溶性ドメインにある拡張した結合ポケット内に見出された。このポケットは芳香族アミノ酸に富んでおり、幾つかの芳香族アミノ酸の組み合わせにより結合部位を形成している。構造の異なる基質に対しては、異なる芳香族アミノ酸の組み合わせにより対応することが解り、複数の組み合わせにより複数の基質の結合が可能な「マルチサイト型」認識である事が判明した。さらにポケットの体積変化で、基質の親和性を変化させる機構も明らになった。
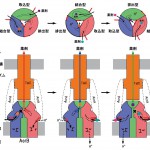
このようにAcrB三量体に含まれるそれぞれのプロトマーが、それぞれ異なる三つの異なる構造および状態を持っていて、それぞれが順番に,取込型→結合型→排出型(そしてまた取込型→・・・)、の順序で構造および状態を回帰的に変化させることで、基質の輸送状態が一定に変化する機構として説明できた。この機構は、F1ATPaseにおける回転触媒機構と共通する部分が多いことから、AcrBによるこの回帰的な協調性の伝搬機構を、機能的回転機構と名付け、薬剤の能動的輸送機構として提唱した[3](図3)。
図3 機能的回転メカニズム概念図
Aが細胞膜に対して垂直方向上から見た図で、Bが細胞膜に対して横方向から見た図。左列A、Bが、図2Bおよび2Aに相当する。それぞれ、取込型、結合型、排出型の三つの状態を含んだ三量体が、それぞれ状態をひとつずつ回帰的に循環させ基質の一方向への能動的輸送を行うため、あたかも回転しているように見える。
4.まとめ
院内感染や再発がん、末期がんに見られる多剤耐性化問題の原因タンパク質である多剤排出トランスポーターと、抗生物質や抗がん剤との複合体の結晶構造をより詳細に調べることで、多剤排出トランスポーターが薬剤分子のどのような部位のどのような特徴を識別し、そして排出するのかが原子レベルで理解できた。また、これらの知見を利用し、この仕組みによって認識され、排出されないような新薬設計や、逆に結合部位に固く結合し、その機能を抑えるトランスポーター阻害剤の開発が期待できる。そうなれば、これまで排出による耐性化でその効力を失っていた過去の薬剤にもう一度活躍の場を与えることができるかもしれない。歴史的な薬剤は副作用や禁忌などの知識の集積が厚く、それを再び用いる事ができれば、新薬を開発するよりもメリットが大きいとも考えられている。そのほか基質結合部位以外にも、このタンパク質の機能上重要な、いわゆる"攻めどころ"がつぶさに見えた。このように阻害剤や回避剤の合理的設計など応用面での展開も見込める本成果は、大いに注目を集めている。
5.おわりに
本研究は長期利用課題によるサポートにより長期にわたって豊富に与えられたビームタイムにより初めて成しえたものであると考えている。ここで扱った研究対象は多剤排出トランスポーターで、基質が多様な膜タンパク質である。実際に著者らは50種類以上もの基質化合物との複合体構造を求め、当初は基質を含む溶液に対する浸潤法をとり、個々のデータを取得したのち解析計算を行ったが、全てに於いて基質結合を認められなかった。その後すべての化合物に対して共結晶化により一つずつ複合体形成を確かめることにした。膜タンパク質の結晶化は難しいことが知られているが、基質との複合体ともなるとなおさらである。本当のことをいうと図2にある多剤排出トランスポーター・基質複合体の立体構造を明らかにするのに著者らは2年近くの歳月を費やしている。その間全くポジティブなデータが出なかった時期があった。だからもしもこの研究を一般の課題で行わねばならなかったとするなら、継続して課題申請が認められたかどうかは定かではないだろう。長期にわたって安定したビームタイムが与えられる長期利用課題はこのようなチャレンジングな課題に果敢に取り組む時にとても有り難い仕組みであった。課題選定から続行に関わられた委員会の関係諸先生方や、ビームラインサイドの山本雅貴、河本正秀、清水伸隆、酒井久伸、諸先生がたにこの場をお借りして心から感謝の意を表したいと思います。
脚注
本研究は、大阪大学・産業科学研究所・中島良介助手、松本崇研究員、大阪大学・蛋白質研究所の山下栄樹助手との共同研究として、大阪大学・産業科学研究所・山口明人教授の研究室にて行われた。
参考文献
[1]S. Murakami, R. Nakashima, E. Yamashita, A. Yamaguchi : Crystal structure of bacterial multidrug efflux transporter AcrB., Nature 419 (2002) 587-593.
[2]N. Tamura, S. Murakami, Y. Oyama, M. Ishiguro and A. Yamaguchi : Direct interaction of multidrug efflux transporter AcrB and outer membrane channel TolC detected via site-directed disulfide cross-linking., Biocheistry 44 (2005) 11115-11121.
[3]S. Murakami, R. Nakashima, E. Yamashita, T. Matsumoto, A. Yamaguchi : Crystal structures of a multidrug transporter reveal a functionally rotating mechanism., Nature 443 (2006) 173-179.
村上 聡 MURAKAMI Satoshi
大阪大学 産業科学研究所
〒567-0047 大阪府茨木市美穂ヶ丘8-1
TEL:06-6879-8547 FAX:06-6879-8549
e-mail : mura@sanken.osaka-u.ac.jp