Volume 11, No.4 Pages 252 - 256
2. 最近の研究から/FROM LATEST RESEARCH
ホタルの発光酵素(ルシフェラーゼ)の発光色制御機構の構造生物学的解明
Structural Basis for the Color Control Mechanism in Firefly Luciferase
1 .はじめに
初夏になるとホタルはお互いのコミュニケーションの手段として黄緑色の発光を行い明滅し、我々はこの幻想的な発光現象を見て楽しんでいる。ホタルやホタルイカに見られる生物発光現象はルシフェラーゼと呼ばれる発光反応を触媒する酵素タンパク質(発光酵素)と、ルシフェリンという発光のもとになる物質(発光基質)が反応することにより生じる。しかし生物によりルシフェラーゼやルシフェリンは全く違ったものであり、発光反応機構も異なっている。
ホタルのルシフェラーゼによる発光反応は図1に示したような2段階で進行する[1]。まずルシフェリンのカルボキシル基がATPのα位のリン酸部位を攻撃し、ルシフェリルAMP中間体を酵素中で一旦生成する。その後、酸素が中間体と反応した後、励起状態のオキシルシフェリンが生成し、これが基底状態のオキシルシフェリンに変わる際、エネルギーを黄緑色の発光として放出するというものである。1960年から70年代にかけて発光反応機構の解明が精力的に行われ、図1aのような反応機構であることがほぼ明らかとなった。このころまではルシフェリンやオキシルシフェリンを中心にした化学研究が中心であったが、1985年にアメリカ産ホタルのルシフェラーゼのクローニングが初めて行われ[2]、研究の中心はルシフェラーゼに向かい始めた。そして1996年にはアメリカ産ホタルルシフェラーゼの立体構造が明らかとなった[3]。しかしこの立体構造はリガンドが結合していない立体構造であったため、活性中心の構造は依然不明のままであり、実際にどのようにして発光反応が進行していくのかはほとんど未解明であった。
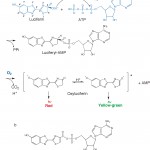
図1 a: ホタルルシフェラーゼの発光反応機構、b: 中間体アナログ
ホタルによる発光反応に関しては、2つの特徴が知られている。1つ目は量子収率が約90%と非常にエネルギーの変換効率が高いということ[4]、そして2つ目は発光色が黄緑色から赤色に変化するということである。反応のpHを中性から酸性に変化させると発光が赤色に変化することは約40年前には知られていた。さらに1991年にはキッコーマンの梶山らによりゲンジボタルのルシフェラーゼの286番目のアミノ酸Serを1残基Asnに変える(S286N変異)だけで発光色が赤色に変わるということも明らかとなっていた[5]。この発光色の変化は図1aのように、発光するときのオキシルシフェリンがケトーエノール互変異により変化し、その状態が違うことで発光色が異なるという説、オキシルシフェリンの平面性の違いにより発光色が異なるといった説などいくつか存在していた。しかしこれらの説ではルシフェラーゼのS286N変異による発光色の変化を説明することができず、ルシフェラーゼが発光色を制御するメカニズムのなぞは深まるばかりであった。そこで筆者らはこの点に注目し、単にルシフェラーゼの酵素反応機構を明らかにするということだけではなく、どのような仕組みで発光色が制御されているのか、その仕組みまで明らかにすることを目標とした。その結果、日本の代表的なホタルであるゲンジボタルの黄緑色発光する野生型と赤色発光S286N変異体のルシフェラーゼの立体構造を決定し、それらの違いを見いだすことができた[6]。本稿ではホタルがどのようにして発光色を制御しているのか、そのメカニズムの解明を中心に紹介する。
2.SPring-8での実験
ゲンジボタルルシフェラーゼの結晶化はPEG4000を沈殿剤として用い、塩としてLiClを用いたときに良好な結晶が得られた。僅かな構造の違いを明確にすることを意識して改良を繰り返し、1.5〜1.3Å分解能という非常に高い分解能を有する結晶を得た。本結晶の回折強度データを収集する際、主にSPring-8のビームラインBL45XU-PXを利用させていただいた。本結晶は空間群がP 212121で格子定数がa = 58Å, b = 182Å, c = 54Åと1軸が長い結晶であった。結晶は板状もしくは柱状であり、結晶が成長していくのはa軸方向であった。そのため、長い格子のb軸を測定の回転軸と一致させることが困難であったため、回折点をうまく分離できるかどうか心配であった。しかしBL45XU-PXの非常に平行性の良いX線、検出面積が大きいR-AXIS V、さらには振動角が0.5度でも大丈夫であったゴニオメーター(後に0.3度でもデータ収集を行い、非常に良いデータが得られた)と非常に恵まれた環境のおかげで、質の良い高分解能回折強度データが収集できたことで細かな議論が可能な構造解析が達成された。
3.ホタルルシフェラーゼのX線結晶構造解析
ルシフェラーゼがどのようにして発光反応を行っているのかを理解するためには、実際に発光が行われている状態を見ることが最もよいと考えられる。しかしながらこの状態は励起状態であり、実際にその状態を結晶解析で捕らえることは不可能である。そこで、発光反応に伴うルシフェラーゼの一連の反応がどのように進行しているのか、ということを明らかにすることを目的として、(1)反応前としてATP複合体、(2)発光直前として中間体アナログ複合体、(3)発光終了後として反応生成物(AMP-オキシルシフェリン)複合体のX線結晶構造解析を行った。ルシフェリルAMP中間体は酵素中でいったん作成されるので、完全な嫌気条件を作り上げることができれば、構造を直接捕らえることは可能であるが、実際にはそれは難しかった。そこでルシフェリルAMP中間体の構造を基に、図1bに示した中間体アナログ5’-O-[N-(dehydroluciferyl)-sulfamoyl] adenosine (DLSA)を合成し、構造解析に用いた。この化合物は構造を安定化するために、ルシフェリルAMP中間体ではP-O結合であるところをS-N結合にし、またルシフェリンの4,5位の炭素間を二重結合にして4位の水素を初めからなくした状態に変更した。この変更のおかげで、酸素による攻撃を受けない構造になっており、酸化される直前であたかも止まっているかのような状態にすることが可能であった。反応終了後の構造はあらかじめルシフェラーゼに対し基質すべてを与えて発光反応を進行させ、その後結晶化を行うということで、反応終了後の状態すなわち、オキシルシフェリンとAMPとの複合体を作り上げた。通常酵素は反応生成物を放出するが、ルシフェラーゼは反応生成物との結合が強く、生成物による阻害が非常に大きいことが知られており、この性質をうまく利用することができたのである。
構造決定は、すでに構造解析されているアメリカ産ホタルのルシフェラーゼの構造を用いた分子置換法により行った。ルシフェラーゼの構造はN末端のラージドメインとC末端側のスモールドメインから構成されているが、分子置換により解が得られた際、N末端ドメインの電子密度は観測できたもののC末端ドメインの電子密度はほとんど観測されなかった。そこで、N末端ドメインのみ分子モデルを構築し精密化を進めたところ、C末端ドメインの電子密度も現れ、すべての分子モデルを構築することができた。図2のようにゲンジボタルとアメリカ産ホタルの各ドメインの構造はほぼ同じで、両ドメイン間の配置だけが異なっていた。ゲンジボタルルシフェラーゼの構造においてDLSAは両ドメイン間の間に存在しており、ここが活性部位であることが初めて判明した。すなわち、リガンドが結合していないときは活性部位が空いた状態になっており、リガンドが結合するとドメインが77度の回転と7Åの移動を伴って、閉まった状態になることがわかった。
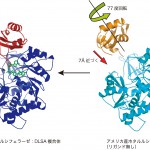
図2 ゲンジボタルルシフェラーゼ-DLSA複合体の3次元構造(左)とアメリカ産ホタルルシフェラーゼの3次元構造(右)
4.ルシフェラーゼの発光反応機構
ゲンジボタルルシフェラーゼのリガンドが結合した3種類の構造を比較すると、反応前のATP複合体と発光反応後のAMP-オキシルシフェリン複合体の構造では大きな違いはなかった。しかしながら発光直前のDLSA複合体では図3aを見るとわかるようにIle288付近にだけ重要な動きが観測された。すなわち、Ile288のCαの位置で1.5Åの動きがあり、側鎖を回転させながらルシフェリン結合部位の方へ移動していたのである。反応前後のATP複合体やAMP-オキシルシフェリン複合体ではSer286とGlu313が水素結合していたが、DLSA複合体ではこの水素結合は形成されておらず、Ser286は水を介してAsn231、Tyr257と水素結合していた。さらに、DLSAのベンゾチアゾール環を取り巻いている環境は非常に疎水性が高く、Ile288が発光直前に動くことで最終的に発光するときの疎水的な環境が完成すると考えられた。すなわち、野生型のルシフェラーゼはその反応に伴って構造変化を引き起こし、励起状態のオキシルシフェリンを非常に高い疎水的な環境下におき、黄緑色の発光を行うと考えられるのである。しかしながら、この動きは発光を行うために必要なことなのか、それとも黄緑色に発光するために必要な動きであるのかは、これら3つの構造解析では明らかにできなかった。

図3 ゲンジボタルルシフェラーゼのルシフェリン結合部位における構造比較
a: 野生型ルシフェラーゼ-DLSA複合体(緑色)と野生型ルシフェラーゼ-AMP-オキシルシフェリン複合体(灰色)の比較
b: S286Nルシフェラーゼ-DLSA複合体(桃色)と野生型ルシフェラーゼ-AMP-オキシルシフェリン複合体(灰色)の比較
c: 野生型とS286NのDLSA複合体のvan der Waals interactionの比較、DLSAを青色、野生型のIle288を緑色、S286NのIle288を赤色で示した。ただしDLSAと接触している部分は濃い色、接触していない部分は薄い色で示した。
そこですでに赤色に発光することがわかっているS286N変異体についてDLSA複合体の構造解析を行った。その結果、図3bのようにS286N-DLSA複合体の構造は野生型の反応終了後の構造と同じであり、S286N変異体ではIle288の動きは観測されなかった。これは野生型におけるSer286がAsnに変異したことで、Glu313との水素結合だけではなく、水との水素結合が増え、この水を介した水素結合ネットワークの形成がIle288の動きを妨げたのだと考えられた。S286N変異体は赤色発光を行うものであるから、Ile288の動きは黄緑色に発光するために必要であることが明らかとなった。さらに野生型とS286N変異体のDLSA複合体について図3cのようにvan der Waals interactionの比較を行った。野生型ではDLSAのベンゾチアゾール環はIle288の側鎖の3つの炭素原子と接触しているものの、S286N変異体ではIle288の動きが無いため、1つの炭素原子が接触しているだけであった。DLSAのベンゾチアゾール環を取巻くアミノ酸残基に関しIle288以外はほぼ同じ位置に存在していた。またDLSAの構造についても2つの構造においてほぼ同じであった。したがって両方の構造における違いはIle288の接触の仕方のみであることから、発光するときのオキシルシフェリンの結合部位に関する疎水性の程度の違いが発光色に大きく関係していると考えられた。これら結果を総合すると次のように考えられる。すなわち、黄緑色に発光する野生型のルシフェラーゼでは発光体のオキシルシフェリンをしっかりと握りしめ、励起状態から基底状態への変化に伴うエネルギーをしっかりと保っている。しかしながら赤色に発光する変異体では発光のときの握りしめ方が弱いため、このエネルギーを振動(熱)として一部無駄に放出してしまい、エネルギーの低い(すなわち、波長の長い)赤色の発光になると考えられた。すなわち、酵素とリガンドとの空間的な配置が完璧であることが発光色制御の原理であることが予想された。
さらにこのことを確認するため、野生型のルシフェラーゼを用いてI288V、I288Aという変異体を作成した。この変異体であればたとえ288番目の残基が動いたとしても、オキシルシフェリンを取り囲む疎水的で相補的な環境は不完全となり、Ile288が動かなかったときと同様に発光色が変化するはずだと考えたからである。I288V、I288A変異体の発光色を測定した結果、図4に示したようにその側鎖の大きさに合わせて発光色がよりエネルギーの低い(波長が長い)橙色、そして、赤色へと順番に変化していった。予想が的中したのだ。 
図4 野生型と3つの発光色変異体(I288V,I288A,S286N)による発光
5.最後に
今回初めてホタルルシフェラーゼとルシフェリンの相互関係を明らかにできたわけであるが、実際に発光しているオキシルシフェリンの構造が黄緑色の時と赤色の時で同じであるのか違うのか、ということはまだわかっていない。さらにこれまでエネルギーが低い赤色に発光がシフトするルシフェラーゼはたくさん作られてきたが、エネルギーが高くなる青色に発光するルシフェラーゼは作成が可能なのか?可能であるならどのようにすればできるのか?など、まだまだ発光色の制御機構についてもその疑問は尽きない。またホタルがもつ最大の特徴である量子収率が高い理由について、ルシフェラーゼの活性中心のもつこの疎水的で相補的な環境が影響していると考えられるが、どうして90%もの高効率を生み出せるのかは不明であり、この理由についても是非これから明らかにしていきたい。
本研究は筆者らが理化学研究播磨研究所メンブレンダイナミクス研究グループ速度論的結晶学研究チームに在籍時代に主に行ったもので、市山進研究員(現学習院大学助手)、小橋信行研究員(現理化学研究所吉田化学遺伝学研究室協力研究員)、中間体アナログを合成していただいた平竹潤京都大学化学研究所助教授との共同研究による成果である。またX線回折実験においてはSPring-8の理研ビームラインスタッフの方に多大なるご協力をいただいたことを、この場をお借りして感謝いたします。
参考文献
[1]M.Deluca : Firefly luciferase.Adv Enzymol Relat Areas Mol Biol 44(1976)37-68.
[2]J.R.de Wet, K.V.Wood, D.R.Helinski and M.DeLuca : Cloning of firefly luciferase cDNA and the expression of active luciferase in Escherichia coli.Proc Natl Acad Sci U S A 82(1985)7870-3.
[3]E.Conti, N.P.Franks and P.Brick : Crystal structure of firefly luciferase throws light on a superfamily of adenylate-forming enzymes.Structure 4(1996)287-98.
[4]H.H.Seliger, and W.D.McElroy : Spectral emission and quantum yield of firefly bioluminescence.Arch.Biochem.Biophys. 88(1960)136-141.
[5]N.Kajiyama and E.Nakano : Isolation and characterization of mutants of firefly luciferase which produce different colors of light.Protein Eng 4(1991)691-3.
[6]T.Nakatsu, et al.: Structural basis for the spectral difference in luciferase bioluminescence. Nature 440(2006)372-6.
中津 亨 NAKATSU Toru
京都大学大学院 薬学研究科 構造生物薬学分野
〒606-8501 京都市左京区吉田下阿達町46-29
TEL:075-753-4606 FAX:075-753-9272
e-mail : nakatsu@pharm.kyoto-u.ac.jp
加藤 博章 KATO Hiroaki
京都大学大学院 薬学研究科 構造生物薬学分野
〒606-8501 京都市左京区吉田下阿達町46-29
TEL:075-753-4617 FAX:075-753-9272
e-mail : katohiro@pharm.kyoto-u.ac.jp








