Volume 10, No.5 Pages342 - 345
2. 最近の研究から/FROM LATEST RESEARCH
ナノビームによる細胞選択的元素測定 〜精子に取り込まれた微量スズの検出に世界で初めて成功〜
Cell-selective Determination of Trace Elements in Testis by SR-XRF Analysis with Nanoprobe
[1]放射線医学総合研究所 National Institute of Radiological Sciences、[2]北里大学 獣医畜産学部 Kitasato University, School of Veterinary Medicine & Animal Sciences、[3](財)高輝度光科学研究センター JASRI
- Abstract
- Organotin compounds are widely used in industry and its environmental contamination by these compounds has recently become a concern. It is known that they act as endocrine disruptors but details of the dynamics of Sn in reproductive organs are still unknown. In the present study, we attempted to determine Sn in the testis of rats exposed to tributyltin chloride (TBTC) cell-selectively by synchrotron radiation X-ray florescence analysis with nanoprobe. TBTC was orally administered to rats at a dose of 45 µmol/kg per day for 3 days. One day later, Sn was detected in spermatozoa at the stage VIII seminiferous tubule, which are the final step of spermatogenesis in the testis. Sn levels in the microdissectioned seminiferous tubules determined by inductively coupled argon plasma-mass spectrometry were approximately equivalent to that in the testis. These data indicate that Sn accumulates in germ cells as well as in spermatozoa in a short period of TBTC exposure.
1.はじめに
精巣の精細管上皮では、年輪のように統制されて配置した生殖細胞が系統だった分裂・分化を経て精子形成が行われている。この過程は環境ストレス(放射線、環境化学物質、重金属等)に対して感受性が高い。近年、環境ホルモン(内分泌撹乱化学物質)の問題や少子化社会を背景に環境ストレスによる次世代への影響に関心が高まっている。精子形成への環境ストレスの作用機序を明らかにするためには、複雑な精巣の構造をふまえてストレッサーの挙動を把握する必要がある。このような観点から、これまで我々は精巣における細胞選択的な元素測定手法の開発を行ってきた[1-3][1]S. Homma-Takeda, Y. Nishimura, Y. Watanabe, H. Imaseki and M. Yukawa : Int. J. PIXE 11 (2001) 103.
[2]S. Homma-Takeda, Y. Nishimura, Y. Watanabe and M. Yukawa : Biomed. Res. Trace Elements 13 (2002) 236.
[3]S. Homma-Takeda, Y. Nishimura, Y. Watanabe, H. Imaseki and M. Yukawa : J. Radioanal. Nucl. Chem. 259 (2004) 521.。
トリブチルスズやトリフェニルスズなどの有機スズ化合物は、船底塗料や魚網防汚剤に混入され海洋汚染を引き起こしており、汚染食品を介しての摂取やその環境ホルモン様作用が危惧されている。しかしながらスズは汎用の分析手法では分析感度が不足して検出が困難な元素であるため、精巣内のスズの挙動に関する研究がほとんどなされていなかった。我々はSPring-8の放射光を使った蛍光X線分析がこれを打破する新たな研究手段になるのではと考え、精巣中の微量スズ(数百ppb〜数ppm(ppb/10億分の1、ppm/百万分の1)の分析に取り組んだ。
2.精巣の構造
精巣内には長い精細管が詰まっている。この精細管の上皮には、大きく分けて精原細胞、精母細胞、および精子細胞などの種類の異なる生殖細胞が配列している。これらの生殖細胞はこの配列を維持したまま成長していく。精原細胞から精母細胞、精子細胞を経て精子となるが、ラットでは精細管上皮の生殖細胞の配列は14段階の成長段階(ステージ)[4][4]L.D. Russell, R.A. Ettlin, A.P. Sinha-Hikim and E.D. Clegg, in: Histological and Histopathological Evaluation of the Testis, Cache River Press, Clearwater, 1990, p. 41.に区分される(図1)。生殖細胞の種類やステージによりストレスに対する感受性が異なることから[5-8][5]S. Homma-Takeda, Y. Kugenuma, T. Iwamuro, Y. Kumagai and N. Shimojo : Toxicology 169 (2001) 25.
[6]M. Hasegawa, G. Wilson, L.D. Russell and M.L. Meistrich : Radiat. Res. 147 (1997) 457.
[7]K. Henriksen, H. Hakovirta and M. Parvinen : Endocrinology 136 (1995) 3285.
[8]J.H. Richburg, A. Nanez, L.R. Williams, M.E. Embree and K. Boekelheide : Endocrinology 141 (2000) 787.、精巣内でのスズの挙動を把握するためには細胞選択的な測定が不可欠であった。
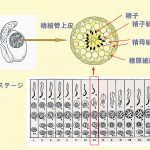
図1 精巣の構造。精細管上皮には外側から精原細胞、精母細胞、精子細胞が配列している。ラットでは生殖細胞の成長段階は14のステージに区分されている。精巣内の精子形成最終段階の精子を有するステージⅧの精細管断面を右上に示した。
3.ナノビーム蛍光X線分析
シンクロトロン放射光蛍光X線分析は、鉱物や金属材料などに比べはるかに華奢な生体試料を破壊することなく元素分析が行えるため、シャープなナノビームを光源として用いれば、精巣の狙った細胞に照射することにより組織の状態のまま個々の細胞の元素情報を収集できる。これまで微少ビーム蛍光X線分析は20 keV以下のエネルギー領域を主体に整備されてきた。この領域内でKあるいはL線の蛍光X線を検出すれば大部分の元素分析をカバーできるからである。しかし生体微量元素分析の立場からは、低いエネルギーのX線ではスズのようにカリウムやカルシウムなどの生体多量元素にL線が埋没してしまう元素に対処できず、これら元素のK線の検出が可能な高エネルギー領域の開発が望まれてきた。昨年、SPring-8生体微量分析ライン(BL37XU)が整備されたことで[9][9]Y. Terada, S. Goto, N. Takimoto, K. Takeshita, H. Yamazaki, Y. Shimizu, S. Takahashi, H. Ohashi, Y. Furukawa, T. Mastushita, T. Ohta, Y. Ishizawa, T. Uruga, H. Kitamura, T. Ishikawa and S. Hayakawa : ATP Conference Proceedings 705 (2004) 376.、ナノビームで、かつスズのK線を利用した蛍光X線分析が可能となり、微細な領域の微量スズの検出が現実化してきた。
4.スズの細胞選択的測定
精巣の横断面の切片には精細管の無数の輪が並んでおり、それらは様々な形をしていることが見て取れる(図2)。生殖細胞の形態的な特徴と精細管ステージ表(図1)を対応させることによりそのステージを判別することが出来る。例えば図2の矢印の精細管は、中央部分である上皮の内側に完成した精子が凝集しており、精巣内での精子形成の最終段階の完成した精子を含有するステージⅧの精細管であることが分かる。このステージⅧの精細管の精子にビームを照射してスズの測定を試みた。

図2 ラット精巣の切片。矢印が測定部位。このステージⅧの精細管で内側の黒い輪に見える部分が精子。
ところで、強力な放射光は厚みが10〜30 µmほどの組織切片試料をほとんど突き抜けてしまうため、透過光のエネルギーロスによって組織構造を可視化することはできない。ビームの照射位置はあらかじめ位置調整したモニター画面に頼るしかないが、これではビームがよりシャープになり、細胞の微細な部分の情報を知りたくなればなるほど厳密な位置確認からはかけ離れていく。そこで、これまでの我々の実験で明らかとなった、ステージⅧの精細管では、精原細胞、精母細胞、あるいは精子細胞などの他の生殖細胞よりも精子部分で亜鉛が高く分布すること[2][2]S. Homma-Takeda, Y. Nishimura, Y. Watanabe and M. Yukawa : Biomed. Res. Trace Elements 13 (2002) 236.を利用して、測定位置の決定は亜鉛のイメージングを照合させることにより行った。これにより精度良く精子に照準を合わせることができた。
トリブチルスズを投与(1日あたり45 µmol/kgの割合で3日間経口投与)したラットの精巣から凍結切片を作成し、測定試料とした。ステージⅧの精細管の精子に3×3 µm2のビームを照射し、600秒計数したところ、スズが検出された(図3)。誘導結合プラズマ質量分析(ICP-MS)によりこの精巣中の総スズ濃度を測定したところ、0.5 µg/gであった。
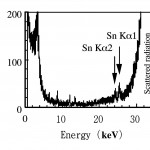
図3 蛍光X線スペクトル。塩化トリブチルスズを45 µmol/kg/dayの割合で3日間経口投与したラットの精巣精細管ステージⅧの精子に3 x 3 µm2のビームを600秒照射した[10][10]S. Homma-Takeda, Y. Nishimura, Y. Terada, S. Ueno, Y. Watanabe and M. Yukawa : Nucl. Instr. Meth. Phys. Res. B 231 (2005) 333.。
5.おわりに
これまで哺乳動物における有機スズの精子形成への影響は十分に理解されていなかった。今回、トリブチルスズの投与後4日目には精子にスズが移行することが判明した。この成果が継世代的な影響も含め、生殖毒性や予防研究の布石となることを期待したい。我々の予備的な実験では、トリブチルスズの投与により細胞死の誘導などの細胞特異的な影響が観察されることから、生殖細胞の種類によるスズ分布の違いを解析し、その量—反応関係を明らかにしていくことが毒性影響解明の鍵となろう。そのためには、現段階では検出感度の向上や測定の安定性、細胞選択手法の簡便化等の課題が残るが、本手法が最強の研究手段となる可能性がある。また、精子形成や生殖組織の機能維持における重要性が指摘されつつも、化学的な情報が欠損している亜鉛等の必須微量元素の生理学的な役割解明や、スズと同様にこのエネルギー領域に含まれる元素(モリブデン、カドミウム、ウラン、セシウム等)の組織内分布の解明に本手法が広く応用されることにも期待が高まる。
謝 辞
本研究は文部科学省ナノテクノロジー総合支援プロジェクトの援助(プロポーザル番号2004A0245-NXb-np-Na/BL37XU)を受けて行われたものであり、ここに深謝いたします。
参考文献
[1]S. Homma-Takeda, Y. Nishimura, Y. Watanabe, H. Imaseki and M. Yukawa : Int. J. PIXE 11 (2001) 103.
[2]S. Homma-Takeda, Y. Nishimura, Y. Watanabe and M. Yukawa : Biomed. Res. Trace Elements 13 (2002) 236.
[3]S. Homma-Takeda, Y. Nishimura, Y. Watanabe, H. Imaseki and M. Yukawa : J. Radioanal. Nucl. Chem. 259 (2004) 521.
[4]L.D. Russell, R.A. Ettlin, A.P. Sinha-Hikim and E.D. Clegg, in: Histological and Histopathological Evaluation of the Testis, Cache River Press, Clearwater, 1990, p. 41.
[5]S. Homma-Takeda, Y. Kugenuma, T. Iwamuro, Y. Kumagai and N. Shimojo : Toxicology 169 (2001) 25.
[6]M. Hasegawa, G. Wilson, L.D. Russell and M.L. Meistrich : Radiat. Res. 147 (1997) 457.
[7]K. Henriksen, H. Hakovirta and M. Parvinen : Endocrinology 136 (1995) 3285.
[8]J.H. Richburg, A. Nanez, L.R. Williams, M.E. Embree and K. Boekelheide : Endocrinology 141 (2000) 787.
[9]Y. Terada, S. Goto, N. Takimoto, K. Takeshita, H. Yamazaki, Y. Shimizu, S. Takahashi, H. Ohashi, Y. Furukawa, T. Mastushita, T. Ohta, Y. Ishizawa, T. Uruga, H. Kitamura, T. Ishikawa and S. Hayakawa : ATP Conference Proceedings 705 (2004) 376.
[10]S. Homma-Takeda, Y. Nishimura, Y. Terada, S. Ueno, Y. Watanabe and M. Yukawa : Nucl. Instr. Meth. Phys. Res. B 231 (2005) 333.
武田(本間) 志乃 HOMMA-TAKEDA Shino
放射線医学総合研究所 緊急被ばく医療研究センター 線量評価研究部
〒263-8555 千葉市稲毛区穴川4-9-1
TEL:043-206-3107 FAX:043-284-1769
e-mail:shino_ht@nirs.go.jp
西村 義一 NISHIMURA Yoshikazu
放射線医学総合研究所 緊急被ばく医療研究センター 線量評価研究部
〒263-8555 千葉市稲毛区穴川4-9-1
TEL:043-206-3107 FAX:043-284-1769
e-mail:y_nishim@nirs.go.jp
渡辺 嘉人 WATANABE Yoshito
放射線医学総合研究所 緊急被ばく医療研究センター 線量評価研究部
〒263-8555 千葉市稲毛区穴川4-9-1
TEL:043-206-3107 FAX:043-284-1769
e-mail:y_nabe@nirs.go.jp
湯川 雅枝 YUKAWA Masae
放射線医学総合研究所 研究基盤部
〒263-8555 千葉市稲毛区穴川4-9-1
TEL:043-206-4193 FAX:043-206-5597
e-mail:m_yukawa@nirs.go.jp
上野 俊治 UENO Shunji
北里大学 獣医畜産学部 獣医公衆衛生学教室
〒034-8628 青森県十和田市東23番町35-1
TEL:0176-23-4371 内443 FAX:0176-23-8703
e-mail:ueno@vmas.kitasato-u.ac.jp
寺田 靖子 TERADA Yasuko
(財)高輝度光科学研究センター
〒679-5198 兵庫県佐用郡三日月町光都1-1-1
TEL:0791-58-0833 内3474 FAX:0791-58-2512
e-mail:yterada@spring8.or.jp
(実験責任者 武田志乃)
使用ビームライン:BL37XU
シフト数:9シフト(2004年3月9日〜12日)








