Volume 17, No.4 Pages 304 - 307
1. 最近の研究から/FROM LATEST RESEARCH
ありふれたセラミックスが大量の水素を取り込んだ
Hydrogen in a Ubiquitous Ceramic
京都大学大学院 工学研究科 Department of Energy and Hydrocarbon Chemistry, Graduate School of Engineering, Kyoto University
- Abstract
- 通常、酸化物中の水素はプロトン(H+)の状態を取っており、組成・構造上の制約が多いことから、ヒドリド(H-)を大量に含む材料は稀であった。これに対し、我々は、水素化物を使った還元法により、いくつかのATiO3型ペロブスカイトで、格子中の約20%の酸素がヒドリドに置き換わった酸水素化物を合成できることを放射光X線回折実験などから見出した。酸化物格子中のヒドリドは、400℃ほどで外界との水素ともよく交換し、高い拡散能が見いだされた。今後は、ヒドリドをもとにした酸化物ベースの様々な物質や応用が期待される。
1.はじめに
水素は様々な物質に含まれている。酸化物系無機材料では、通常、水素は結晶水(H2O)や水酸化物アニオン(OH-)として含まれる。しかし、この水素は、H2O、OH-いずれの場合も正の電荷を帯びたプロトンとして存在し、負の電荷を帯びたヒドリド(H-)であることはほとんどなかった。H-とO2-が混在する系は酸水素化物(oxyhydride)とよばれる。この二つのアニオンはイオン半径が近いため、剛体球モデルの観点からは様々な化合物が得られることが予想されるが、実際には大変珍しい。この理由は、ヒドリド(H-)を含むため、合成に際し強い還元条件が必要であることに伴い、構成金属イオンMn+が金属M0まで還元されてしまうためである。つまり、ヒドリドの強い還元力が合成上の高いハードルとなってきた。今まで、各種プロトン伝導体[1-3][1]S. Steinsvkik, Y. Larring and T. Norby: Solid State Ionics 143 (2001) 103-116.
[2]F. W. Poulsen: Solid State Ionics 145 (2001) 387-397.
[3]T. Norby, M. Widerøe, R. Glöckner and Y. Larring: Dalton Trans. (2004) 3012-3018.やMgO[4][4]Y. Chen, R. Gonzalez, O. E. Schow and G. P. Summers: Phys. Rev. B 27 (1983) 1276-1282.、ZnO[5, 6][5]A. Janotti and C. G. van de Walle: Nat. Mat. 6 (2007) 44-47.
[6]M. -H. Du and K. Biswas: Phys. Rev. Lett. 106 (2011) 115502/1-4.などでヒドリドの存在が報告されてきたが、ヒドリド濃度はいずれも極めて少なく、欠損レベルといえるものであった。堂々と酸水素化物と言えるほどヒドリドを含有する化合物としては、還元されにくい典型元素のみを含むLaHO[7][7]B. Malaman and J. F. Brice: J. Solid State Chem. 53 (1984) 44-54.、Ba21Ge2O5H24[8][8]B. Huang and J. D. Corbett: Inorg. Chem. 37 (1998) 1892-1899.、12CaO∙7Al2O3[9][9]K. Hayashi, S. Matsuishi, T. Kamiya, M. Hirano and H. Hosono: Nature 419 (2002) 462-465.が報告されている。また、遷移金属を含んだものに関しては、LaSrCo3H0.7[10][10]M. A. Hayward, E. J. Cussen, J. B. Claridge, M. Bieringer, M. Rosseinsky et al.: Science 295 (2002) 1882-1884.、Sr3Co2O433H0.84[11][11]R. M. Helps, N. H. Rees and M. A. Hayward: Inorg. Chem. 49 (2010) 11062-11068.のみが報告されている。これらの化合物のコバルトの価数は、それぞれCo1.7+、Co1.75+であり、ヒドリドの高い還元力を反映してかなり低く、かなり特殊なケースといえる。
2.新しい酸水素化物:BaTiO2.4H0.6
我々は最近、誘電材料として古くから知られているBaTiO3を酸水素化物BaTiO3-xHxに変換することに成功した[12][12]Y. Kobayashi, O. J. Hernandez, T. Sakaguchi, T. Yajima, T. Roisnel et al.: Nat. Mat. 11 (2012) 507-511.。これまでに、BaTiO3に対し水素ガスによる高温還元を施した例は報告されているが、生成される酸素欠損の量は僅かであり、また、酸水素化物は生成されない。しかし、BaTiO3をCaH2と550〜580℃ほどで反応させることによって、大量の水素を含有する酸水素化物が得られた。組成にもよるが、酸水素化物は濃い青色を呈する(Fig. 1a)。Fig. 1に示すSPring-8で得られた粉末X線回折データ(BL02B2, BL15XU)によると、反応後の格子定数にはのびがみられ、室温での結晶系は正方晶から立方晶へと変化する。
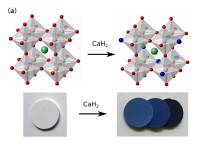
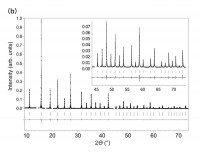
Fig. 1 (a)出発物質のBaTiO3と生成物質のBaTiO3-xHx。写真中のペレットの組成は左から順にそれぞれBaTiO2.9H0.1、BaTiO2.7H0.3、BaTiO2.5H0.5。(b)BaTiO2.4 H0.6の放射光X線回折パターン。
放射光データのリートベルト解析の結果、立方晶(理想的)ペロブスカイト構造にランダムな酸素欠損を導入したモデルで良いフィットが得られ、組成はBaTiO2.59(6)と決定できた(Pm3m,Rwp= 6.69%, Rp= 4.86%, χ2 = 1.07)。しかし、同じ試料に対し、中性子線回折データを同様のモデルで解析すると、収束は悪くないものの(Rwp= 2.06%, Rp= 0.59%, χ2 = 1.12%)BaTiO1.91(3)とX線とは大きな不一致が得られた。酸素量1.91は非現実的な低い値である。そこで、アニオンサイト欠損の代わりに水素原子が存在すると仮定し、水素と酸素がランダムに固溶したモデルで解析した。その結果、BaTiO2.33(2)H0.67(2)と、X線の解析に近い酸素組成が得られた。また、酸素流中でのTG(熱重量分析)からも、酸素量2.38が得られ、良い一致がみられた。磁化率データのキュリーワイス解析からはTi3.4+という価数が見積もられた。これもBaTiO2.4H0.6の組成と一致する。上述したコバルト系酸水素化物のコバルトの異常低原子価とは対照的に、本物質ではチタン化合物に典型的な価数をとる。
格子中の水素の状態を観察するために、BaTiO2.9 H0.1において1H MAS NMR実験を行ったところ、4.4 ppmに一本の鋭いピークのみが観測された。このことは水素の配位環境が単一であることを示している。プロトン伝導体(水酸化物イオン含有)[13, 14][13]H. Maekawa, N. Kashii, J. Kawamura, Y. Hinatsu and T. Yamamura: Solid State Ionics 122 (1999) 231-236.
[14]M. C. Verbraeken, H. A. L. Viana, P. Wormald and J. T. S. Irvine: J. Phys.: Cond. Matt. 23 (2011) 234111/1-7.と既知のヒドリド化合物[15][15]K. Hayashi: J. Solid State Chem. >strong>184 (2011) 1428-1432.における水素のケミカルシフトはともに4〜5 ppmであるため、NMRデータのみでは水素種をヒドリドと断言することはできない。しかし、単一の水素種が存在すること、合成の強い還元条件、中性子のフーリエマップに間隙位置水素(OH-基)が見られないことから、本物質でヒドリド以外の水素種が存在するとは考えにくい。
還元条件を温度、時間などで変化させることにより、アニオン組成(酸素/水素比)を制御することもできる。各種実験を行なった結果、アニオン欠損がない酸水素化物固溶系BaTiO3-xHxが得られたことが確認できた。ただし、BaTiO2.4H0.6が得られる条件よりも強い還元条件では、部分的にペロブスカイト構造が分解し、TiH2の生成が顕著になる。 BaTiO3-xHxは空気中で200℃まで安定であり、水に対しても少なくとも120℃までは安定である。不活性雰囲気下では、450℃前後まで安定であり、より高温では水素ガスを放出する。沸騰水、アルカリ溶液に対しても安定であるが、酸溶液中(0.1 M HCl)では水素ガスを発生させながら分解する。現在までに、CaH2、NaHなどの金属水素化物を使ったトポケミカル還元反応により、SrFeO2、LaNiO2など様々な新しい酸化物が報告されているが、酸水素化物が得られるのは前述のCo系と今回のTi系のみである。
3.ヒドリド交換
興味深いことに、BaTiO3-xHx格子中のヒドリドは、外界の水素ガスと容易に交換する。Fig. 2に示すように、BaTiO3-xHxを重水素(D2)ガス中、400℃まで加熱すると、HDガスの放出が検出された。H種は酸水素化物に由来し、D種は気相からしか供給されないので、このようなスクランブルされた生成物は、気相中の水素と酸水素化物の水素が400〜500℃で交換するために発生する。もし、このような交換が起こっていれば、時間とともにBaTiO3-xHyDzという組成に変化するはずである。実際に、重水素処理後の試料を酸で分解し、生成されたガスを質量分析すると、H/D交換率が90%であることがわかった。また、中性子線回折でも、H/D交換が高効率で起こっていることが確認できた。中性子回折はバルクの構造をみるため、H/D交換は粒子の表面のみによるものではなく、粒子内部まで進行している。
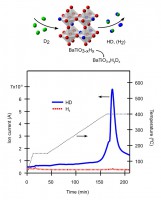
Fig. 2 BaTiO2.4H0.6を、流通下D2/Ar 下で加熱しながら、生成されたガスを四重極質量分析計でモニターした結果。
上記の交換反応は比較的短時間で可能なことから、ヒドリドの結晶内拡散が速いことが期待できる。LaSrCoH0.7☐0.3でも、準弾性中性子散乱より450℃で高い拡散定数が報告されているが[16][16]C. A. Bridges, F. Fernandez-Alonso, J. P. Goff and M. J. Rosseinsky: Adv. Mat. 18 (2006) 3304-3308.、この系では大量に存在するアニオン欠損が拡散に重要であると指摘されている。一方、BaTiO3-xHxはアニオン欠損量が極めて低いのにも関わらず、なおヒドリド拡散が速いことは興味深い。通常のアニオン拡散(ホッピング機構)を考えた場合、格子中のO2-が大きな質量と高い電荷の為に、H-拡散の妨げになることが予想される。しかし、H-の濃度が高ければ、H-(および少量の欠損)だけで伝導パスがつながるため、効率的な拡散が達成できるはずである。もう1つの非自明のヒドリド拡散のシナリオは、水素のみで可能な機構である。すなわち、水素種が拡散するときに、単にアニオン(H-)としてではなく、電子とプロトンに分かれて、それぞれが酸化物格子中を拡散した後、違うサイトで再結合してアニオンに戻る機構である(Fig. 3)。このプロセスに関連した理論は最近第一原理計算によって提唱されている[17][17]Y. Iwazaki, T. Suzuki and S. Tsuneyuki: J. of App. Phys. 108 (2010) 83705.。この拡散機構では、酸化物イオンの移動を必要としないため、安定な酸化物の中で、水素のみを伝導に使うことになる。
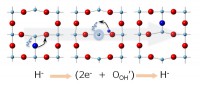
Fig. 3 理論によって提唱された新しいヒドリド拡散機構。ヒドリドが電子と、OH-基に取り込まれたプロトンに別れて拡散しており、重い酸素自身は動かない。
4.今後の展開
ここまでに示したチタン系酸水素化物試料はすべて粉末であったが、より精密な物性測定には単結晶試料やエピタキシャル薄膜が重要である。我々は既に、BaTiO3-xHx、SrTiO3-xHx、CaTiO3-xHxのエピタキシャル薄膜の調製に成功し、高い電子伝導率、および、重水素置換を確認している[18][18]T. Yajima, A. Kitada, Y. Kobayashi, T. Sakaguchi, G. Bouilly et al.: J. Am. Chem. Soc. 134 (2012) 8782-8785.。ペロブスカイト構造のAサイトによらず酸水素化物が形成されることは、Ti系の酸水素化物が本稿で示した物質に限らず、もっと広い物質系として存在することを示唆している。これは、今後の合成によって明らかになるであろう。
セラミックスにおける酸化物イオンをF-、S2-、N3-などの他のアニオンへの置換することで物性をコントロールすることが可能である。例えば、フッ素の導入は超伝導体への有効なキャリアドープの方法であり[19][19]M. Ai-Mamouri, P. P. Edwards, C. Greaves and M. Slaski: Nature 369 (1994) 382-384.、酸化物の窒素化処理は良い光触媒材料をもたらしてきた[20][20]M. Jansen and H. P. Letschert: Nature 404 (2000) 980-982.。アニオン置換法の中で、最も困難であった H-による置換が可能になったことで、 固体化学はさらに発展し、電子物性、イオニクス、触媒、など固体化学の様々な分野で応用が展開されるだろう。
5.謝辞
本研究は、フランス・レンヌ第一大学のOlivier Hernandez、京都大学の辻本吉廣博士(現NIMS)、坂口辰徳、矢島健博士、森田昌樹、野田泰斗博士、最上祐貴、北田敦助教、大倉仁寿、細川三郎助教、李兆飛博士(現中国石油)、吉村一良教授、竹腰清乃理教授、井上正志教授、高野幹夫教授、東京工業大学の林克郎教授、倉敷芸術科学大学の草野圭弘准教授、JASRIの金延恩博士、辻成希博士、藤原明比古博士、物材機構の松下能孝博士と共同で行われた。本研究は、主として2011A1061、2012A1114のビームタイムで得られた結果をもとにしている。また、世界最先端研究(FIRST)プログラム「新超電導および関連機能物質の探索と産業用超電導線材の応用」(中心研究者 細野秀雄)より補助を受けた。
参考文献
[1]S. Steinsvkik, Y. Larring and T. Norby: Solid State Ionics 143 (2001) 103-116.
[2]F. W. Poulsen: Solid State Ionics 145 (2001) 387-397.
[3]T. Norby, M. Widerøe, R. Glöckner and Y. Larring: Dalton Trans. (2004) 3012-3018.
[4]Y. Chen, R. Gonzalez, O. E. Schow and G. P. Summers: Phys. Rev. B 27 (1983) 1276-1282.
[5]A. Janotti and C. G. van de Walle: Nat. Mat. 6 (2007) 44-47.
[6]M. -H. Du and K. Biswas: Phys. Rev. Lett. 106 (2011) 115502/1-4.
[7]B. Malaman and J. F. Brice: J. Solid State Chem. 53 (1984) 44-54.
[8]B. Huang and J. D. Corbett: Inorg. Chem. 37 (1998) 1892-1899.
[9]K. Hayashi, S. Matsuishi, T. Kamiya, M. Hirano and H. Hosono: Nature 419 (2002) 462-465.
[10]M. A. Hayward, E. J. Cussen, J. B. Claridge, M. Bieringer, M. Rosseinsky et al.: Science 295 (2002) 1882-1884.
[11]R. M. Helps, N. H. Rees and M. A. Hayward: Inorg. Chem. 49 (2010) 11062-11068.
[12]Y. Kobayashi, O. J. Hernandez, T. Sakaguchi, T. Yajima, T. Roisnel et al.: Nat. Mat. 11 (2012) 507-511.
[13]H. Maekawa, N. Kashii, J. Kawamura, Y. Hinatsu and T. Yamamura: Solid State Ionics 122 (1999) 231-236.
[14]M. C. Verbraeken, H. A. L. Viana, P. Wormald and J. T. S. Irvine: J. Phys.: Cond. Matt. 23 (2011) 234111/1-7.
[15]K. Hayashi: J. Solid State Chem. 184 (2011) 1428-1432.
[16]C. A. Bridges, F. Fernandez-Alonso, J. P. Goff and M. J. Rosseinsky: Adv. Mat. 18 (2006) 3304-3308.
[17]Y. Iwazaki, T. Suzuki and S. Tsuneyuki: J. of App. Phys. 108 (2010) 83705.
[18]T. Yajima, A. Kitada, Y. Kobayashi, T. Sakaguchi, G. Bouilly et al.: J. Am. Chem. Soc. 134 (2012) 8782-8785.
[19]M. Ai-Mamouri, P. P. Edwards, C. Greaves and M. Slaski: Nature 369 (1994) 382-384.
[20]M. Jansen and H. P. Letschert: Nature 404 (2000) 980-982.
京都大学大学院 工学研究科 物質エネルギー化学専攻
〒615-8510 京都府京都市西京区京大桂
TEL:075-383-2509
e-mail:yojik@scl.kyoto-u.ac.jp
京都大学大学院 工学研究科 物質エネルギー化学専攻
〒615-8510 京都府京都市西京区京大桂
TEL:075-383-2506
e-mail:kage@scl.kyoto-u.ac.jp








