Volume 17, No.1 Pages 17 - 20
1. 最近の研究から/FROM LATEST RESEARCH
海藻カサノリ由来ロドプシンARIIの結晶構造
Crystal Structure of the Marine Alga Acetabularia Rhodopsin Ⅱ
(独)理化学研究所 生命分子システム基盤研究領域 Systems and Structural Biology Center, RIKEN
- Abstract
-
膜タンパク質の1つで、真核単細胞生物の光駆動型プロトンポンプであるロドプシン「ARII」は、海藻のカサノリ由来のタンパク質で、生きた細胞を用いる一般的な発現方法では大量合成が非常に難しい。我々は、無細胞タンパク質合成技術※1を用いることで、ARIIの機能を保持したまま大量合成することに初めて成功し、ARIIの機能を詳細に解析することができた。また、人工脂質二重膜中での膜タンパク質の結晶化が可能な脂質メソフェーズ法※2をARIIに適用し、結晶化に成功した。そして、SPring-8のBL41XUでX線回折実験を行い、3.2 Å分解能で立体構造を決定した。これは、真核単細胞生物由来のロドプシンとして初めての構造解析例となる。
今回用いた無細胞タンパク質合成技術による膜タンパク質の合成方法は、医薬品開発など産業上有用な膜タンパク質の機能や構造の解析などに幅広く適用されることが期待される。
※1無細胞タンパク質合成技術:生命体に依存しない人工的なシステムで、細胞からタンパク質合成に必要な成分一式を
抽出し、これに目的のタンパク質をコードする遺伝子を合成装置が読み取れる形にして添加して、タンパク質を合成
する技術。外部からさまざまな因子を加えることが容易であり、反応条件の変更や最適化も容易であるなど、多くの
優れた特徴を持つ。
※2脂質メソフェーズ法:人工脂質二重膜中で膜タンパク質の結晶化を行う新しい技術。生体外で不安定な膜タンパク質
の結晶化に適している。
1.はじめに
膜タンパク質は、エネルギー生産、物質輸送、情報伝達など生命の維持に重要な役割を担うだけでなく、多くの病気に関与していることから、その構造と機能の解明により、医薬品を合理的に設計することが可能になると期待されている。タンパク質の構造と機能の解析のためには大量の試料が必要とされるが、組換え動物細胞などを用いた従来の膜タンパク質の合成方法では、その合成量が少ないうえに、合成の途中で変性しやすいなどの問題があり、大量合成が困難だった。
そこで本研究グループは、文部科学省大規模研究開発事業「ターゲットタンパク研究プログラム」で理化学研究所(理研)が開発を進めている無細胞タンパク質合成技術や脂質メソフェーズ法を用いた結晶化技術を駆使し、膜タンパク質の合成と結晶化およびその構造と機能の解析に挑んだ。
2.ロドプシンタンパク質
生命現象と光には深い関わりがあり、そこで重要な役割を果たしている物質のひとつがロドプシンである。ロドプシンはレチナール分子を含む膜タンパク質である。多くの薬剤標的となっている膜タンパク質であるGタンパク質共役受容体(GPCR)と同じ7回膜貫通構造を持ち、そのタンパク質部分(オプシン)の第7ヘリックスにあるリジン残基とレチナール分子がシッフ塩基結合してオプシンに内包されると赤〜紫色を呈する。
動物の網膜に存在するロドプシンは、光を受けるとレチナール分子の立体構造変化(11-cisからall-transへの立体異性化)が起こり、Gタンパク質と相互作用してシグナル伝達を行う。また、微生物においても様々なロドプシンが発見されているが、この中で最もよく研究されているのが好塩菌Halobacterium由来のバクテリオロドプシン(BR)である。BRが光を受けるとレチナール分子を異性化する光サイクルが始まり、1サイクルあたり1分子のプロトンが細胞質側から細胞外側に輸送される。微生物においては、BRのようなプロトンポンプのほか、塩化物イオンを細胞質側へポンプするハロロドプシン(HR)、生体が光に反応して光源方向に移動する性質(走光性)に関する情報伝達を行うセンサリーロドプシンなどが知られている。なお視物質型ロドプシンと微生物型ロドプシンではアミノ酸配列の類縁性が小さく、進化的に別の道筋をたどって今日の構造に収斂したものと考えられる。
近年、藻類の遺伝子解析から、これまでに知られていなかったオプシンが次々に発見された。2003年、緑藻クラミドモナスChlamydomonasからチャネルロドプシンChR2が同定された。ChR2に光が照射されるとゲートが開き、ナトリウムなどの陽イオンが濃度勾配に従って輸送される。組換え技術でChR2を発現した神経細胞(ニューロン)に光を照射すると脱分極し、神経興奮が引き起こされた。同様にHRを発現したニューロンに光照射すると過分極が起きた。この研究分野は、オプトジェネティクス(光遺伝学)と呼ばれ、進展が目覚ましい。また2006年には、海藻カサノリAcetabularia acetabulumから新規のオプシン(AR)の遺伝子が同定され、アフリカツメガエル卵母細胞内で発現させたARに、細胞内のプロトンを積極的に汲み出す活性が認められ、光駆動型プロトンポンプであることが確認された。ARの生理的な役割は今でもよくわかっていないが、カサノリの配偶子がもつ走光性と関係しているかもしれない。
3.ARIIタンパク質の合成
今回、我々はカサノリから新たな微生物型オプシン(ARII)の遺伝子を同定した[1][1]T. Wada, K. Shimono, T. Kikukawa, M. Hato, N. Shinya, S. Y. Kim, T. Kimura-Someya, M. Shirouzu, J. Tamogami, S. Miyauchi, K. H. Jung, N. Kamo and S. Yokoyama: J. Mol. Biol. 411 (2011) 986-998.。そして、ARII遺伝子を導入した組換えアフリカツメガエル卵母細胞に光を照射すると電流が発生することがわかった。さらに機能解析を進めるためには、ARIIタンパク質を純度高く大量に取得する必要がある。しかし、多くの研究者がARIIを得ようと、大腸菌に遺伝子を導入してタンパク質を生産させるといった生きた細胞を用いる一般的な方法を試みていたが、発現量が非常に低く成功例が無かった。大腸菌では、膜タンパク質の多くが細胞質膜に挿入されるため、生きている細胞で大量発現させると致死的になる現象が散見される。これは膜構造が破壊されるためと推測されている。死に至らない場合でも、生き延びるために構造遺伝子やプロモーターに変異が入ることが多く、その場合は目的タンパク質の発現量が極端に少なくなる。一方、無細胞タンパク質合成技術は転写と翻訳のみを基本とした試験管内反応であるため、そのようなリスクを回避できる。そこで今回、理研で開発した膜タンパク質の無細胞タンパク質合成技術[2][2]K. Shimono, M. Goto, T. Kikukawa, S. Miyauchi, M. Shirouzu, N. Kamo and S. Yokoyama: Protein Sci. 18 (2009) 2160-2171.を応用した。具体的には、大腸菌由来のタンパク質合成反応液に脂質と界面活性剤を加え、ARII遺伝子を組み込んだプラスミドDNAを添加して、天然の細胞膜に見立てた人工の脂質二重膜(リポソーム)中でARIIを合成した。脂質二重膜は、試験管内で実際の細胞膜と同様な構造を持っているため、活性体と呼ばれる正しい形と機能を保持した状態で膜タンパク質を得ることが可能である。ここに、ロドプシンに必須のall-trans型のレチナール溶液を添加して反応させたところ、反応開始前には反応液がオレンジジュースのような黄色を呈していたが、30℃で3時間保温したところ、トマトジュースのような赤色に変わり、ロドプシンの合成が進んでいることが一目瞭然であった。合成されたARIIは合成と同時に形成されたリポソーム内に移行し、反応終了後に遠心分離によって沈殿として回収することができた。この膜画分では、27 ml合成反応液あたり4.5 mgの収量で、ARII分子が脂質画分の約50%以上を占めるという大量発現が確認された。この沈殿に界面活性剤を含むバッファー溶液を添加するとARIIが可溶化し、続いてNiアフィニティカラムとゲルろ過カラムによる精製を行った。最後に限外ろ過により濃縮し45 mg/mlとした。
無細胞タンパク質合成技術によって大量合成・精製されたARIIは、複数の生化学的および物理化学的実験の結果からプロトンポンプ活性が確認された[1][1]T. Wada, K. Shimono, T. Kikukawa, M. Hato, N. Shinya, S. Y. Kim, T. Kimura-Someya, M. Shirouzu, J. Tamogami, S. Miyauchi, K. H. Jung, N. Kamo and S. Yokoyama: J. Mol. Biol. 411 (2011) 986-998.。
4.ARIIの結晶構造解析
脂質メソフェーズ法による結晶化では、ARII溶液、コレステロールを含んだ脂質モノオレインをシリンジに測り取り、ふたつのシリンジの先端同士を連結してプランジャの押し引きを繰り返して混合した。つぎにガラスプレート上に穴の空いた両面粘着シートを張り付け、プレート上の穴の中に混合試料をごく少量押し出し、その上に結晶化溶液(0.1 M Tris–HCl(pH 7.5)、6% 2-methyl-2,4-pentanediol、14% polyethylene glycol 400)を滴下した。この上から別のガラスプレートを被せてサンドウィッチ状にして密閉した。このプレートを1〜2週間、20℃で保温すると一辺の長さが0.1 μm程度、厚さが10 μmの薄い板状の赤紫色の結晶が成長した(図1)。
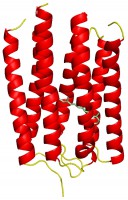
5.ARIIの立体構造
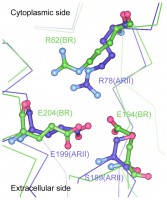
ARII結晶の空間群はP212121で、非対称単位中でテトラマー構造を取り、ARII 1分子あたり2分子のコレステロールが確認された。モノマー構造(図2)はBRなど微生物型ロドプシンの構造とよく類似し、7番目のヘリックス中のLys211がall-trans型レチナールとシッフ塩基結合していた。通常、αヘリックスでは主鎖のカルボニル基は4残基先のアミド基と水素結合するが、Lys211の前後周辺のアミノ酸残基は5残基分ずれた相手と水素結合し、結果Ala210のカルボニル基は水素結合の相手を失ってヘリックスが折れ、πバルジと呼ばれる構造を取っていた。この折れ曲がりはBRにも見られ特徴的である。
6.おわりに
今回用いた無細胞タンパク質合成技術や、脂質メソフェーズ法によって、水溶性タンパク質と比べて立体構造解析が遅れている膜タンパク質の基礎研究が大きく発展すると予想される。膜タンパク質の多くは創薬ターゲットであり、医薬品の50%以上が膜タンパク質に作用するともいわれている。膜タンパク質の詳細な立体構造解析の結果から、そこに作用する医薬品の設計が可能となるとともに、無細胞タンパク質合成技術の応用によって、膜タンパク質に対する抗体の取得が可能となることから、これらの技術は、医薬品の研究開発に大きく貢献することが期待される。
7.謝辞
本研究は、BL41XU 2011B1005(成果公開優先利用課題)、文部科学省大規模研究開発事業「ターゲットタンパク研究プログラム」の一環として行われました。BL41XUでの測定にあたりましてご協力いただきました山本雅貴先生、河野能顕先生に厚くお礼申し上げます。また、本稿の執筆にあたりましては、共著者である下野和実先生、田母神淳先生、加茂直樹先生(松山大学)、宮内正二先生(東邦大学)、菊川峰志先生(北海道大学)、So Young Kim先生、Kwang-Hwan Jung先生(西江大学校)、新屋直子先生、羽藤正勝先生(理化学研究所 生命分子システム基盤研究領域)に厚くお礼申し上げます。
参考文献
[1]T. Wada, K. Shimono, T. Kikukawa, M. Hato, N. Shinya, S. Y. Kim, T. Kimura-Someya, M. Shirouzu, J. Tamogami, S. Miyauchi, K. H. Jung, N. Kamo and S. Yokoyama: J. Mol. Biol. 411 (2011) 986-998.
[2]K. Shimono, M. Goto, T. Kikukawa, S. Miyauchi, M. Shirouzu, N. Kamo and S. Yokoyama: Protein Sci. 18 (2009) 2160-2171.
和田 崇 WADA Takashi
(独)理化学研究所 生命分子システム基盤研究領域
〒234-0045 神奈川県横浜市鶴見区末広町1-7-22
TEL:045-503-9196
染谷 友美 KIMURA-SOMEYA Tomomi
(独)理化学研究所 生命分子システム基盤研究領域
〒234-0045 神奈川県横浜市鶴見区末広町1-7-22
TEL:045-503-9196
白水 美香子 SHIROUZU Mikako
(独)理化学研究所 生命分子システム基盤研究領域
〒234-0045 神奈川県横浜市鶴見区末広町1-7-22
TEL:045-503-9196
横山 茂之 YOKOYAMA Shigeyuki
(独)理化学研究所 生命分子システム基盤研究領域
〒234-0045 神奈川県横浜市鶴見区末広町1-7-22
TEL:045-503-9196
e-mail:yokoyama@riken.jp