Volume 17, No.1 Pages 3 - 8
1. 最近の研究から/FROM LATEST RESEARCH
フロリゲン(花成ホルモン)の細胞内受容体の発見
Discovery of Intracellular Receptors for Rice Hd3a Florigen
[1]奈良先端科学技術大学院大学 バイオサイエンス研究科 Graduate School of Biological Sciences, Nara Institute of Science and Technology、[2]大阪大学 蛋白質研究所 Institute for Protein Research, Osaka University
- Abstract
- 「フロリゲン」は花芽形成を誘導する植物ホルモンとして70年以上前に提唱されていたが、最近になってようやく、その分子実体が高等植物で広く保存されている遺伝子FLOWERING LOCUS T(FT)にコードされている蛋白質であることが明らかになった。本研究において我々は、SPring-8 BL41XUおよびBL44XUを用いた放射光実験により、FT相同蛋白質であるイネのフロリゲンHd3a、茎頂細胞の14-3-3蛋白質、転写因子の3者からなるフロリゲン活性化複合体の結晶構造を2.4 Å分解能で決定することに成功した。さらにイネ培養細胞および形質転換イネを用いた実験から、茎頂細胞の14-3-3蛋白質が細胞内でフロリゲン受容体として働くことや、フロリゲン活性化複合体がイネの花芽形成遺伝子の転写を活性化し、花成を誘導することを明らかにした[1](図1)。
はじめに
多くの植物は1年の決まった時期に花を咲かせ子孫を残す。この開花制御には日長が重要な役割を果たしている。1937年にロシアの研究者Chailakhyanは、日長の変化に応答して葉で作られた物質が茎頂に運ばれて花芽形成を誘導すると考え、そのような物質を花成ホルモン「フロリゲン」と名付けた。以後70年以上の間、フロリゲンの存在を支持する多くの実験結果が報告されたが、フロリゲンの実体は謎のままであった。しかし、近年になってシロイヌナズナFT蛋白質とその相同因子であるイネHd3a蛋白質がフロリゲンの分子実体であることが明らかにされた[2, 3][2]Corbesier, L., Vincent, C., Jang, S. et al.: FT protein movement contributes to long-distance signaling in floral induction of Arabidopsis. Science, 316 (2007) 1030-1033.
[3]Tamaki, S., Matsuo, S., Wong, H. L. et al.: Hd3a protein is a mobile flowering signal in rice. Science, 316 (2007) 1033-1036.。FT蛋白質と相互作用する因子として、シロイヌナズナFDが報告されている[4, 5][4]Abe, M., Kobayashi, Y., Yamamoto, S. et al.: FD, a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex. Science, 309 (2005) 1052-1056.
[5]Wigge, P. A., Kim, M. C., Jaeger, K. E. et al.: Integration of spatial and temporal information during floral induction in Arabidopsis. Science, 309 (2005) 1056-1059.。FDはbZip型の転写因子であり、FTとFDの両者の過剰発現によりfloral meristem identitty geneの1つであるAP1遺伝子の発現が誘導される。しかし、フロリゲンがどのようなメカニズムで下流の標的遺伝子の発現を活性化しているのかは不明であった。その活性化機構を明らかにするために、我々は未知の蛋白質-蛋白質間相互作用を簡便に検出、同定できる酵母ツーハイブリッド法(Y2H)を用いてスクリーニングを行い、複数のHd3a相互作用因子を同定し、それらの詳細な相互作用解析を行った。
1.Hd3a-14-3-3-OsFD1の3者の蛋白質間の相互作用
フロリゲンによる花成誘導の分子機構を理解するために、イネcDNAライブラリーを用いた酵母ツーハイブリッド法(Y2H)によるHd3a相互作用因子の探索を行った。その結果、GF14c(イネ14-3-3)、OsKANADI1(シロイヌナズナKANADIのイネホモログ)、OsBIP116b(シロイヌナズナWAVE DAMPENED2のイネホモログ)が得られた。また、データベースサーチから得られたOsFD1(シロイヌナズナFDのイネホモログ)もY2H法においてHd3aと相互作用した。GF14cを除く残り3つの相互作用因子のC末端には共通してSAPモチーフ(Ser-Ala-Pro)が見いだされた。この配列は、既に報告されていたFDにおけるFTとの相互作用モチーフ(Thr-Ala-Pro)と類似していた[4][4]Abe, M., Kobayashi, Y., Yamamoto, S. et al.: FD, a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex. Science, 309 (2005) 1052-1056.。いずれのHd3a相互作用因子においても、SAPモチーフのアラニン置換によってY2H法においてHd3aとの相互作用が失われた。一方、in vitroでの相互作用実験では、Hd3aとGF14cの間の相互作用は検出されたが、Hd3aとOsFD1の相互作用は検出できなかった。これらの実験結果と、SAPモチーフと14-3-3認識配列の類似性、さらにGF14cにSAPモチーフがないことから次のような仮説を立てた。すなわち、Hd3aとその相互作用因子は14-3-3を介して間接的に相互作用していると考えた。Y2H法において観察されたHd3aとその相互作用因子の間の結合は、Y2H法で用いる酵母の内在性の14-3-3を介した間接的なものであると説明できる。そこで、OsFD1とGF14cとの相互作用を調べたところ、両者はin vitroで相互作用した。さらに変異解析により、SAPモチーフ内のセリンのリン酸化が両者の相互作用に重要であることが示唆された。Hd3aと14-3-3の植物細胞内での相互作用は、イネ茎頂細胞の抽出液を用いた共免疫沈澱解析から確かめられた。共免疫沈殿解析では、可溶性の抗原と抗体が特異的に反応して不溶化し沈殿する免疫沈降反応を利用しており、目的蛋白質と相互作用する蛋白質との複合体を回収することで、生体内での蛋白質間相互作用を解析できる。
2.フロリゲン活性化複合体(FAC)の結晶構造
Hd3a、GF14およびOsFD1の相互作用の詳細を調べるため、SPring-8 BL41XUおよびBL44XUを用いた放射光実験(課題番号:2011A1890、2010B1595、2010B6509、2010A1125、2010A6509)により、これら3者からなる蛋白質複合体の立体構造解析を行い、結晶構造を2.4 Å分解能で決定することに成功した(PDB ID: 3AXY)。結晶化にあたっては、OsFD1はY2Hより判明していたGF14との結合に必要十分なリン酸化されたSer192を含むC末端の9アミノ酸断片を用いた。得られた複合体構造ではHd3a、GF14、OsFD1それぞれ2分子ずつからなるW字型のヘテロ6量体を形成しており、ダイマーを形成したGF14のW字の底にあるくぼみにリン酸化されたOsFD1がはまり込み、その上側にHd3aが1分子ずつ左右対称に離れて結合していた(図2)。
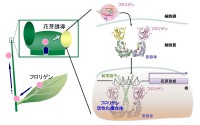
図1 フロリゲンの花成誘導機構
イネのフロリゲンは葉の維管束篩部伴細胞において花成誘導条件(短日条件)特異的に発現した後、おそらく篩管を経由して茎頂まで長距離輸送される。茎頂分裂組織の細胞内に到達したフロリゲンは細胞質で受容体と結合した後、転写因子依存的に核移行してフロリゲン-受容体-転写因子の3者からなるフロリゲン転写活性化複合体を形成する。この複合体は花芽形成遺伝子の転写を活性化し、花芽形成がスタートする。
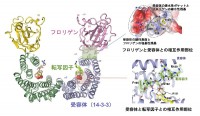
図2 フロリゲン転写活性化複合体の結晶構造
フロリゲン転写活性化複合体はフロリゲン-受容体-転写因子の3者からなり、受容体が2量体を形成することでヘテロ6量体として存在する。フロリゲンと受容体との相互作用領域は、受容体の酸性表面とフロリゲンの塩基性アミノ酸からなる静電的相互作用部位と、受容体の疎水性ポケットとフロリゲンの疎水性アミノ酸からなる疎水性部位で構成されている。受容体と転写因子との相互作用は典型的な14-3-3蛋白質とリン酸化ペプチドとの相互作用様式に類似している。
Hd3aとOsFD1の間に直接的な相互作用はみられず、Hd3aとOsFD1はGF14に対して独立に結合するというY2H実験の結果と一致していた(図3)。GST融合蛋白質を用いて相互作用する蛋白質を解析するGSTプルダウンアッセイにおいて、GF14が存在する場合のみHd3aとOsFD1は結合が見られることから、GF14はフロリゲンであるHd3aと転写因子OsFD1を結びつける役割を果たし、これら3者からなる複合体がフロリゲンシグナル伝達の本体であると考えられた。そこで、我々はこの3者複合体をフロリゲン転写活性化複合体(Florigen Activation Complex; FAC)と名付けた。
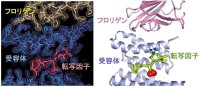
図3 フロリゲンと転写因子との相互作用
フロリゲン転写活性化複合体の電子密度マップとそのリボン図を示す。フロリゲン転写活性化複合体の結晶構造ではフロリゲンと転写因子との接触は見られない。これらは生化学的な相互作用解析やNMRやITCなどの物理化学実験の結果と一致している。
14-3-3蛋白質はリン酸化されたアミノ酸を認識するドメインとして知られているが[6][6]Yaffe, M. B., Rittinger, K., Volinia, S., et al.: The structural basis for 14-3-3: phosphopeptide binding specificity. Cell 91 (1997) 961-971.、GF14とHd3aの相互作用はリン酸化非依存的であり、それらとはかなり異なる結合様式を見せていた。GF14とHd3aの相互作用は、Hd3aのループ領域に存在する2つの突き出た塩基性アミノ酸残基(Arg64、Arg132)がGF14上部にある酸性のくぼみに錨のようにはまり込み、さらにHd3a本体はGF14のC末端へリックスの間にある疎水性の溝と広く相互作用していた(図2右上)。一方、リン酸化されたOsFD1とGF14の相互作用は、これまで多く報告されている14-3-3蛋白質とリン酸化ペプチドの結合様式に類似していた[6][6]Yaffe, M. B., Rittinger, K., Volinia, S., et al.: The structural basis for 14-3-3: phosphopeptide binding specificity. Cell 91 (1997) 961-971.。OsFD1のリン酸化されたSer192がGF14の塩基性のリン酸化ペプチド結合ポケットにはまり込み、さらにSAPモチーフ全体も認識されていた(図2右下)。
立体構造解析では一般に相互作用しているアミノ酸がもれなく全て分かるため、点変異等による解析と比較して、種間での相互作用の保存性が正確に見積もれる事が大きな利点の1つである。そこで、イネのFACで観察された相互作用に関わるアミノ酸の保存性を他の植物種間で比較して調べたところHd3a-GF14、GF14-OsFD1共に高等植物で高度に保存されており、これらの相互作用がイネ同様存在する可能性が示唆された。また、シロイヌナズナやトマトにおいて、フロリゲンと14-3-3蛋白質が実際に相互作用することが報告されている[7, 8][7]Pnueli, L., Gutfingera, T., Hareven, D., et al.: Tomato SP-interacting proteins define a conserved signaling system that regulates shoot architecture and flowering. Plant Cell 13 (2001) 2687-2702.
[8]Lifschitz, E., Eviatear, T., Rozman, A., et al.: The tomato FT ortholog triggers systemic signals that regulate growth and flowering and substitute for diverse environmental stimuli. Proc. Natl. Acad. Sci. USA 103 (2006) 6398-6403.。
これらの事により、フロリゲン-14-3-3-転写因子の相互作用は、植物全般に共通して存在する花成誘導経路であると考えられる。
3.プロモーターDNA上でのFAC
bZip型転写因子としてのOsFD1を含むFACは、実際の細胞内では花芽形成遺伝子OsMADS15(シロイヌナズナAP1ホモログ)のプロモーター領域に結合して、転写活性化を行っていると考えられる[9][9]Komiya, R., Ikegami, A., Tamaki, S., et al.: Hd3a and RFT1 are essential for flowering in rice. Development 135 (2008) 767-774.。しかし、得られた結晶構造はDNAを含んでいないため、このFACが実際にプロモーターDNA上で形成出来るかどうかは不明であった。それを調べるため、シロイヌナズナAP1プロモーター上のC-box DNA(GACGTC)を用いてFACとDNAの結合をゲルシフトアッセイを行って調べた。ゲルシフトアッセイでは、DNAに蛋白質が結合するとDNAのみの場合と電気泳動での移動度が異なることを利用しており、DNAと蛋白質との結合が明確に解析できる。その結果、DNAに対してOsFD1、GF14、Hd3aを順に加えていくとDNAの段階的なスーパーシフトが見られ、実際にプロモーターDNA上で安定なFACが形成される事が判明した。
このFAC-DNA複合体中でのHd3aの位置づけを確認するため、FAC-DNA複合体のモデル構造を報告されている動物のbZip-DNA複合体構造を基に作成した(図1右下)。モデルでは、Hd3aはGF14とOsFD1をDNAに安定に保持するように位置し、この配置がHd3aの転写活性化や花成誘導能に関係しているものと予想された。
4.Florigen Activation Complexの形成メカニズム
次にFACが細胞内で構築されるメカニズムを調査し、この複合体がダイナミックな細胞内局在変化を伴って形成されることが明らかとなった。はじめに3蛋白質の細胞内局在を観察したところ、Hd3aは核と細胞質に、GF14bはほとんどが細胞質に、OsFD1は核にのみ局在しており、複合体を形成するはずの3者の局在がそれぞれ異なっていることが分かった。そこで次にHd3a-GF14b複合体の形成を2分子蛍光相補(BiFC)法によって検討した。BiFC法では蛍光蛋白質を2つの断片に分けて相互作用の有無を検討する2種の蛋白質にそれぞれ導入し、2種の蛋白質が相互作用したときだけ蛍光が検出されるため、生きている細胞内での分子間相互作用の検出が可能である。Hd3a-GF14b複合体はGF14bの存在する細胞質で形成されることが分かったが、OsFD1の核局在とオーバーラップしていないため、複合体を結びつけるメカニズムが存在すると考えられる。そこで私たちはHd3a-GF14b複合体の存在化でさらにCFP-OsFD1を共発現させる実験を行った。ここでCFP-OsFD1は青色蛍光蛋白質であるCFPとOsFD1との融合蛋白質である。その結果Hd3a-GF14b複合体が細胞質から核へ局在を変え、3者が核に集まることが観察された。このことから、Hd3aははじめに細胞質でHd3a-GF14b複合体を形成した後、核移行してOsFD1と相互作用していると考えられる(図1)。
私たちはHd3a-GF14b-OsFD1複合体の形成をさらに検証するために、BiFC法とFRET/FLIM法(蛍光エネルギー共鳴移動/蛍光寿命イメージング測定法)を組み合わせたバイオイメージング実験を行った。この実験では、青色蛍光蛋白質CFPと黄色蛍光蛋白質Venusが近接すると蛍光エネルギー共鳴移動(FRET)が生じ、CFPの蛍光寿命が短縮する現象を利用してイメージング測定(FLIM)を行う。すなわちHd3a-GF14b複合体をBiFC法によって再構成したVenusで可視化し、さらにCFP-OsFD1を共発現させると、3者が相互作用していればCFP-Venus間が近接してCFPの蛍光寿命が短縮することが期待される。実際に蛍光寿命の測定実験を行ったところ、Hd3a-GF14b(BiFC)とCFP-OsFD1が共存した時だけCFPの蛍光寿命の短縮(FLIM)が観察された。このことから、細胞内においてもHd3a-GF14b-OsFD1複合体が実際に形成されていることが強く示唆された。
5.Hd3aによる花芽形成促進には14-3-3との相互作用が必要である。
さらに、多数の形質転換イネを用いた実験から、FACの形成が花芽形成に必要であることが明らかになった。Hd3aは葉の維管束で発現することから、維管束特異的に強い活性を持つrolCプロモーターによってHd3aを発現させたところ、形質転換イネの出穂は顕著に促進される。この時Hd3aに14-3-3との相互作用を失わせる変異を導入すると、試した4種類の変異すべてにおいて花成の促進機能が失われることが分かった(図4)。すなわちHd3aが開花促進能力を発揮するためには14-3-3との相互作用が必須であると言える。これら相互作用を失わせる変異体のデザインにはNMRによる相互作用解析が有効であった(図4右)。

図4 形質転換イネによる機能解析
フロリゲンを過剰発現させることで開花が促進される。受容体と相互作用できないフロリゲン変異体を過剰発現させたところ、開花がほとんど促進されない。開花を促進するためには受容体との結合が必須であると考えられる。受容体とフロリゲンとの相互作用部位は複合体の結晶構造に加えてNMRでも解析した。受容体と相互作用できないフロリゲン変異体のデザインにはNMRによる相互作用解析が有効であった。
おわりに
本研究から、14-3-3蛋白質はフロリゲンHd3aの細胞内受容体として機能すると考えることができる。フロリゲンHd3aは葉で合成された後、茎頂まで長距離移動する。Hd3aは、茎頂の細胞に到達した後、細胞質で14-3-3に受容され、Hd3a-14-3-3複合体を形成する。Hd3a-14-3-3複合体は核へ移動し、OsFD1とさらに高次の複合体FACを構築して花芽形成遺伝子の発現をスタートさせるのである(図1)。また、最近フロリゲンは花成のみならず植物の発生の多様な局面を制御することが明らかにされつつある[10, 11][10]Shalit, A., Rozman, A., Goldshmidt, A., et al.: The flowering hormone florigen functions as a general systemic regulator of growth and termination. Proc. Natl. Acad. Sci. USA 106 (2009) 8392-8397.
[11]Krieger, U., Lippman, Z. B. and Zamir, D.: The flowering gene SINGLE FLOWER TRUSS drives heterosis for yield in tomato. Nature Genet. 42 (2010) 459-463.。FACモデルはこの多機能性をも説明できると考えられる。14-3-3は多数の転写因子と結合可能であるから、Hd3aが14-3-3に受容された後、転写因子部分を変化させることで多様な機能を発揮できるという仮説である。従って、これらのメカニズムを踏まえてフロリゲン複合体の形成と機能を調節すれば、将来的に作物生産上重要な形質の改良に貢献できるであろう。
参考文献
[1]Taoka, K., Ohki, I., Tsuji, H. et al.: 14-3-3 proteins act as intracellular receptors for rice Hd3a florigen. Nature, 476 (2011) 332-335.
[2]Corbesier, L., Vincent, C., Jang, S. et al.: FT protein movement contributes to long-distance signaling in floral induction of Arabidopsis. Science, 316 (2007) 1030-1033.
[3]Tamaki, S., Matsuo, S., Wong, H. L. et al.: Hd3a protein is a mobile flowering signal in rice. Science, 316 (2007) 1033-1036.
[4]Abe, M., Kobayashi, Y., Yamamoto, S. et al.: FD, a bZIP protein mediating signals from the floral pathway integrator FT at the shoot apex. Science, 309 (2005) 1052-1056.
[5]Wigge, P. A., Kim, M. C., Jaeger, K. E. et al.: Integration of spatial and temporal information during floral induction in Arabidopsis. Science, 309 (2005) 1056-1059.
[6]Yaffe, M. B., Rittinger, K., Volinia, S., et al.: The structural basis for 14-3-3: phosphopeptide binding specificity. Cell 91 (1997) 961-971.
[7]Pnueli, L., Gutfingera, T., Hareven, D., et al.: Tomato SP-interacting proteins define a conserved signaling system that regulates shoot architecture and flowering. Plant Cell 13 (2001) 2687-2702.
[8]Lifschitz, E., Eviatear, T., Rozman, A., et al.: The tomato FT ortholog triggers systemic signals that regulate growth and flowering and substitute for diverse environmental stimuli. Proc. Natl. Acad. Sci. USA 103 (2006) 6398-6403.
[9]Komiya, R., Ikegami, A., Tamaki, S., et al.: Hd3a and RFT1 are essential for flowering in rice. Development 135 (2008) 767-774.
[10]Shalit, A., Rozman, A., Goldshmidt, A., et al.: The flowering hormone florigen functions as a general systemic regulator of growth and termination. Proc. Natl. Acad. Sci. USA 106 (2009) 8392-8397.
[11]Krieger, U., Lippman, Z. B. and Zamir, D.: The flowering gene SINGLE FLOWER TRUSS drives heterosis for yield in tomato. Nature Genet. 42 (2010) 459-463.
田岡 健一郎 TAOKA Ken-ichiro
奈良先端科学技術大学院大学 バイオサイエンス研究科
〒630-0101 奈良県生駒市高山町8916-5
TEL:0743-72-5506
e-mail:ktaoka@bs.naist.jp
大木 出 OHKI Izuru
奈良先端科学技術大学院大学 バイオサイエンス研究科
〒630-0101 奈良県生駒市高山町8916-5
TEL:0743-72-5576
e-mail:i-ooki@bs.naist.jp
辻 寛之 TSUJI Hiroyuki
奈良先端科学技術大学院大学 バイオサイエンス研究科
〒630-0101 奈良県生駒市高山町8916-5
TEL:0743-72-5501
e-mail:tsujih@bs.naist.jp
児嶋 長次郎 KOJIMA Chojiro
大阪大学 蛋白質研究所
〒565-0871 大阪府吹田市山田丘3-2
TEL:06-6879-8598
e-mail:kojima@protein.osaka-u.ac.jp
島本 功 SHIMAMOTO Ko
奈良先端科学技術大学院大学 バイオサイエンス研究科
〒630-0101 奈良県生駒市高山町8916-5
TEL:0743-72-5500
e-mail:shimamoto@bs.naist.jp








