Volume 07, No.2 Pages 78 - 84
2. 最近の研究から/FROM LATEST RESEARCH
X線で1分子の動きを追う
Dynamical X-ray Observations of Single Molecules
(財)高輝度光科学研究センター、大阪大学 蛋白質研究所、JST戦略基礎(佐々木チーム)研究代表 JASRI, Osaka University/IPR, JST/CREST
- Abstract
- We propose a new X-ray methodology for direct observations of the behaviors of single molecular units in real time and real space. This new system, which we call Diffracted X-ray Tracking (DXT), monitors the Brownian motions of a single molecular unit by observations of X-ray diffracted spots from a nanocrystal, tightly bound to the individual single molecular unit in bio-systems. DXT does not determine any translational movements, but only orientational movements. Recently, time-resolved dynamical X-ray imaging of individual DNA molecules with picometer-scale precision is demonstrated using DXT for the first time. DXT can obtain information about the dynamics of single molecules through a quantitative analysis, since the signals from DXT are independent of the chemical conditions.
1.1分子の動きを見る!
本研究の目的は、生きている細胞内で繰り広げられている生命現象の主役であるタンパク質分子が、いかにして生命の誕生、維持、崩壊を制御しているのかを、1分子の運動観察を元に原子レベル以下の精度で解析を試み、そして理解することである。とてつもなく大きなテーマであるが、重要な生命現象の各素過程を詳細に解析するためには、本来1分子で機能しているタンパク質分子の情報を1分子のままで得なければ、その詳細な解析は完結しない。そのためには、生体分子の定常状態における構造情報と、それに加え機能発現時の励起状態つまり、運動状態の情報が不可欠である。定常状態の方は静止しているから集団で計測しても情報は得られるが、運動状態にある分子の詳細を計測可能にするには1つ1つ分子をモニターするしかない。そこで、1分子計測学が必然的に登場してきたのである。これらの静と動の両面の情報が得られて初めて生命現象の基本が完璧に読み取れてくる。やがて、それらの研究成果は、生命現象を制御する人工系構築を進展させ、新しい知識が医薬的に活用されるようになるだろう。最終的に1分子計測研究の進展の先には、“真の生命の偉大さとは?”、“生命とは?”という大きなテーマに対して、納得の出来る解釈がなされるであろう。期待を含めてであるが、計測学の究極的方法論である1分子計測研究を促進させることで、21世紀のこれからの時代に相応しい新しい生命観が誕生する可能性もある。
2.1分子計測の歴史から必然的に生まれた
1分子計測の歴史はそれほど古いわけではない。企業研究者であるT. Hirschfeld[1][1]T. Hirschfeld : Appl. Opt. 15 (1976) 2965.によって1970年初頭に始まった。単純に基板上の蛍光分子を数えただけだった。この単純な実験が“分解能”とか、“回折限界”という亡霊に獲りつかれていた研究者達を大いに刺激した。1つの分子を見るのに分子レベルの定規はいらないことに気がついたのだ。それから生体分子に蛍光分子を標識して生体分子の運動を観察するという研究まで10年かかった。しかし、この最初の研究が日本で行なわれた[2][2]S. Matsumoto et al : J. Mol. Biol. 152 (1981) 501.ことは意義深い。当事者である柳田充弘氏曰く、“計測できる土壌はすでにあった。問題はそれをどう信頼できる実験で具現化するかであった。”と。彼が複雑な分子ではなく、基本的な生体分子、DNAに着目して実験を行なったのは正解であった。計測法の研究を行なう際に、対象物になにを選ぶかでその研究の運命が決まることはよくある。その後、筋肉系の実験[3][3]T. Yanagida et al : Nature 307 (1984) 58.で1分子計測法は市民権を得た。この研究がきっかけで、タンパク質1分子の運動を見るのに分子全体の詳細な画像を得ることが必ずしも必要ないという発想が定着した。そして、1分子計測はただ単に1分子の運動を見るだけではなく、タンパク質1分子の機能まで評価できるようになった。同時代にノーベル賞対象となった走査型トンネル顕微鏡[4][4]G. Binning et al : Phys. Rev. Lett. 49 (1982) 57.や、光ピンセット[5][5]A. Ashkin : Science 210 (1980) 1081.などが考案されているのは意外と相互に関連しているように思える。これらの新規な研究領域の誕生を見て、計測科学の新しい大きな潮流を感じるのは私だけではあるまい。
可視光で1分子の動きを見る方法は、正に“アッベの壁”をすり抜けた歴史的成果であるが、その位置決定精度がnmレベルまで行くとはだれも予想していなかったかもしれない。この数値は、検出器の位置分解能とビデオエンハンス法[6][6]B. J. Schnapp et al : Cell 40 (1985) 455.の利用で実現した。しかし、幸運にも上記の数値はこれ以上よくなることはなかった。タンパク質分子は、数nmから数十nmのユニットを形成するが、その分子内運動がその機能発現の鍵を握る場合が多い。しかも、タンパク質分子は私達が思っている以上に効率的なエネルギーの使い方をしているようなので[7][7]K. Kinoshita Jr. et al : Cell 93 (1998) 21.、コンパクトな構造変化が予想される。従って、タンパク質分子の内部運動を正確にモニターするにはpmのオーダーの精度が必要となる。ここで必要とされるプローブが可視域の光ではなく、X線となるのは必然的である。
正確な理論式ではないが、波長λとすると1分子計測の位置決定精度は、λ/100まで可能であるという。可視光領域が300〜800nmとすると数nmの位置決定精度は合点がいく。これをX線の波長(=0.01〜1nm)に置き換えて考えると、pmオーダーの位置決定精度が出ることになる。そんなバカなと思いながら私がノートの片隅で実験計画を立てていたのはもう5年も前のことである。
このようにして可視光を利用した計測方法の限界、そして計測の必要性からX線1分子計測は生まれた。今考えると、私でなくても誰かが発想した単純な研究展開であったように思える。しかし、波長を短くするという単純な解答を得た時点は、X線のどのような物理現象を利用すれば1分子という気が遠くなるような高感度を実現できるかを思案し倦ねる前の段階であり、ナノ結晶の標識という、これまた単純なアイデアが浮かぶまでは多くの試行錯誤が必要であった。
3.X線1分子計測の原理
1分子計測法で位置決定精度pmレベルが実現すれば、タンパク質分子の分子内運動が正確にモニターでき、機能発現に伴う微小な構造変化情報が得られる。しかし、多くの研究者は、“X線を用いて1分子を検出できるのか?”という疑問を持つであろう。それは、物質と電磁波との断面積の大きさは、波長に比例するという常識からの当然の疑問である。無論、X線の発光、吸収、散乱現象を用いて1分子を直接的に検出することは第三世代大型放射光施設を用いて数時間の積算をしたとしても難しい。私は、X線の物理現象で一番高感度な現象、つまりX線回折を利用した、時分割回折X線追跡法(Diffracted X-ray Tracking: DXT)が1分子検出の可能性を秘めていると直感した。X線1分子計測法のアイデアは単純である(図1)。まず、直径数nm程度の極微結晶をタンパク質分子にその機能を損なわないように標識する。そして、極微結晶からのラウエ斑点を指標に、着目したタンパク質分子の動きを時分割(〜ms程度)トレースする。この新規計測法DXTによって、細胞内でのリアルなタンパク質1分子に関する三次元動的構造情報を得ることが可能となる。
実験は、大型放射光施設SPring-8(BL44B2)にて行った。検出器は、X線イメージインテンシファイヤーを使用し、数ミリ秒の積算時間で1秒間(ビデオレイト)の連続計測を行った。
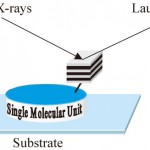
図1 X線1分子計測の原理図
4.X線1分子計測で重要な新技術
図1を見ても想像がつくかもしれないが、X線1分子計測を成功させるためには、3つの技術的ポイントがあった。(1)良質のナノ結晶作製、(2)生体1分子(ユニット)のソフトな基板固定及び、(3)1分子に対して1ナノ結晶を1対1に標識する方法である。(1)については後述する。
(2)については、水溶液中を拡散、ブラウン運動している分子にナノ結晶を標識しても、現在のX線検出システムではX線回折斑点を効率良くモニターすることはできない。従って、X線を非常に良く透過する石英基板(厚さ70µm)の上に生体分子をソフトに化学固定することにした。固定法はいくつかの方法が開発されている。ポイントは目的分子と基板表面の間を直接接触させない程度に基板修飾分子で空間を空けることである。しかし、空けすぎると極端な言い方をすれば、水溶液中に存在している時の自由運動と同様の運動をしてしまうので、これまた計測不可能となってしまう。上記空間は目的分子や固定する残基位置に依存して異なる。ここで注意することは、この固定法がX線1分子計測法の必須条件ではないと言う点である。検出されるX線回折斑点の感度が向上すれば、より高速の計測が可能となり、水溶液中を浮遊している分子の分子内運動も計測できる可能性はあるということを付け加えておく。
(3)に関しては現在のところ、完全には解決していない。理想的には目的1分子に標識されるのはナノ結晶1つでなければならない。それも目的分子中の1つのサイトを介してである。本研究で用いているナノ結晶は金結晶であり、金はX線回折の検出感度が高いばかりではなく、金表面とシステインとの共有結合が有効に利用できる。金表面は無数の活性サイトを持っているので、複数のシステインとの反応が進むことが容易に予想される。現状は、金表面の汚れのためにそれほどの多くの活性サイトを金ナノ結晶表面に考えなくてもよいのであるが、将来的には活性表面をこちらが指定した表面電荷になるような金表面化学修飾を施して、完全に1つの反応分子のみを金ナノ結晶表面に修飾することが可能であると考えている。
5.ナノ結晶の作製
最初にX線1分子計測の実験に用いたナノ結晶は、サイズが非常に揃っている金コロイドであった。金コロイドは電子顕微鏡でその格子像が確認されている結晶体であるが、SPring-8でラウエ像を取ると、回折斑点はほとんど得ることができなかった。これは、物質に対する電子線とX線の断面積の違いを如実に表わした結果として理解できる。逆に考えると、電子線回折を利用する1分子計測方法も可能性があることになる。
より良質の結晶を作製すべく、一次元及び三次元結晶の自作を始めるしかなかった。主に2つの方法を考案した。1つ目はX線の反射鏡に使用されている多層膜(Mo/Si系)をナノレベルのドライエッチングにより切り出した多層膜微粒子である(図2a)。最終的に基板から多層膜粒子を切り離さなければならないので、その際の工夫は厄介であるが高反射率で直径15〜25nmの多層膜粒子の作製に成功した[8][8]Y. C. Sasaki et al : Phys. Rev. E. 62 (2000) 3843.。2つ目の方法は、結晶性の良い薄膜を作製するために無機材料において応用されている現象、エピタキシャル成長を利用した方法である。NaCl(100)面上に連続膜になる前段階の状態まで金を0.5〜1.0Å/sで真空蒸着する。そうすると金は不連続膜(アイランド)状態でエピタキシャル成長する。金結晶が成長している間、基板の温度は700〜800℃に保持しておく。そうすると、膜厚10nmで直径15〜20nmの金ナノ結晶が完成する(図2b)。特記することは、エピタキシャル成長をこのようにナノ結晶(粒子)を作製するために積極的に利用した例は本実験が初めてという点である。しかし問題点があった。この金ナノ結晶や先の多層膜粒子はいずれも真空中で作製したものなので、各ナノ結晶を水溶液で使用するために基板から剥離させると一瞬にして凝集が開始し、1分子への化学的標識など到底不可能であった。そこで、その凝集の原因であるナノ結晶表面の疎水性を親水性に変えるために界面活性剤を比較的高濃度(10〜50mM)添加して安定なナノ結晶溶液とした(図2b)。この界面活性剤自身がこの後の生体分子との反応効率に影響しないことは確認済みである。
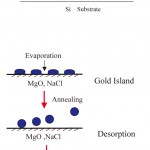
(a)多層膜ナノ粒子の作製断面図
(b)エピタキシャル成長を利用した金ナノ結晶の安定水溶液の作製手順
図2 ナノ結晶作製法
6.DNA分子を用いた測定限界
新しい計測法の測定限界を決定することは、これから計測対象になるサンプル系を明確化できるだけでなく、解析上も重要な因子の決定となる。その際の参照分子として、分子設計が比較的簡単なDNA分子を採用した。図3のように、直径10〜15nm程度のナノ結晶体を計測したいDNA1分子(図では短い塩基列を持ったDNA分子)の興味ある部位(ここでは末端)に化学的に標識する。完全に水溶液中で自由にブラウン運動している分子は、標識したナノ結晶からの回折斑点を検出できない。従って、ある基板表面に固定することになる。その際、分子の固定とナノ結晶の標識によって計測したい分子の運動特性が変化しないように最大の注意を払う。基板に固定された分子はそれでもブラウン運動をする。その時、標識されたナノ結晶も同様に運動するので、その標識された1つのナノ結晶からの回折斑点を追跡すれば、基板に固定された1分子の運動を計測できる。本実験は、ある領域内のブラック角すべてで反射が可能でなければ、回折斑点を用いた連続的運動追跡は不可能なので白色X線が必要となる。その点、本来白色特性を持つ放射光光源は理想的である。しかし意外にも、SPring-8のビームラインで白色X線を利用するのは例外的で特記に値する。
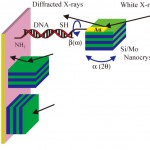
図3 DNA 1分子計測
(a)DNA 1分子の計側 (b)ナノ結晶の物理吸着
(c)回折斑点がナノ結晶から回折斑点が検出できない場合
検出系は、X線を可視蛍光に変換するX線イメージングインテンシファイヤーV5445Pを使用。可視蛍光はCCDカメラにて検出。この検出システムがビデオレイトのリアルタイムイメージングを可能にした。サンプルは、厚さ7µmの水溶液層を挟んで両側にX線透過フィルムで封をしている。サンプルは温度制御可能でDNA分子の実験では5℃設定下で行われた。1秒間の照射実験を何度も繰り返し、各運動を統計処理して既知のブラウン運動と比較検討した[9,10][9]Y. C. Sasaki et al : Nucl. Instrum. Methods. A467-468 (2001) 1163.
[10]Y. C. Sasaki et al : Phys. Rev. Lett. 87 (2001) 248102.。
図3aはDNA分子をアミノ基で固定して、金ナノ結晶をSHで修飾した。分子の運動は大まかに2種類ある(αとβ)。現在の透過型ラウエ斑点計測だと、α型の運動に対して非常に感度良く計測される。図3bでは、もしナノ結晶にDNA分子が修飾されずに物理吸着した場合を表わした。また、図3cでは図3b同様、物理吸着している場合でも、回折条件が満たされずに回折X線が得られない例を示した。つまり、X線1分子計測法では、X線照射内にナノ結晶があっても回折条件が満たされない場合はナノ結晶の存在を確認することはできないことがある。
X線1分子計測法の測定限界は、図3bの例を利用して決定される。確認された回折斑点の安定性を観察する。50点程度の回折斑点を観察した結果、1秒間に2θ=1.5mrad以内の安定性が確認され、この数値をもし長さ6nmのDNA分子の最小運動値として表わすのであれば、4.5pmという数値を得ることができる。この数値はなんと原子の1/100の長さに相当する。
図4はDNA 1分子を計測した例である。各フレーム間は0.25秒。1秒間の観察結果を示した。2θ方向に回折斑点が運動しているのが分かる。いままで、回折像が動画として認識された例はほとんどなく、X線1分子計測法の発想がいかに意外性があり、有効かが理解できる。
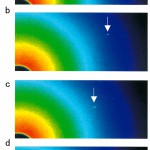
図4 X線回折斑点の実時間検出(DNA 1分子(18 mer)の場合)
7.ミオシン分子の拘束ブラウン運動
筋肉の主成分であるミオシン分子のATP加水分解に関係する構造変化計測を試みた。石英基板上に取りはずし可能な化学法で固定したミオシン分子(図5)に直径20nmの金ナノ結晶をラベルし、溶液内にATP分子、ADP分子、及び核酸非存在下の各条件下でpm(nm/1000)レベルの1分子内ブラウン運動のリアルタイム計測を行った。一般の1分子計測において、1分子全体が(1粒子として)溶媒中をブラウン運動しながら拡散して行く現象は数多く確認されている。しかし、分子内のある特定の部位、この場合は筋肉力発生メカニズム解明の中心的存在であるレバーアーム部位において、各溶液条件下での1分子内ブラウン運動の差異の計測に成功した例は今まで全くなかった。測定温度は5℃、基準水溶液成分はTris/HCl(pH=8.0、50mM)、150mM KCl下で行った。ミオシンS1分子は、C末端を基板側に固定し、N末端を結晶クラスターの標識サイトに使用した(図5)。これによりレバーアーム部位の構造変化を詳細に計測することが可能となる。
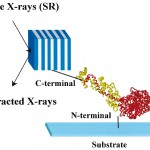
図5 ミオシン分子のサンプル配置
実験結果は、核酸非存在下、及びMg-ADP分子存在下では、全く自由な拘束されないブラウン運動をしていたが、Mg-ATP存在下では、推定拘束面積1.1nm2程度の拘束されたブラウン運動をすることが確認された。これは生化学で常識的な“Mg-ATPはATP加水分解の阻止剤として働く”という現象を分子内の1分子の動的情報と合致させる非常に重要な計測結果であると結論づけた。
一般に、ブラウン運動を解析するためには、分子の運動に関わる測定値のMSD(Mean Square Displacement)曲線を表示することで議論される。MSD曲線において、直線的な関係が成立する場合(本実験では核酸分子が存在しない場合図6aは、なんの外力も存在しないブラウン運動と帰属される。しかし、図6bでは、ある値で飽和する曲線が得られた。これは明らかに外力の存在を示しており、その外力により分子はその飽和値の面積内に拘束された運動をしていることになる。従って、ミオシン分子のレバーアーム部位は、ATP分子などが存在しない場合は、全く自由にふらふらとブラウン運動を好き勝手に運動しているが、ATP分子がそのレバーアーム部位の根元に反応(ATP分子の反応部位はすでに知られている)すると、アーム部位の運動は拘束運動に変化することが分かった。極端に解釈すると、ATP分子があるサイトに侵入するとレバーアーム部位の運動は停止するとも表現できる。これが力発生にどのように関わっているかを解明するには、もう少し多くの因子を変化させてみなければ分からないが、この実験方向で各溶液条件によって、分子内運動を明確に区別することができる方針がたったことは大いなる進展であった。
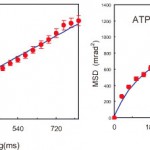
(a) (b)
図6 ブラウン運動特性を評価するために用いられるMSD曲線
(a)図は測定時に水溶液に核酸分子が全く存在しない場合。(b)図はATP分子が共存している対照実験。
8.アクチン繊維内の分子揺らぎ(発想の転換)
ミオシン分子の場合、分子内の構造変化を計測することが最終的な目標である。しかし、生体分子の中には、特異的な構造変化よりも分子の硬さや揺らぎなどの運動が非常に重要である場合もある。ここでは、ミオシン分子の相手役であり、分子(繊維)の分子内揺らぎが最近注目されてきたアクチン分子の分子内揺らぎを計測することにした。アクチンの基板固定、及びナノ結晶固定には、特別な変異体を使用しないで行った。アクチンはシステイン基を介して金基板表面に吸着させて、金ナノ結晶は反対側のシステイン基を介して図7にあるように標識した。溶液条件は水溶液内にファロイジンを含む場合、含まない場合。それにCa系、Mg系での実験を試みた。
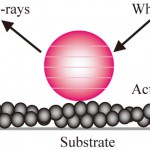
図7 アクチン繊維の局部的分子揺らぎの計測法
測定温度は5℃、基準水溶液成分はTris/HCl(pH=8.0、50mM)、1.0mM ATP、100mM KCl下で行った。実験結果としては、MSD曲線より比較的拘束されたブラウン運動が検出された。これは明らかにアクチン繊維の基板固定法に問題があると思われる。なぜならば、本実験のあらゆる溶液条件(Mg,Ca及びファロイジン共存下)において拘束運動が確認されたからである。しかし、同じ拘束運動でも、Mgイオン共存条件よりもCaイオン共存条件の方が、またファロイジン共存下よりも非存在下の方が繊維内の分子揺らぎが大きい(柔らかい)という特徴は評価することができた。
ここで、重要な発想の転換を読み取ることにできる方は先が見える研究者である。筋肉系の研究は現在1分子の構造変化計測と機能計測に集中している。しかし、1分子の運動がある程度理解されてくれば、最終的には筋肉というシステムでの運動解析を進めなければならない。そうしなければ、筋肉系の運動メカニズムを正確に理解したことにはならない。つまり、最終段階では、システムを解析しつつ、1分子の運動をモニターしなければならない。今回のアクチンの実験は、システムをできるだけ破壊せずに、そのシステムの中で行われている1分子及び、局部的運動をいかに精度よく計測できるかを試みた。次の段階ではミオシン分子の運動も加えてアクチンの局部運動をモニターする予定である。当然最終的には、筋肉システムの中でのアクチン1分子の動き、ミオシン1分子の動きを詳細にしていく予定である。このように、本来1分子で機能していない系を1分子計測の研究対象にする場合、注意しなければならないのは、単純な1分子計測が最終目標ではないことを認識する点である。ルーチン的な還元主義は生命現象の本質を見失うことがあることをいつも注意しなければならない。
9.展望:将来に向けて
人間のDNA塩基配列が決定し、そのゲノムが設計しているタンパク質分子の機能発現メカニズムを正確に理解するためには、最終的には機能を実際に具現化している細胞内でどのように運動しているのかを測定しなければならない。そのためにも、細胞内実時間1分子計測の完成を目指して、X線1分子計測を発展させていかなければならない。最初に手がける系としては、やはり1分子機能計測法が確立している、イオンチャネル等のパッチクランプ法との併用実験であろう。多くの運動予想がある中で、実際に運動計測した例は未だになく、X線1分子計測法以外に成功する実験系は今のところない。
もう1つ生命科学を大きく進展させるために必要な情報は、生体分子の迅速な構造情報の取得である。計算科学の大躍進が期待される昨今、X線1分子計測法から得られた動的分子挙動解析を元に、より正確な計算科学による生体分子フォールデング過程の解析を進ませてみたい。より正確により迅速に生体分子フォールデング過程を計算科学によって予想することができるようになれば、安定な構造情報もその1つの解として得ることができるであろう。また、それに同期した細胞内での機能計測も研究が進めば、生体分子がいかにして機能を発現しているか、その基本的法則が見えてくるかもしれない。時代は正に“1分子”の時代に突入したと断言できる。
10.おわりに
本研究は、その初期段階において科学技術振興事業団個人研究推進事業さきがけ研究21(JST/ PRESTO)の研究助成により推進された。また、今年度から、同事業団戦略的基礎研究推進事業(JST/CREST)“蛋白質の構造・機能と発現メカニズム(テーマ名)X線1分子計測からのin-vivoタンパク質動的構造/機能解析”において5年間の研究助成をいただくことになった。この5年間で、X線1分子計測法という全く新しい研究領域の根幹を確立する予定である。最後に、本研究推進にあたり、SPring-8/JASRIの八木直人氏、鈴木芳生氏にはアイデア当初から討論をしていただいた。この場をお借りして感謝したい。また、足立伸一氏、谷口彬雄氏、奥村泰章氏、岡 俊彦氏、井上勝晶氏、大石 昇氏、須田 斎氏にもこの場をお借りして感謝したい。
参考文献
[1]T. Hirschfeld : Appl. Opt. 15 (1976) 2965.
[2]S. Matsumoto et al : J. Mol. Biol. 152 (1981) 501.
[3]T. Yanagida et al : Nature 307 (1984) 58.
[4]G. Binning et al : Phys. Rev. Lett. 49 (1982) 57.
[5]A. Ashkin : Science 210 (1980) 1081.
[6]B. J. Schnapp et al : Cell 40 (1985) 455.
[7]K. Kinoshita Jr. et al : Cell 93 (1998) 21.
[8]Y. C. Sasaki et al : Phys. Rev. E. 62 (2000) 3843.
[9]Y. C. Sasaki et al : Nucl. Instrum. Methods. A467-468 (2001) 1163.
[10]Y. C. Sasaki et al : Phys. Rev. Lett. 87 (2001) 248102.
佐々木 裕次 SASAKI Yuji C.
SPring-8大型放射光施設 (財)高輝度光科学研究センター 放射光研究所 生物医学G 副主幹研究員。(兼任)大阪大学 蛋白質研究所(客員部門)蛋白質機能評価研究部門教授。(兼任)科学技術振興事業団 戦略的基礎研究推進事業(JST/CREST)“蛋白質の構造・機能と発現メカニズム”佐々木チーム研究代表者。
TEL:0791-58-0802(03931) FAX:0791-58-2512
e-mail:ycsasaki@spring8.or.jp
略歴:1991年 東北大学大学院 工学研究科博士課程修了(工学博士)。








