Volume 06, No.5 Pages 377 - 382
4. 最近の研究から/FROM LATEST RESEARCH
細菌べん毛素繊維の結晶構造とスイッチ機構
Crystal Structure of the Bacterial Flagellar Protofilament and Its Switch Mechanism
[1]松下電器産業㈱ 先端技術研究所、科学技術振興事業団 ERATO プロトニックナノマシンプロジェクト Advanced Technology Research Laboratories, Matsushita E. I. Co., Ltd./Protonic NanoMachine Project, ERATO, JST、[2]科学技術振興事業団 ERATO プロトニックナノマシンプロジェクト Protonic NanoMachine Project, ERATO, JST
- Abstract
- The bacterial flagellar filament is a helical propeller made of 11 protofilaments of a single protein, flagellin. The filament switches between left- and right-handed supercoiled forms when bacteria switch the swimming mode between running and tumbling. Supercoiling is produced by two different packing interactions of flagellin called L and R. In switching from L to R, the intersubunit distance (~52 Å) along the protofilament decreases by 0.8 Å. We solved the 2.0 Å resolution crystal structure of a 41-kDa fragment of Salmonella flagellin. The crystal contained pairs of antiparallel straight protofilaments having the R-type repeat. By simulated extension of the protofilament model, we identified possible switch regions responsible for the bi-stable mechanical switch.
1.はじめに
細菌の多くはべん毛と呼ばれるらせん型繊維をスクリュープロペラとして回転させ、数10µm/秒の速度で活発に泳ぎ回る。そうして栄養や温度など最適環境に集まるのを走性と呼ぶ。大腸菌やサルモネラ菌の典型的な運動パターンは、2〜3秒間の直線的泳ぎと0.1秒ほどの方向変換の繰り返しである。移動にともなう環境変化を細胞膜上のセンサー蛋白質が検出し、方向変換頻度を制御する。1〜2µmの菌体長に対し、べん毛は長さ10数µmにも達するが、直径は20nmの細長い繊維である。その根元に細胞膜に固定された直径30nm程の回転モータがあり、200〜300Hzで回転する[1][1] H. Berg : Phil. Trans. R. Soc. Lond. B, 355 (2000) 491-501.。
べん毛の構築はモータ部分から始まり、細胞外に長く伸びる軸構造の構成蛋白質はべん毛中心を貫通する細長い穴を通って先端に運ばれ、常に構造の先端に組み込まれる(Fig.1)。長いらせん部分はべん毛繊維と呼ばれ、1種類の蛋白質フラジェリンが非共有結合で重合した繊維である。長さ10µmのべん毛繊維を構築するのに約2万1千分子のフラジェリンが必要で、2〜3時間かけて10数µmまで伸びる[2][2] K. Namba and F. Vonderviszt : Quart. Rev. Biophys., 30 (1997) 1-65.。
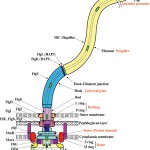
Fig. 1 Schematic diagram of the bacterial flagellum. Different colors represent different protein components. Labels on the left are the names of proteins and those on the right are the names of structural parts, where red labels indicate functions.
べん毛繊維のらせん構造はピッチ約2.3µmの左巻で、数本のべん毛繊維の同期した回転により推力を発生し菌体は直進するが、方向変換時にはモータの急反転トルクによりらせんが瞬時に右巻きに変わり、束がほぐれて推力バランスが崩れ、その結果菌体が方向変換する[3][3] R. M. Macnab and M. K. Ornston : J. Mol. Biol., 112 (1977) 1-30.。このように、べん毛はただの堅いスクリューではなく、ダイナミックな形態スイッチ機構をもつ構造体である。
そもそも一種類の蛋白質からなるチューブ状構造体がどのようにして曲率を生じるのかが不思議であり、長い間謎であった。しかし、以下に解説するように、構造解析法の工夫と進歩、特にSPring-8の高輝度で波長可変のX線だからこそ可能であった結晶解析によって我々が最近明らかにしたべん毛素繊維の分子構造は、この謎をみごとに解き明かした。
2.べん毛繊維の基本構造
サルモネラ菌のべん毛繊維は、分子量51.5kDaのフラジェリン(494アミノ酸残基)で構成され、その基本構造はFig.2のようになっている。この立体像は、極低温電子顕微鏡により凍結氷包埋したべん毛繊維の像を多数集めて画像解析することにより得られた、9Å分解能の像である[4][4] Y. Mimori, I. Yamashita, K. Murata, Y. Fujiyoshi, K. Yonekura, C. Toyoshima and K. Namba : J. Mol. Biol., 249 (1995) 69-87.。直径230Åで中心に直径30Åのチャネルが貫通しており、半径60Åまではサブユニットが密につまってべん毛繊維の芯を作っているが、外側は突起状に突き出ている。これらの突起からサブユニットのらせん配列、つまり1重らせん2巻きに11サブユニットの並び、また見方を変えれば11本の素繊維の束であることがよくわかる。
芯の内部構造を等高線図で見ると、密度の高い部分が同軸2重円筒構造を作っている。フラジェリンは動径方向に並んだ4つのドメインからできていて、内側から順にD0、D1、D2、D3と名付けた。ドメインD0は2重円筒構造の内筒を、D1は外筒を形成している。様々な部分を取り除いたフラジェリンが形成する繊維の構造解析結果から、N末端とC末端がD0にあり、D0、D1は主にαヘリックス、D2、D3はほとんどβ構造であることなどがわかっていた[5−8][5] Y. Mimori-Kiyosue, F. Vonderviszt, I. Yamashita, Y. Fujiyoshi and K. Namba : Proc. Natl. Acad. Sci. USA, 93 (1996) 15108-15113.
[6] Y. Mimori-Kiyosue, F. Vonderviszt and K. Namba : J. Mol. Biol., 270 (1997) 222-237.
[7] Y. Mimori-Kiyosue, I. Yamashita, Y. Fujiyoshi, S. Yamaguchi and K. Namba : J. Mol. Biol., 284 (1998) 521-530.
[8] K. Namba, I. Yamashita and F. Vonderviszt : Nature, 342 (1989) 648-654.。

Fig. 2 Three-dimensional structure of the R-type straight flagellar filament. (a) Solid surface rendering, (b) contoured density map. The cross section is 50 Å thick and the longitudinal section is 30 Å thick. Blue contour lines represent the surface of the molecules, and red contour lines show the density twice higher than that of the blue contour. The resolution of the map is 9 Å.
3.べん毛繊維がらせん型になるしくみ
べん毛繊維のらせん型の形状は、細菌の運動を推進するプロペラとして働くために必須である。1種類の蛋白質フラジェリンで構築されるにも関わらず、その繊維構造が緩やかな曲率とねじれを持ち、いわゆる超らせん構造を形成する。しかもその超らせん構造は、べん毛モータ反転のねじれの力で左巻きから右巻きに瞬時に変換し、直進運動中に形成されるべん毛の束が急速にほぐれて菌体を方向転換させる[3][3] R. M. Macnab and M. K. Ornston : J. Mol. Biol., 112 (1977) 1-30.。そのしくみはどんなものか?
べん毛の超らせん形成のしくみについて、朝倉はFig.3のような2状態素繊維モデルを考えた[9][9] S. Asakura : Adv. Biophys., 1 (1970) 99-155.。べん毛繊維の11本の素繊維が全て同じ周期構造なら、まっすぐのチューブ構造しか形成しない。しかし、素繊維がその周期長と素繊維間結合位置の異なる2種類の構造をとり、それらがチューブ構造に混在すれば、周期長の差が曲率を産み、素繊維間結合位置の差がチューブ軸に対する素繊維方向の変化となってねじれを生じ、超らせん構造を形成する。また2種類の素繊維構造の本数割合が変化すれば、繊維のらせん型は様々に変わり得る。
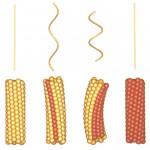
Fig. 3 Model of polymorphic supercoiling of the flagellar filament. Upper panel show the filament shape and lower panel show the subunit packing arrangement. The types of the filaments (from left to right): L-type straight; normal (the left-handed helix of the wild type); curly (the right-handed one produced upon reversal of the flagellar motor rotation); R-type straight. Two different colors of subunits represent two distinct conformations, where the repeat distance of the protofilaments in red is shorter than that in brown, which produces the curvatures.
このモデルから、らせん対称性と素繊維周期長の異なる2種類の直線型べん毛繊維の存在が予測され、実際に様々な条件下で見つかった[10][10] R. Kamiya, S. Asakura, K. Wakabayashi and K. Namba : J. Mol. Biol., 131 (1979) 725-742.。我々はフラジェリンのアミノ酸1個の変異によって直線型チューブ構造を安定に形成する変異株を用いて構造解析を進めた。
2種類の直線型べん毛繊維は、その素繊維の傾きに応じてL型およびR型と名付けられた[10][10] R. Kamiya, S. Asakura, K. Wakabayashi and K. Namba : J. Mol. Biol., 131 (1979) 725-742.(Fig.3)。高度に配向させたべん毛繊維の液晶試料からX線繊維回折像を記録し、その回折層線位置から素繊維に沿った周期長を正確に求めたところ、L型が52.7Å、R型が51.9Åであった。わずか0.8Åという原子1個分より小さな周期長差が、べん毛繊維の緩やかな曲率を作るために使われていた[11][11] I. Yamashita, K. Hasegawa, H. Suzuki, F. Vonderviszt, Y. Mimori-Kiyosue and K. Namba : Nature Struct. Biol., 5 (1998) 125-132.。つまり、べん毛素繊維の長さ方向の機械的スイッチ精度は、実に0.1Åレベルなのである。
4.結晶構造中の素繊維構造
フラジェリンは繊維構造を形成する性質が非常に強く、どのような結晶化条件も繊維形成を促進するのみであった。そこで、モノマー状態ではフォールドしていない両末端セグメントをそれぞれ52残基と44残基取り除き、分子量41kDaのフラグメントF41を作ることで結晶化に成功した。しかし得られた結晶は極めて薄く、厚さは10ミクロン以下であった。回折データ収集には大変な困難をともなったが、幸いそのころより利用可能となった第3世代の放射光施設(SPring-8やESRF)の高輝度で波長可変X線により凍結結晶から回折データを得て、最終的にはBL45XUでの多波長異常分散回折データにより2.0Å分解能で分子構造を解くことができた[12,13][12] F. A. Samatey, K. Imada, F. Vonderviszt, Y. Shirakihara and K. Namba : J. Struct. Biol., 132 (2001) 106-111.
[13] F. A. Samatey, K. Imada, S. Nagashima, T. Kumasaka, M. Yamamoto, F. Vonderviszt and K. Namba : Nature 410 (2001) 331-337.。
F41分子はFig.4に示すように、比較的独立した3つのドメインからなる。N末端とC末端からなるドメインD1は、3本のαヘリックスと1本のβヘアピンからできており、残りのドメインD2とD3はほとんどβ構造である。D2とD3にはユニークなフォールドも見つかり、デカルトのフォーリアム(葉線)と呼ばれる3次曲線にちなんでβフォーリアムと名付けた(Fig.4c)。
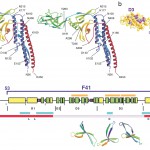
Fig. 4 Molecular structure of the F41 fragment of flagellin. (a) Ribbon diagram of the Cα backbone in stereo. Color changes gradually from the N-terminus (red) to the C-terminus (blue). (b) Distribution of hydrophobic side chains showing the three domains. (c) Distributions of various structural features along the amino acid sequence. From top to bottom: the region of F41 (dark blue line); three regions of β-folium (orange); secondary structures identified in the F41 model (α-helix, yellow; β-structure, green; β-turn; purple); tic mark at every 50 residues; region corresponding to each domain; region involved in axial subunit contact within the protofilament (cyan); well-conserved regions (red); positions of mutations that produce various helical and straight forms (c, curly; L, L-type straight; R, R-type straight); ribbon diagram of three β-folia.
結晶格子のa軸周期が51.9Åで、R型の素繊維周期と全く同じであったため、構造が解けるとまずa軸に沿った分子の並びを確認した。それは確かに素繊維であった。べん毛繊維を形成する際には平行に並んだ11本の素繊維がらせん対称性に従って束になるが、結晶中では素繊維が反平行に繰り返し並んでシート構造を形成し、そのシートが積層して単結晶に成長していた(Fig.5a)。結晶のa軸に沿った分子配列を1本を取りだして、電子顕微鏡像解析で得られた密度分布図にはめ込むと、その一致度からべん毛の素繊維であることが一目瞭然である(Fig.5b)。密度分布図では、内筒ドメインD0のみが分子模型では満たされず、この領域が取り除いた両末端によって形成される部分である。繊維構造の安定化に重要な分子間相互作用部位であることを明瞭に示している。
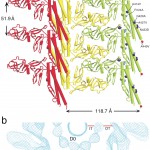
Fig. 5 Molecular packing in the F41 crystal and superposition of the protofilament model on an EM density map. (a) Upper panel is the view along the a-axis and lower panel shows the view along the b-axis of the F41 crystal. Amino acid residues involved in polymorphic mutations are indicated. (b) Docking of the protofilament model in an EM density map. Upper panel, a cross section; lower panel, a longitudinal section. Both are 50 Å thick. IT and OT indicate the inner and outer tube region, respectively, and these two high-density regions are painted light blue to indicate that these regions are filled, not empty.
素繊維構造から素繊維に沿った分子間相互作用について詳細な情報が得られ、素繊維の周期構造をスイッチするしくみについてもその手がかりが得られた。べん毛らせん型変異株フラジェリンのアミノ酸変位の位置[14][14] S. Kanto, H. Okino, S.-I. Aizawa and S. Yamaguchi : J. Mol. Biol., 219 (1991) 471-480.についても、そのうちいくつかは素繊維軸に沿った分子間相互作用との関わりが明らかになった(Fig.4と5)。
5.素繊維モデル伸張実験によるスイッチの同定
べん毛繊維中でのわずかなねじれを除けば、結晶構造中の分子配列はR型、つまり周期長が0.8Å短い方の素繊維構造そのものであった。そこで、素繊維の周期構造を切り替えるスイッチ機構を構造中に探すため、R型素繊維モデルを伸張する計算機シミュレーションを行った。実際には3分子からなる素繊維モデルを設定し(Fig.6a)、下の分子のみ0.1Åずつ下方へずらし、そのたびに上下2分子のCα骨格を固定してモデル全体のエネルギー最小化を行い、中間に位置する分子にどのような構造変化が起こるかを見た。
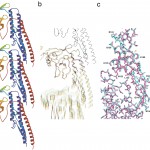
Fig. 6 Simulated extension of the protofilament model. (a) Three subunits as a protofilament model. (b) Superposition of Cα backbones at different steps of the simulated extension colored from blue to green to yellow to red. The β- hairpin in domain D1 makes a small but significant jump in its conformation from 4.5 Å to 4.7 Å extension. (c) Magnified image of the β- hairpin portion in stereo at extensions of 4.5 Å (cyan) and 4.7 Å (dark pink). The conformational jump of the β- hairpin is clearly shown.
下の分子の移動距離が4.5Åまでは、中間の分子の構造はゆっくりと一様に伸びるだけであった。それはαヘリックスのピッチの変化に良く現れている。しかし、移動距離が4.5Åから4.7Åへ進んだわずか0.2Åの間に、中間の分子のドメインD1のβヘアピンが斜め下方へジャンプしたのである(Fig.6bとc)。このβヘアピンは、アミノ酸配列上その手前にある2つの連続したβターンとともに、素繊維軸方向の分子間相互作用に直接関わる部分であり、この部分をわずかにスイッチすることによって素繊維の周期構造が切り替わるしくみになっていると考えられる。
このようにべん毛素繊維構造では、0.8Åというわずかな周期長変化を高精度で実現するスイッチが、一般的には疎水性コアを形成し安定で固い構造と考えられるドメイン内部の小さな構造変化として見つかった。このβヘアピンがドメイン内でそのコンフォメーションをわずかに変化できる理由は、ドメインD1の疎水性コア内の側鎖間相互作用に一ヶ所見られる大きな隙間によるらしい。この構造設計により、このドメインはひとかたまりの剛体として挙動せず、機械的スイッチ機能を持つと考えられる。
6.むすび
SPring-8の高輝度X線を利用することで、べん毛繊維がさまざまならせん型になるための素繊維周期長のスイッチ機構を初めて明らかにすることができた。そして、水素結合など弱い結合力で構造形成するため必然的に柔らかい構造を持つ蛋白質が、0.1 Åレベルの高精度スイッチ機構をいかに実現しているかが明らかになった[13][13] F. A. Samatey, K. Imada, S. Nagashima, T. Kumasaka, M. Yamamoto, F. Vonderviszt and K. Namba : Nature 410 (2001) 331-337.。これは全く特異的なものではなく、一般的に蛋白質ナノマシンのポテンシャルの高さを示すものであり、ナノマシン立体構造の設計原理としていずれ役に立つものである。ひとつひとつの原子を積み上げ組み上げて機能素子やナノマシンの製作を目指すナノテクノロジーでは、大量生産技術の開発がもっとも大きな障壁である。その点、自己組織化という能力により立体構造を形成する蛋白質ナノマシンは、大量生産が容易である。生命活動を支える膨大な種類のナノマシンの構造と動作機構を解明することで、その設計原理を学び人工ナノマシンの設計製作に役立てることが、21世紀に大きな応用展開が期待されるナノテクノロジーの基盤づくりにおいて目指すべき、ひとつの重要な方向であろうと思われる。
謝 辞
本研究の結晶回折データ収集にあたっては、SPring-8の河本正秀、三浦圭子、神谷信夫、ESRFにおられた富崎孝司、若槻壮市の各氏ほか、大勢の方々にお世話になった。また最終的に構造解析を可能にした多波長以上分散回折データは、理化学研究所の山本雅貴、熊坂 崇の両氏の協力を得てBL45XUで収集したものである。SPring-8ビームライン建設を主導された植木龍男氏ほか多くの方々にも、心から感謝の意を表したい。
参考文献
[1] H. Berg : Phil. Trans. R. Soc. Lond. B, 355 (2000) 491-501.
[2] K. Namba and F. Vonderviszt : Quart. Rev. Biophys., 30 (1997) 1-65.
[3] R. M. Macnab and M. K. Ornston : J. Mol. Biol., 112 (1977) 1-30.
[4] Y. Mimori, I. Yamashita, K. Murata, Y. Fujiyoshi, K. Yonekura, C. Toyoshima and K. Namba : J. Mol. Biol., 249 (1995) 69-87.
[5] Y. Mimori-Kiyosue, F. Vonderviszt, I. Yamashita, Y. Fujiyoshi and K. Namba : Proc. Natl. Acad. Sci. USA, 93 (1996) 15108-15113.
[6] Y. Mimori-Kiyosue, F. Vonderviszt and K. Namba : J. Mol. Biol., 270 (1997) 222-237.
[7] Y. Mimori-Kiyosue, I. Yamashita, Y. Fujiyoshi, S. Yamaguchi and K. Namba : J. Mol. Biol., 284 (1998) 521-530.
[8] K. Namba, I. Yamashita and F. Vonderviszt : Nature, 342 (1989) 648-654.
[9] S. Asakura : Adv. Biophys., 1 (1970) 99-155.
[10] R. Kamiya, S. Asakura, K. Wakabayashi and K. Namba : J. Mol. Biol., 131 (1979) 725-742.
[11] I. Yamashita, K. Hasegawa, H. Suzuki, F. Vonderviszt, Y. Mimori-Kiyosue and K. Namba : Nature Struct. Biol., 5 (1998) 125-132.
[12] F. A. Samatey, K. Imada, F. Vonderviszt, Y. Shirakihara and K. Namba : J. Struct. Biol., 132 (2001) 106-111.
[13] F. A. Samatey, K. Imada, S. Nagashima, T. Kumasaka, M. Yamamoto, F. Vonderviszt and K. Namba : Nature 410 (2001) 331-337.
[14] S. Kanto, H. Okino, S.-I. Aizawa and S. Yamaguchi : J. Mol. Biol., 219 (1991) 471-480.
難波 啓一 NAMBA Keiichi
松下電器産業㈱ 先端技術研究所
科学技術振興事業団ERATOプロトニックナノマシンプロジェクト
〒619-0237 京都府相楽郡精華町光台3-4
TEL:0774-98-2543 FAX:0774-98-2575
e-mail:keiichi@crl.mei.co.jp
略歴:
1980年 大阪大学大学院 基礎工学研究科博士課程修了
1980年 学術振興会奨励研究員(大阪大学大学院 基礎工学研究科)
1981年 Brandeis大学 Rosenstiel 研究センター 研究員
1985年 Vanderbilt大学 分子生物学科 上級研究員
1986年 ERATO宝谷超分子柔構造プロジェクト グループリーダー
1992年 松下電器産業㈱ 国際研究所 リサーチディレクター
1997年 ERATOプロトニックナノマシンプロジェクト 総括責任者(兼任)
1999年 松下電器産業㈱ 先端技術研究所 リサーチディレクター
2001年 (財)高輝度光科学研究センター 構造生物グループ グループリーダー(兼任)
サマティ・ファデル SAMATEY Fadel, A.
科学技術振興事業団ERATOプロトニックナノマシンプロジェクト
〒619-0237 京都府相楽郡精華町光台3-4
TEL:0774-98-2543 FAX:0774-98-2575
e-mail:alexis@npn.jst.go.jp
略歴:
1992年 Joseph Fourier University(Grenoble, France)博士課程修了
1992年 IBPC-CNRA, Paris, Post-doctorate position
1994年 高エネルギー物理学研究所 フォトンファクトリー 研究員
1996年 松下電器産業㈱ 国際研究所 リサーチアソシエイト
1997年 ERATOプロトニックナノマシンプロジェクト 研究員
今田 勝巳 IMADA Katsumi
科学技術振興事業団ERATOプロトニックナノマシンプロジェクト
〒619-0237 京都府相楽郡精華町光台3-4
TEL:0774-98-2543 FAX:0774-98-2575
e-mail:kimada@npn.jst.go.jp
略歴:
1992年 大阪大学大学院 理学研究科博士課程修了
1992年 (財)高輝度光科学研究センター 企画調査部員
1993年 松下電器産業㈱ 国際研究所 リサーチアソシエイト
1997年 ERATOプロトニックナノマシンプロジェクト グループリーダー
長島 重広 NAGASHIMA Shigehiro
科学技術振興事業団ERATOプロトニックナノマシンプロジェクト
〒619-0237 京都府相楽郡精華町光台3-4
TEL:0774-98-2543 FAX:0774-98-2575
e-mail:nagasima@npn.jst.go.jp
略歴:
1993年 東京大学大学院 理学系研究科博士課程修了
1993年 理化学研究所 奨励研究生
1994年 理化学研究所 基礎科学特別研究員
1997年 ERATOプロトニックナノマシンプロジェクト 研究員








