Volume 06, No.3 Pages 223 - 226
4. 最近の研究から/FROM LATEST RESEARCH
活性化された筋収縮蛋白のX線繊維回折
X-ray fiber diffraction of activated contractile proteins in muscle
[1](財)高輝度光科学研究センター 放射光研究所 JASRI Research Sector、[2]総務省 通信総合研究所 関西先端研究センター Kansai Advanced Research Center, Communications Research Laboratory、[3](財)高輝度光科学研究センター 放射光研究所 JASRI Research Sector、[4]理化学研究所 播磨研究所 RIKEN Harima Institute
- Abstract
- X-ray diffraction/scattering techniques using synchrotron radiation offer a wide range of applications to biological sciences. Protein crystallography is the best-known example. The lesser-known but equally important applications include small-angle scattering and fiber diffraction. Unlike protein crystallography, these techniques can be applied to proteins or protein assemblies functioning under physiological conditions. Here we briefly describe what can be achieved by using the fiber diffraction technique using synchrotron radiation, with an example of our own recent results on the contractile proteins in muscle fiber.
1.はじめに
シンクロトロン放射光によるX線回折・散乱法の生物試料への応用といえば、だれでも蛋白の結晶構造解析を連想するであろう。確かにSPring-8の利用研究課題数を見ても蛋白の結晶構造解析が大きな割合を占めているし、またポストゲノムプロジェクトの元でこの分野のさらなる発展が期待されているのは周知のとおりである。しかしX線回折・散乱法の応用にはその他に小角散乱・繊維回折という大きな分野がある。今回とくに繊維回折について解説するが、この手法の特長は何であろうか。
結晶構造解析の特長は、文字どおり極めて規則的に配列した蛋白分子の集合体(通常は単一の分子種か、少数の分子種の複合体)を対象とすることで、原子レベルの空間分解能が得られる。一方で蛋白分子が結晶内で置かれている環境は、通常生理的条件とは大きく異なっている。それに対して繊維回折の場合は、空間分解能はナノメートル以下で、原子レベルの解像力を得るのは難しい。また繊維状の集合体を形成する蛋白に対象が限定されるのも欠点である。しかし最大の特長は生理的条件下で機能する蛋白の構造を調べることができる点jで、生きている組織や細胞から直接回折像を記録することも可能である。多種の分子の集合体が解析の対象にされることも多い。分子配列の乱れ(disorder)は一般的には構造解析上の障害とみなされるが、生体内の蛋白分子集合体の場合にはそれが機能上重要な意味を持つことがあり、その評価が繊維回折では1つのポイントとなる。
現在までに用いられた繊維回折実験の対象には、古典的な例であるDNA、筋肉、コラゲン、原核生物の鞭毛、変わったところではクモの糸などがある。ここでは筋肉を用いた実験の例として、我々の最近の研究成果[1][1]H. Iwamoto, K. Oiwa, T. Suzuki and T. Fujisawa : J. Mol. Biol., 305 (2001) 863-874.を紹介する。
2.筋肉の収縮機構
脊椎動物の骨格筋は直径50〜100マイクロメートル程度の筋細胞が多数集まってできている。個々の筋細胞には収縮装置と呼ばれる収縮蛋白の集合体がぎっしり詰まっていると考えてよい。この収縮装置の機能上の最小単位はサルコメア(Fig. 1a)と呼ばれる構造で、収縮装置はこれが多数直列につながって構成されている。サルコメアの中で最も重要な構造はアクチン、ミオシンという収縮蛋白が重合してできた2種類のフィラメントで、筋収縮はこの2種のフィラメントが互いに滑り合うことで生じる(Fig.1b)。アクチンは分子量約4万の球状蛋白である。ミオシンは6個のサブユニットからなる分子量約40万の蛋白であるが、全体としては2個のやや球状の頭部と、α-ヘリックスのコイルドコイル構造を持つ尾部に分けることができる(Fig. 1c)。ミオシン頭部にはアクチン結合部位とATP結合部位がある。一方尾部はフィラメントの形成に関与する。ミオシン頭部はアクチンに結合し、ATP加水分解時に放出される化学エネルギーを利用した首振り運動を行うことで収縮力を発生するといわれてきた(首振り説[2][2]H. E. Huxley : Science, 164 (1969) 1356-1366.)。最近ミオシン頭部の結晶構造が解かれ[3][3]I. Rayment, W.R. Rypniewski, B. Schmidt-Base, R. Smith, D.R. Tomchick, M.M. Benning, D. A. Winkelmann,G. Wesenberg and H. M. Holden : Science, 261 (1993) 50-58.、その結果ミオシン頭部はさらにアクチン、ATPの結合部位を持つモータードメインと、1本のα-ヘリックスの周りに2本の軽鎖(サブユニット)をつけたレバーアームからなることが示された(Fig. 1d)。そしてミオシン頭部全体ではなくて、アクチンに立体特異的に固定されたモータードメインに対してレバーアームのみが首を振ることで収縮張力が発生すると考えられるようになった(Fig. 1e)。
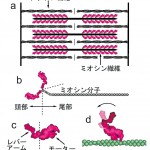
Fig. 1 Structure of the contractile machinery of muscle.
(a), structure of a sarcomere consisting of two sets of filaments (myosin and actin). (b), mechanism of contraction, which is caused by the sliding of the filaments relative to each other. (c), structure of a single myosin molecule. (d), structure of a myosin head, consisting of motor and lever arm domains. (e), conventional explanation of the mechanism of contractile force production, caused by the swing of the lever arm domain on the motor domain bound to an actin filament in a stereospecific manner.
3.筋肉のX線回折
筋肉を構成する2種の収縮蛋白はそれぞれがフィラメントを形成し、その中で個々の蛋白分子はらせん状に配列している。このらせんの周期はアクチンとミオシンで異なるので、X線回折像には2種のらせん周期に由来する反射が現れる。またフィラメントはサルコメアの断面中で六角格子状に配列しているので、この配列に由来する反射も出現する。ここで取り上げるのはアクチンのらせんに由来する反射である。
連続らせんのX線回折像(フーリエ変換像)は、らせんの軸に沿って原点から遠ざかるにつれて次数の上がる一連の整数次のベッセル関数となり、各次のベッセル関数はらせんの軸に直角な層線反射として現れる。らせん状に並んだ分子(不連続らせん)のX線回折像は、この一連のベッセル関数と分子(モノマー)間隔の逆数を周期とする周期関数のたたみ込みになる。アクチンのらせんは、らせんの周期がモノマーの間隔の整数倍にならないnonintegral helixで、モノマーの間隔が約2.7ナノメートル、13/6らせん(6らせん周期中に13モノマー)あるいは28/13らせんとして表現される。結果として得られる回折像はFig. 2の様であり、5.9と5.1ナノメートルの周期に相当する層線反射の強度は特に高い。
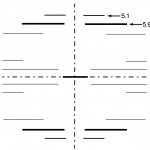
Fig. 2 Schematic diagram of the diffraction pattern obtained from actin filaments. The pattern consists of a series of layer line reflections, of which the ones indexed to the periods of 1/5.9 nm-1 and 1/5.1 nm-1 (arrows) are the strongest.
4.実験方法と結果
X線回折の試料として、十分な信号を得るため従来は筋肉をまるごと(全筋)用いていた。SPring-8のアンジュレータ光を用いれば単離した直径50マイクロメートル程度の筋細胞30本程度を用いて、わずか1秒の露光で全筋からのものに匹敵する画質の回折像を記録することができる。実験はBL45XU小角散乱ステーション[4][4]T. Fujisawa, K. Inoue, T. Oka, H. Iwamoto, T. Uruga, T. Kumasaka, Y. Inoko, N. Yagi, M. Yamamoto and T. Ueki : J. Appl. Cryst., 33 (2000) 797-800.で行い、用いた検出器はイメージインテンシファイヤと冷却CCDカメラ(1000×1018画素)の組み合わせである。
Fig. 3aは、ウサギの骨格筋細胞をFig. 1bとは逆方向に引き伸ばし、ミオシンとアクチンのフィラメントの重なり合いを殆どなくしたもののX線回折像である。この状態ではアクチンフィラメントのまわりにミオシン頭部がないので、裸のアクチンフィラメントのX線回折像が記録できる(Fig. 2に相当)。Fig. 3aではその他、ミオシンフィラメントのらせんに由来する反射も弱く現れている。用いた筋細胞は、予め界面活性剤で細胞膜を取り除いてある。こうすることで収縮蛋白の溶液環境を自由にコントロールできるほか、拡散によって外来の蛋白などを細胞内に導入することもできる。
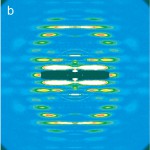
Fig. 3 Diffraction patterns recorded from an array of overstretched single rabbit skeletal muscle fibers.
(a), pattern recorded in the absence of exogenously introduced myosin head. Layer lines typical of bare actin filaments are observed. (b), pattern recorded after myosin heads had been exogenously introduced in the absence of ATP. The actin-based layer lines are strongly enhanced because of the stereospecific labeling of the actin filaments by the myosin heads. (c), pattern recorded in the presence of ATP after exogenously introduced myosin heads had been cross-linked. The actin-based layer lines are as weak as those of bare actin filaments and there is little sign of stereospecific binding.
Fig. 3bは、上の筋細胞に尾部から酵素処理によって切り離したミオシン頭部を、ATP非存在下で細胞内に導入したもののX線回折像である。ATPが存在しないと、ミオシン頭部はアクチンに立体特異的に強く結合する(死後硬直の状態)。このとき、ミオシン頭部はモータードメインからレバーアームの先端に至るまで厳密にアクチンのらせん周期に従って配列するので、アクチンの周期に由来する反射はいずれも著しく増強される。
それでは、硬直状態ではなくて収縮時(ATP存在下)には、ミオシン頭部はどのような状態でアクチンと相互作用しているのであろうか?困ったことに、ATPにはミオシンの反応基質として働くほかにミオシン頭部をアクチンから解離させる作用もある。従ってFig. 3bの筋細胞にATPを加えればミオシン頭部はアクチンから外れ、拡散により失われてしまう。そこで、EDCと呼ばれる架橋試薬を用いてミオシン頭部がアクチンから解離しないようにしておく。こうすることで収縮時に相当するX線回折像を記録できるばかりでなく、アクチンに結合したミオシン頭部の数を常に一定にできる利点もある。これはX線回折像を解釈する上で極めて重要である。実はEDCで架橋したとき、ミオシン頭部のATP分解活性は生筋の収縮時よりもはるかに高い。これはミオシン頭部がアクチンから解離しないので、反応論的にはミオシン頭部に対するアクチン濃度を無限大に外挿したATP分解速度(Vmax)が得られるためと解釈されている[5][5]D. Mornet, R. Bertrand, P. Pantel, E. Audemard and R. Kassab : Nature, 292 (1981) 301-306.。
このようにしてミオシン頭部が最大限に活性化されたときのX線回折像がFig. 3cである。従来の説明に従えば、このときレバーアームは首振り運動をしているとはいえ、バルキーなモータードメインは依然アクチンに立体特異的に結合している。従って硬直状態(Fig. 3b)でみられたアクチン層線反射の著しい増強は、かなりの割合で残ると予想される。しかし実際に観察された回折像(Fig. 3c)は裸のアクチンのもの(Fig. 3a)によく似ており、特に5.9ナノメートルの層線反射の強度分布は全く区別がつかなかった。立体特異的結合の生じている形跡は殆どない。
以上の結果は、最大限に活性化されたときにレバーアームだけでなく、ミオシン頭部全体がアクチン上で大きく揺動していることを示している。モデル計算によると、ミオシン頭部はアクチンの周期に従う部分が殆どなくなるくらい激しく揺動している必要がある。実験結果はレバーアームの首振り運動の存在を否定するものではないが、収縮力発生機構はそれだけで説明できるほど単純ではないことを示している。立体特異的結合はエネルギー的に安定な状態で、それに近づこうとする傾向が収縮力発生の重要な要素であっても不思議ではない。それにもかかわらず立体特異的結合がみられないのは、立体特異的結合が形成される前にATP分解反応が先に進んでしまうためと想像される。このようにミオシン頭部を常にエネルギー的に不安定な状態に置くことが効率的な収縮力発生を保証する仕組みなのかもしれない。
5.意義
以上のように、繊維回折法によって機能している生体分子集合体の構造解析が可能である。この中には生体分子の立体構造そのものの決定の他に、分子配列の乱れ(disorder)から生体分子の動態を知ることも含まれる。本研究ではその「乱れ」がまさに1つのキーワードになっていて、その解析から筋収縮機構の本質にかかわる情報が得られている。生きた試料からそのまま繊維回折像を得るのも1つの研究法であるが、本研究ではそれ以上に種々の操作を試料に加えている。例えば外来のミオシン頭部を細胞内に拡散させ、さらにそれをアクチンに化学架橋している。このとき筋細胞内のアクチンは、外来のミオシン頭部を規則的に配列させるための定規として使われていると言えなくもない。従って拡散させるミオシン頭部は起源の異なるものでも構わない。例えば家族性拡張心筋症の原因となる心筋の変異ミオシンはもちろん、致死性となるような重度の変異を持ったミオシンでもインビトロで発現・精製ができれば同様に骨格筋細胞中に拡散させ、化学架橋してその挙動を繊維回折法により解析することができるであろう。さらに各種の細胞に分布するが、機能が十分には解明されていない各種の非筋ミオシンの構造・機能解析にも本手法は応用できるであろう。このように本研究で用いられた手法は基礎研究のみならず心筋症の発症機構の研究など、臨床的応用研究にも役立つことが期待される。
謝 辞
本研究の出版に当たり有益なご助言を戴いた当財団放射光研究所の八木直人博士、ならびに研究を通じて技術支援を受けた劉 如漪氏に感謝する。本研究は、先端的共同利用施設利用促進事業(科学技術振興事業団)の一環として行われた。
参考文献
[1]H. Iwamoto, K. Oiwa, T. Suzuki and T. Fujisawa : J. Mol. Biol., 305 (2001) 863-874.
[2]H. E. Huxley : Science, 164 (1969) 1356-1366.
[3]I. Rayment, W.R. Rypniewski, B. Schmidt-Base, R. Smith, D.R. Tomchick, M.M. Benning, D. A. Winkelmann,G. Wesenberg and H. M. Holden : Science, 261 (1993) 50-58.
[4]T. Fujisawa, K. Inoue, T. Oka, H. Iwamoto, T. Uruga, T. Kumasaka, Y. Inoko, N. Yagi, M. Yamamoto and T. Ueki : J. Appl. Cryst., 33 (2000) 797-800.
[5]D. Mornet, R. Bertrand, P. Pantel, E. Audemard and R. Kassab : Nature, 292 (1981) 301-306.
岩本 裕之 IWAMOTO Hiroyuki
(財)高輝度光科学研究センター 放射光研究所
〒679-5198 兵庫県佐用郡三日月町光都1-1-1
TEL:0791-58-0803 ext. 3884 FAX:0791-58-0830
e-mail:iwamoto@spring8.or.jp
大岩 和弘 OIWA Kazuhiro
総務省通信総合研究所 関西先端研究センター
〒651-2401 神戸市西区岩岡町岩岡588-2
TEL:078-969-2234 FAX:078-969-2239
e-mail:oiwa@crl.go.jp
鈴木 拓 SUZUKI Takuya
(財)高輝度光科学研究センター 放射光研究所
〒679-5198 兵庫県佐用郡三日月町光都1-1-1
現:北九州市立大学 国際環境工学部
藤澤 哲郎 FUJISAWA Tetsuro
理化学研究所 播磨研究所
〒679-5148 兵庫県佐用郡三日月町光都1-1-1
TEL:0791-58-2822 FAX:0791-58-1844
e-mail:fujisawa@spring8.or.jp








