Volume 06, No.3 Pages 218 - 222
4. 最近の研究から/FROM LATEST RESEARCH
高等植物の電子伝達複合体の立体構造
Structure of the plant electron transfer complex from maize leaf
大阪大学 蛋白質研究所 Institute for Protein Research, Osaka University
- Abstract
- Photosynthetic electron transfer is a key reaction, which makes green plants get the reductive power to grow. About 20 years ago, the first structure of a plant-type ferredoxin, a photosynthetic electron carrier protein, has bee reported. Many biochemists and plant physiologists have been studying the interaction site of ferredoxin based on this 3D structure. After the crystal structure of ferredoxin-NADP+ reductase, a partner protein of ferredoxin, has been reported in 1991, further experiments, including computer modeling and continuous mutational experiments, of this protein-protein interaction have been done extensively. Here we determined the first 3D structure of this electron transfer complex from maize leaf. We think that the structural information of this complex is consistent with previous biochemical and biophysical reports and conclude the precise interaction model.
1.はじめに
植物の無機物から有機物を合成する能力は、極めて重要な生体反応である。炭素、窒素および硫黄など無機物の大部分は酸化的状態で存在し、生体が糖やアミノ酸のような有機体に変換するには還元同化しなければならない。この同化反応には多くの還元力が必要で、NO3−がNH4+に還元される過程で(亜硝酸還元酵素)6電子、SO42−がS2−に還元される過程(亜硫酸還元酵素)で6電子、グルタミンとα−ケトグルタル酸から2分子のグルタミン酸を生じる反応(グルタミン酸合成酵素)で2電子が供給されなければ全体の反応は進行しない。光合成を行うラン藻を含めた藻類や高等植物では、光合成明反応の水分子の開裂により生じる電子をこれらの同化反応に用いている。光合成電子伝達反応は、原核細胞のチラコイドや真核細胞の葉緑体チラコイドで行われ、光還元力は上記の同化反応を触媒する酵素群に渡されるが、この電子伝達にはフェレドキシン(Fd)と呼ばれる電子キャリアー蛋白質が働いている。高等植物やラン藻を含めた光合成生物に広く見出されるFdは植物型Fdとよばれ、補欠分子族として2原子ずつの非ヘム鉄と無機硫黄からなる[2Fe-2S]クラスターを酸化還元中心として持っている。真核細胞内で、Fdは葉緑体ストローマに局在し光合成電子伝達系の光化学系Ⅰから電子を受け取り、Fd-NADP+還元酵素など上述のFd依存酵素群へ、亜硫酸還元、亜硝酸還元、グルタミン酸合成に必要な電子をわたしている。さらにFdは、これら還元同化系の酵素以外にも多くのFd依存性の酸化還元反応を進行させている[1]。以上のように光合成代謝反応では単一のFdが多くの酵素蛋白質に電子を伝達しているので、Fdを中心とした電子分配が光合成を統御するステップとして注目を集めている。
電子伝達反応は光合成、呼吸、薬物代謝など生体の重要な代謝系をなす反応過程である。電子伝達は多くの場合、蛋白質に取り込まれている遷移金属イオンや有機補欠分子族が酸化還元中心となっている。異なる蛋白質の酸化還元中心の間で、高い効率と特異性が要求され、しかも速い速度で電子を伝達させるには、酸化還元中心の電位、蛋白質間相互作用、電子移動の距離などが制御要因として考えられている。いくつかの生体酸化還元反応系では、これらの諸要因を明らかにしようとする研究が盛んに行われている。本稿では光合成の電子伝達蛋白質であるFdとFd依存性酵素であるFd-NADP+還元酵素との複合体の結晶構造を基に、電子伝達のメカニズムと生理的役割の関係について紹介する。
2.トウモロコシの葉由来FdとFd-NADP+還元酵素
Ⅰ.複合体の結晶構造
植物型Fdは分子量約12Kの酸性蛋白質で、これまでに様々な生物種に存在するFd[2〜7]の立体構造が報告されている。また、Fd-NADP+還元酵素(FNR)についても3種の立体構造[8〜10]が報告されており、立体構造を基にした相互作用領域を明らかにする為の研究が進められてきた。生化学的には化学修飾、部位特異的変異の導入や限定分解等の手法により、Fd、FNR双方の相互作用領域が同定されている。また、構造生物学的には、FdとFNRの立体構造上の静電ポテンシャルを基に、複合体モデルが提唱されていた[11]。しかしながら、蛋白質間相互作用や分子間電子伝達のメカニズムをより直接的に研究する為には、FdとFd依存性酵素複合体の立体構造が必要不可欠であり、いくつかのグループで複合体の結晶化が試みられてきた。一般にFdとFd依存酵素間の電子伝達は静電的相互作用による蛋白質・蛋白質複合体形成により行われると考えられている。そこで我々はトウモロコシ葉緑体中に存在するFdとFNRの複合体結晶化を試みた。静電的な複合体状態を保ったまま結晶化するために、PEGを中心に結晶化条件の検索を進めたところ、18%(w/v)PEG6000を沈殿剤とした時に、薄茶色の針状晶を得た。この結晶を用いてSPring-8 BL41XUにおいてX線回折強度データの収集を行い、その立体構造を2.59Å分解能で決定することに成功した(Fig. 1)[12]。
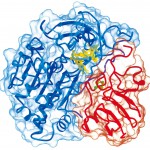
Fig. 1 Crystal structure of the electron transfer complex between Ferredoxin and Ferredoxin-NADP+ reductase from maize leaf.
Ⅱ.相互作用領域
結晶中のFdとFNR複合体は1対1で複合体を形成していた。FNRの酸化還元中心であるFADと、Fdの酸化還元中心である[2Fe-2S]クラスターの鉄原子は、複合体構造中で大変近い位置関係にあった。FADのC8M炭素とFdのFE1鉄までの距離が6.0Å、FADのC8M炭素と[2Fe-2S]クラスターへの配位子であるC44のSG硫黄までの距離が4.1Åであった(Fig. 2)。[2Fe-2S]クラスターのFE1鉄原子は、直接酸化還元に関与している原子であり、これらの距離は量子力学的に電子伝達が行われると考えるのに十分な近さであった。FdおよびFNR双方から合計47残基がFdとFNRの分子境界にある会合領域に位置しており、その会合領域の面積は約800Å2であった。これはFNRの全分子表面に対し約5%、Fdの分子表面に対しては約15%に相当していた。境界面に存在する原子の約半分は疎水性であり、Fdの5残基(Y37、C39、A41、C44およびY63)とFNRの4残基(V92、L94、V151およびV313)が双方の酸化還元中心近傍に疎水的な環境を作り出し、補欠分子族間で直接電子伝達されるのに適した環境を作り出していた(Fig. 2)。
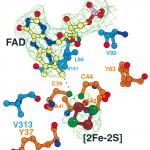
Fig. 2 Active site structure of the electron transfer complex.
Ⅲ.塩橋構造とFdの構造変化
FdとFNRの会合領域中には21残基の電荷を持ったアミノ酸が存在していた。これらのアミノ酸残基は酸化還元中心を取り巻く疎水的な領域の外側に位置し、そのうち5対のアミノ酸が塩橋を形成していた(Fig. 3)。これらの静電的な相互作用が複合体の安定化に寄与しており、FdとFNRの相対的立体配置決定の主要因であった。FdとFNR間の静電的相互作用に関しては、部位特異的変異法や化学修飾法により多くのグループが関係するアミノ酸の同定を行ってきた。まとめると、FdのD26、E29、E30、D34、D61、D65およびD66、FNRのK33、K88、K91、K88およびK304があげられる(残基番号は全て対応するトウモロコシでの番号)。これらのアミノ酸は、すべて今回の複合体構造中で二つの蛋白質間にある会合領域に位置していた。しかしながら、FdのR40とFNRのE154による塩橋の形成は、全く予想されていないものであった。おそらく、Fdの酸性残基とFNRの塩基性残基が静電的相互作用に寄与するとの考え方のみが積み重なって来た為、各々に逆の電荷のアミノ酸が関与していると考えにくかったためであろう。高等植物をはじめとする多くの光合成生物のFdでは、複合体を形成していない単体状態ではR40の側鎖はE29の側鎖と分子内に塩橋を形成し、この保存された分子内塩橋は[2Fe-2S]クラスターを取り囲んでいるループ構造を安定化している[5、13]。このループ構造が[2Fe-2S]クラスターの酸化還元電位を約−400mVと大変低くする環境を作り出していると考えられている。今回の複合体構造中ではR40とE29の分子内塩橋が開裂し、R40はFNRのE154と、E29はFNRのK304と新たに分子間に塩橋を形成していた。この塩橋の架け替えが、FNRとの複合体形成に伴いFdが持つ[2Fe-2S]クラスターの酸化還元電位がさらに約90mV低下するという従来の報告に対応する構造変化であると考えられる。
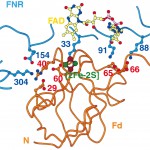
Fig. 3 Electrostatic interactions within the electron transfer complex.
Ⅳ.複合体形成に伴うFNRの構造変化
電子伝達複合体の結晶構造に加え、Fdが結合していない状態でのトウモロコシFNRの立体構造も2.2Å分解能で決定した[12]。FNRはN末端側に存在するFAD結合ドメインとC末端側に存在するNADP+結合ドメインから成り、両ドメイン間に挟まれる形でFADのイソアロキサジン環が位置している[8]。Fdが結合していないFNRの立体構造と複合体構造中でFdが結合したFNRの立体構造を比較したところ、興味深い構造変化を確認することが出来た。両FNRの立体構造の重ね合わせ図からも明らかなように、N末端ドメインに存在するループ構造(G89〜K91)が大きく変化していた(Fig. 4)。この領域にあるFNRのK88とK91がFdと塩橋を形成する為に主鎖構造を変化させていると考えられる。エンドウ豆のFNRにおいて、基質であるNADP+はFNRのC末端ドメインに結合し、NADP+のニコチン環部分がFADのイソアロキサジン環に相互作用していることが報告されていたが[10]、今回Fdと複合体を形成することによってFNRのC末端ドメインが、全体的に動いていることも初めて明らかになった。
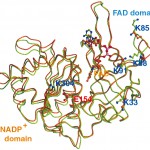
Fig. 4 Superimposed model of the Fd-bound and Fd-free FNRs.
複合体形成に伴うE312の動きも重要な構造変化である。FNRのE312はFAD近傍に存在する保存残基でFNRの活性中心に位置し、他のアミノ酸に置換するとFd間の電子伝達に著しい影響を及ぼすことが報告されている[14]。また、このE312の側鎖はFNR内部にあるS96と共にNADP(H)のニコチン環と水素結合することが報告されている[10]。Fdが結合していないFNRと複合体構造中のFNRの構造を比較してみると、フリー状態のFNRではS96のOG酸素と5.6Å離れていたE312のOE1酸素が、FdとFNRが複合体になることによりS96のOG酸素の方へ約2Å近づいて水素結合可能な距離に移動していた(Fig. 5)。このE312側鎖の動きは、FNRがFdと結合することによってFdのS38のカルボニル酸素と立体障害を起こすことにより分子内部へと押し込まれた形になっている。FNR内部に押し込まれたE312はS96と共に、NADP(H)がFADと特定の相互作用をする為に必要な配置へと構造変化していると考えられる。すなわち、複合体形成によりFdがFNRの表面にあったE312という“プッシュボタン”を押して、FNRの活性中心がNADP(H)と反応するのに好都合な状況を作り出したと考えることができる。
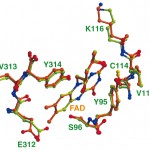
Fig. 5 Comparison of the active site structures of FNRs.
3.他の組織に存在するFdとFd依存性酵素の相互作用
高等植物では根のような非光合成組織にもFdとFNRが存在し、今回複合体構造が解かれた葉由来の分子種とは一次構造が異なるアイソザイムとして存在している。光合成型および非光合成型の2種類のFNRのアミノ酸配列を、配列が判明しているいくつかの植物種間で比較したところ、今回FNRがFdと相互作用する際に重要なK88、K91およびE154は、光合成型FNRにのみ保存されており、根などの非光合成組織に存在しているFNRでは、これらのアミノ酸は全て電荷を持たないアミノ酸に置換されていた。そして、トウモロコシの根FNRについて、光合成型と非光合成型のFdとの分子間相互作用力を検討したところ、葉緑体中の光合成型Fd(FdⅠ)より根プラスチド中の非光合成型Fd(FdⅢ)との方が、約10倍高い結合定数を持つことが明らかになった[15]。このことから光合成型と非光合成型のペアは、おそらく異なった様式で相互作用していることが予想される。すなわち高等植物では器官や組織によって、アイソザイムを使い分けて、それぞれ異なった分子間相互作用により酸化還元の代謝反応を制御している可能性があると言えるであろう。現在立体構造の面からこの統御機構を解明するべく、トウモロコシの根に存在するFdⅢとroot-FNRとの複合体結晶構造を解析し、電子伝達複合体の構造とその生理的役割との相関を解析しているところである。
おわりに
FdおよびFNR単体の立体構造が約10年前に解明されてからも、電子伝達複合体の形成に関して決定的な実験結果は報告されていなかった。本稿で紹介したトウモロコシ葉緑体中に存在するFdとFNRの複合体立体構造は、継続的に議論されてきた複合体の形成様式に詳細な構造情報を与えると共に、電子伝達メカニズムについても単体の構造解析からは判らない新規な知見を提供したと考えている。冒頭で紹介したFdに依存した酵素群による種々の酸化還元反応は、一つの電子伝達蛋白質と多数の酵素による相互作用ネットワークであり、それぞれの複合体立体構造と同化反応の統御メカニズムとの相関に興味が持たれる。今後、窒素同化、硫黄同化などに関与している亜硝酸還元酵素、亜硫酸還元酵素などとFdとの複合体結晶を調整し、同化酵素に関する統一的な構造研究を進展させていきたいと考えている。
最後に、本研究は大阪大学蛋白質研究所酵素反応部門、長谷俊治研究室との共同研究で行われたものであり、本研究の主なX線回折実験は大型放射光施設(SPring-8)を利用して行われました。関係諸先生方に深く感謝いたします。
また、本研究は文部省科学研究費補助金、科学技術振興事業団の援助のもとに行われました。
参考文献
[1]Blankenship, R.E. : Nature Struct. Biol., 8 (2001) 94-95.
[2]Tsukihara, T., Fukuyama, K., Nakamura, M., Katsube, Y., Tanaka, N., Kakudo, M., Wada, K., Hase, T., Matsubara, H. : J. Biochem., 90 (1981) 1763-1773.
[3]Tsukihara, T., Fukuyama, K., Mizushima, M., Harioka, T., Kusunoki, M., Katsube, Y., Hase, T., Matsubara, H. : J. Mol. Biol., 216 (1990) 399-410.
[4]Rypniewdki, W.R., Breiter, D.R., Benning, M.M., Wesenberg, G., Oh, B.-H., Markley, J.L., Rayment, I., Holden, H.M. : Biochemistry, 30 (1991) 4126-4131.
[5]Jacobson, B.L., Chae, Y.K., Markely, J.L., Rayment, I., Holden, H.M. : Biochemistry, 32 (1993) 6788-6793.
[6]Ikemizu, S., Bando, M., Sato, T., Morimoto, Y., Tsukihara, T., Fukuyama, K. : Acta Cryst. D50 (1994) 167-174.
[7]Binda, C., Coda, A., Aliverti, A., Zanetti, G., Mattevi, A. : Acta Cryst, D54 (1998) 1353-1358.
[8]Karplus, P.A., Daniels, M.J., Herriott, J.R. : Science, 251 (1991) 60-66.
[9]Serre, L., Vellieux, F.M.D., Medina, M., Gomez-Moreno, C., Fontecilla-Camps, J.C., Frey, M. : J. Mol. Biol., 263 (1996) 20-39.
[10]Deng, Z., Aliverti, A., Zanetti, G., Arakaki, A.K., Ottado, J., Orellano, E.G., Calcaterra, N.B., Ceccarelli, E.A., Carrillo, N., Karplus, P.A. : Nature Struct. Biol., 6 (1999) 847-853.
[11]Fukuyama, K., Ueki, N., Nakamura, H., Tsukihara, T., Matsubara, H. : J. Biochem., 117 (1995) 1017-1023.
[12]Kurisu, G., Kusunoki, M., Katoh, E., Yamazaki, T., Teshima, K., Onda, Y., Kimata-Ariga, Y., Hase, T. : Nature Struct. Biol., 8 (2001) 117-121.
[13]Holden, H.M., Jacobson, B.L., Hurley, J.K., Tollin, G., Oh, B-H., Skjeldal, L., Chae, Y.K., Cheng, H., Xia, B., Markley, J.L. : J. Bioenerg. Biomembr., 26 (1994) 67-88.
[14]Aliverti, A., Deng, Z., Ravasi, D., Piubelli, L., Karplus, P.A., Zanetti, G. : J. Biol. Chem., 273 (1998) 34008-34015.
[15]Onda, Y., Matsumura, T., Kimata-Ariga, Y., Sakakibara, H., Sugiyama, T., Hase, T. : Plant Physiol., 123 (2000) 1037-1045.
栗栖 源嗣 KURISU Genji
大阪大学 蛋白質研究所 生体分子解析研究センター
〒565-0871 吹田市山田丘3-2
TEL:06-6879-8634 FAX:06-6879-8636
e-mail:kurisu@protein.osaka-u.ac.jp
略歴:
1997年 大阪大学大学院 工学研究科 博士課程修了
1997年 大阪大学 蛋白質研究所 助手
楠木 正巳 KUSUNOKI Masami
大阪大学 蛋白質研究所 生体分子解析研究センター
〒565-0871 吹田市山田丘3-2
TEL:06-6879-8634 FAX:06-6879-8636
e-mail:kusunoki@protein.osaka-u.ac.jp
略歴:
1980年 大阪大学大学院 理学研究科 博士課程修了
1980年 大阪大学 蛋白質研究所 助手
1995年 大阪大学 蛋白質研究所 助教授








