Volume 05, No.6 Pages 394 - 400
3. 最近の研究から/FROM LATEST RESEARCH
G−タンパク質共役受容体ロドプシンの立体構造
Crystal Structure of a G-Protein Coupled Receptor : Bovine Rhodopsin
理化学研究所 播磨研究所 RIKEN Harima Institute
- Abstract
- The crystal structure of bovine rhodopsin, a G-protein coupled receptor was solved by MAD phasing using 3.3Å resolution MAD data set collected at SPring-8 BL45XU, and followed by the structural refinement at 2.8Åresolution using a twinned crystal data collected at APS 19-ID.
1.はじめに
G-タンパク質共役受容体(GPCR)は、光の受容体であるロドプシンをはじめとして、におい、ホルモン、また、アンジオテンシンⅡやエンドセリンなどのペプチドホルモン、プロスタグランジンなどの脂質メディエーター、脳内などで働く神経伝達物質などの受容体、そしてHIVウィルスがとりつく受容体CCR5を含むケモカイン受容体など、生物学的重要性だけでなく、多くの医薬品開発ターゲットでもある[1][1]“Receptor Classification”ed. D. G Trist, P. P. A. Humphrey, P. Leff and N. P. Shankley:Ann. N.Y. Acad. Sci. vol. 812(1997).。細胞外情報の受け手としてのGPCRはこうした外部環境情報を最初に受容する分子スイッチとして多岐にわたる外部信号を区別して認識するが、外部刺激によりGPCRの分子スイッチが入り、わずか数種類しかないG−タンパク質にその信号を受け渡し、引き続く一連の細胞内信号伝達系のカスケードによりクロストークしながら信号増幅あるいは信号を抑えて細胞の運命を変えたり、または細胞が受容した信号に応じた機能を果たす。つまり、その分子スイッチ機構は、それぞれのGPCRにおいて不活性型から活性型へと自ら立体構造変化して、G-タンパク質に結合したGDPを解離させ、代わりにGTPを結合した活性型G-タンパク質へと信号を伝え、受容した外部環境情報を細胞内信号伝達カスケードに受け渡すという同一の分子機構を担っている。その共通した七回膜貫通型構造による普遍的な分子機構であると信じられている。
2.ロドプシン
GPCRの中でロドプシンは、視覚というもっとも豊かな情報処理器官の光受容体分子として、網膜に並んだ桿体中に積層したディスクの脂質2重膜上にある。ロドプシンは光量子の受け手である視物質で、光を吸収して活性化に伴い色(吸収スペクトル)が変わるので、微量な試料で高速反応まで物理測定が比較的容易である。さらにGPCRのモデルとしても広範に研究されており、H. G. Khorana[2][2]J. Klein-Seetharaman, E. V. Getmanova, M. C. Loewen, P. J. Reeves and H. G. Khorana, : Proc. Natl. Acad. Sci. USA 96(1999)13744.たちによる系統的変異体研究をはじめとして、数千に上る研究成果が集積されてきた。
ロドプシンにはじまる視覚はきわめて感度が高く、5つ程度の光子を感じることができるという。光によって活性化されたロドプシンの光信号は細胞質側にあるG-タンパク質、トランスデューシン(Gt)へ伝えられる。Gtはα、β、γからなる3量体であり、GDPを結合した不活性型のGtαがGtβγ複合体とさらに複合体を形成している。光により活性型となったロドプシンにより、GDPがはずされ、そこにGTPが結合して活性型となったGtα*が遊離される。この活性型Gtα*はcGMPホスホジエステラーゼ(PDE)と結合してこの酵素を活性化する。その結果、細胞内cGMPレベルが下がって、cGMP依存Na+チャンネルが閉じるというカスケードへつながっていく。桿体から視神経を介して電気スパイクとして脳に伝える一連の複雑で精緻な視覚反応はロドプシンによる光受容にはじまり、高いS/N比と感度で光を“みる”ことができる。
ロドプシン分子は、クロモフォアとしてビタミンAの誘導体・レチナールを含み、ロドプシンの蛋白部分であるオプシンに結合している。光受容過程で、不活性型である11-シス-レチナールは、吸収した光エネルギーにより全トランス型へと立体構造が変化することで、分子スイッチのトリガーとなる。ロドプシンの光による活性化過程には複数の段階が存在する。まずは、レチナールが光を吸収したすぐ後に生じるレチナール自身の光異性化反応であり、いくつかのステップを経てピコ秒程度でMI状態となり、さらにゆっくりとミリ秒程度で活性型ロドプシンであるMⅡ状態となる。最後は、MⅢ状態となり、全トランス-レチナールがオプシンからはずれていく。オプシンはそのままですでに活性型であり、このオプシンに11-シス-レチナールを加えるだけで、自律的に再構成されて赤色をした不活性型のロドプシンが再構成できる。ロドプシンを含む膜タンパク質は普通に使える大腸菌などでの大量発現法がまだ確立していないので、ウシなどの網膜から均質な試料を比較的大量に得られやすいロドプシンはあらゆる面から研究が進められてきた数少ないGPCRである。立体構造決定の試みもいくつかのグループによって精力的にすすめられており、結晶化の試みもすでにいくつかの報告があるが、その実用上の重要性から、原子レベルでの立体構造解析がもっとも期待されてきたタンパク質のひとつである。しかしながら、これまでのところ電子顕微鏡回折によってもっとも分解能のよい方向で5Å程度での概形が知られているのみであった[3][3]P. Herzyk and R. E. Hubbard:J. Mol. Biol. 281(1998)741.。
3.ウシ・ロドプシンの結晶構造解析[4][4]K. Palczewski, T. Kumasaka, T. Hori, C. A. Behnke, H. Motoshima, B. A. Fox, I. L. Trong, D. C. Teller, T. Okada, R. E. Stenkamp, M. Yamamoto and M. Miyano:Science 289(2000)739.
ワシントン大学のグループとともに、T. Okadaらが結晶化したウシ・ロドプシン結晶を用いて構造解析を行った[5][5]T. Okada, I. Le Trong, B. A. Fox, C. A. Behnke, R. E. Stenkamp and K. Palczewski:J. Struct. Biol. 130(2000)73.。得られた結晶は結晶格子のa,b軸長が容易に変化すること、双晶になりやすいなど多重重原子同型置換法では解析が困難であった。そこで、MADデータ測定に特化したトリクロメーターを備えたSPring-8理研構造生物ビームラインⅠ (BL45XU)を使って、水銀誘導体のMADデータを測定した(空間群P41、a=b![]() 96.5Å, c=149.5Å)。数セット収集したMADデータのうち一番双晶率の少ないもの(双晶率10%、CNSによる推定値)を選びイメージ処理とスケールマージ(DENZO/Scalepack)を行い、双晶の考慮なしでMAD位相を使って構造解析を進めた。まず、4つの水銀サイトを使って、3.3ÅのMAD位相を位相改良した電子密度図で14本のヘリックスを構築した(SOLVE, SHARP, O)。この部分モデルにより、非結晶単位に2分子あるロドプシン分子の非結晶学的2回対称関係を決定し、改めてNCS平均を含めた位相改良をした(DM)。この実験位相による電子密度図でリジン269番目にシッフ塩基を形成した11-シス-レチナールを明瞭に確認できた。位相計算に用いたMADデータをそのまま精密化の構造因子として用いて、さらに精密化とモデルの再構築を行った(R値24%、フリーR値28%、CNS,O)。Asp2、Asp15に結合した糖鎖の一部を含めて、細胞質側のループの一部を除いてほぼ全体構造が明らかになった(Fig.1)。そこでさらにAPS・19-IDビームラインで収集した水銀誘導体の2.8Å回折データをもちいて分子置換法で位相付けしたのちmerohedral twin(双晶率29%)として、精密化とモデル再構築を繰り返した(現在のモデルのR値=18.3%、フリーR値=23.0%)。このモデルには、シッフ塩基を形成した11-シス-レチナールや水銀、亜鉛そしてAsn2とAsn15位の糖修飾の一部、アセチル基でキャップされたN末を含めてロドプシンのほぼ全容を含んでいる(Fig.1)。
96.5Å, c=149.5Å)。数セット収集したMADデータのうち一番双晶率の少ないもの(双晶率10%、CNSによる推定値)を選びイメージ処理とスケールマージ(DENZO/Scalepack)を行い、双晶の考慮なしでMAD位相を使って構造解析を進めた。まず、4つの水銀サイトを使って、3.3ÅのMAD位相を位相改良した電子密度図で14本のヘリックスを構築した(SOLVE, SHARP, O)。この部分モデルにより、非結晶単位に2分子あるロドプシン分子の非結晶学的2回対称関係を決定し、改めてNCS平均を含めた位相改良をした(DM)。この実験位相による電子密度図でリジン269番目にシッフ塩基を形成した11-シス-レチナールを明瞭に確認できた。位相計算に用いたMADデータをそのまま精密化の構造因子として用いて、さらに精密化とモデルの再構築を行った(R値24%、フリーR値28%、CNS,O)。Asp2、Asp15に結合した糖鎖の一部を含めて、細胞質側のループの一部を除いてほぼ全体構造が明らかになった(Fig.1)。そこでさらにAPS・19-IDビームラインで収集した水銀誘導体の2.8Å回折データをもちいて分子置換法で位相付けしたのちmerohedral twin(双晶率29%)として、精密化とモデル再構築を繰り返した(現在のモデルのR値=18.3%、フリーR値=23.0%)。このモデルには、シッフ塩基を形成した11-シス-レチナールや水銀、亜鉛そしてAsn2とAsn15位の糖修飾の一部、アセチル基でキャップされたN末を含めてロドプシンのほぼ全容を含んでいる(Fig.1)。
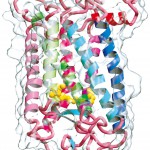
Fig. 1 Three-dimensional Structure of Bovine Rhodopsin.
Cartoon model of bovine rhodopsin with a transparent molecular surface. Cytoplasmic and extracellular domains are up and down, respectively. 11-cis-Retinal is connected at Lys269 as a protonated Schiff-base in yellow-ball model, and two sugar moieties are attached at Asn2 and Asn15 in stick models colored by sky-blue.
4.ウシ・ロドプシンの全体構造
この正方晶系のロドプシン結晶では、非結晶学的単位に2回対称で関係づけられるロドプシン単分子はヘリックスⅠを介して、上下逆さまに充填されている。これは、ロドプシン分子の静電ポテンシャルが全体としてほとんどが負に偏っているのに対し、細胞質側が正となって互いの静電ポテンシャルを相殺する形をとっていることになる。
膜貫通部分の7本ヘリックス束の並びはすでに原子構造既知の七回膜貫通型プロトンポンプ・バクテリオロドプシンのものとトポロジー的に対応する(Fig.2)。しかし、すでにこれまでの電顕による低分解能構造からもすでに指摘されていたように、両者でその機能の違いとともに、その位置関係は大きく異なっている。特に細胞質側では、ヘリックスⅣが大きく外側にずれて6本の束にヘリックスⅣが付加したような配置になっている。さらに、膜貫通ヘリックスはその途中にヘリックスを壊しやすいプロリン、グリシン残基を含むため、標準的なヘリックスでないところが多い。なかでもヘリックスⅡとⅥの細胞外ドメインよりそれぞれ1/3程度の88FGGFと265WLPY付近、そしてヘリックスⅦの普通より引き延ばされたやや細胞質よりの300VYNP付近で大きく折れ曲がっている。このため、細胞質側では、後に述べるように7本の膜貫通ヘリックス間で水素結合ネットワークを形成するほど密な束なのに対して、細胞外ドメイン側でヘリックス束の内側が広がって分子内に11-シス-レチナールを納めて余りあるほどの空隙を形成している(Fig.3A)。
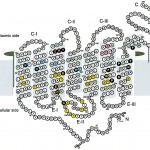
Fig. 2 Schematic Secondary Structure of Bovine Rhodopsin after Hargrave's.
Filled residues are conservative residues among GPCRs. All colored residues are corresponding to the mentioned residues in Fig. 3 and 4. Orange colored S-S bridge is in Fig. 3A, pink, sky-blue and light-green residues are in Fig. 3B, 3C and 3D, respectively. Yellow colored residues are the vicinity of 11-cis-retinal within 4Å as in Fig. 4.
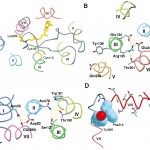
Fig. 3 Interesting Sub-structures in Bovine Rhodopsin.
A: Conserved S-S bridge between Cys110 and Cys187 on the transmembrane helix Ⅲ and extracellular loop Ⅱ among GPCR family.
B: Asp/Glu-Arg-Try motif in GPCR family. The putative salt bridges and hydrogen bonds are indicated by break-line in yellow. These residues contribute to the electrostatic negative surface surrounded by hydrophobic wall at the bottom of the pocket in the cytoplasmic domain.
C: Hydrogen bonding network between transmembrane helices near the cytoplasmic domain.
D: Additional short and amphiphilic helix Ⅷ just after transmembrane helix Ⅶ. The angle between helices Ⅶ and Ⅷ is almost right angle and the bent structure of the helices is supported by aromatic ring stacking with the side chains of the conserved Tyr306 and Phe313 in space filled model with sky-blue colored carbon atoms.
細胞外ドメインはコンパクトに折り畳まれており、2本のストランドからなる短いβシートを含むN末の部分が、そして7本ヘリックス束の中心にある中空を長いE-Ⅱループがβシートで埋めるように内蓋をした上に覆い被さっていて、コンパクトな半球状の細胞外ドメイン全体で七回膜貫通ヘリックスの束を二重にキャップしている。βシートを形成した内蓋はGPCRでよく保存されている2つのシステイン残基Cys187とヘリックスⅢの細胞外側の端にあるCys110とS−S結合で固定されている(Fig.3A)。この内蓋の直下にβシートにそって11-シス-レチナールが弓形となってヘリックスⅦのLys269とシッフ塩基を形成して結合している。
これに対して、細胞質側ドメインはC末の長いループを含めて、7本ヘリックスの束の外側にループがのびているため特徴的な凹凸を持った比較的平板な構造をしており、細胞外ドメインの単純な半球状に比べ、Gtなどと直接相互作用するのに適しているように見える(Fig.1)。その分子表面静電ポテンシャルにおいても同様で、細胞外ドメインに比べて変化に富んだ特徴的正負の分布がみられる。特に膜貫通ヘリックスⅦに引き続くC末には10残基ほどからなる短いヘリックスⅧがほぼヘリックスⅦに直角につながっている(Fig.1,2)。このヘリックスⅧは脂質2重膜の表面に沿った位置になると予想され、脂質側だけに疎水残基が並んだ両親媒性のヘリックスであり、これを裏付ける。さらにその直後には、パルミチン酸が結合しているとされるCys322、Cys333が並んでいる。この結晶ではシステインの硫黄原子の先に結合したパルミチン酸の存在を示唆する電子密度は全く確認できないが、翻訳後修飾されたパルミチン酸チオエステルは精製・結晶化、さらには酢酸水銀による重原子誘導体化処理などの過程で加水分解されたかもしれない。
5.GPCRでよく保存された残基
多くのGPCRの間でよく保存されたアミノ酸残基がロドプシンの蛋白分子全体に広がっている。これらのよく保存された残基がGPCR一般の分子機能発現、特に分子スイッチ機構において重要であろうと予想されてきた。これらの残基は不活性型ロドプシンの立体構造維持に大きく寄与しているアミノ酸残基であることが明らかとなった。まず、(1)もっともよく保存されているジスルフィド結合した2つのシステイン残基はすでに述べたとおり、細胞外ループⅡのβシートをヘリックスⅢに固定しており、このシートはレチナールの内蓋を形成している(Fig.3A)。(2)GPCRに特徴的である134E(D)RY配列はヘリックスⅢの細胞質側の少し内側にあり、ヘリックスⅥとの間でGlu247、Thr251とともに塩橋、水素結合ネットワークを形成している(Fig.3B)。このGlu134などによる負の荷電は細胞質側の疎水的ポケットの底に露出して、Gtと直接相互作用することが可能である。(3)ヘリックスⅠのAsn55とヘリックスⅦのAla299主鎖のカルボニルそしてヘリックスⅡのAsp83への水素結合、さらに同じヘリックスⅡのAsn78と、ヘリックスⅣのTrp161、Thr160およびヘリックスⅢのSer127との間での水素結合を形成している。こうして細胞質側ドメイン付近で非共有結合ネットワークを形成して、5本のヘリックスを束ねている(Fig.3C)。(4)ヘリックスⅦから直角に折れ曲がった短いヘリックスⅧの両者にまたがったTyr306とPhe313はそれぞれの芳香環がスタックしていて、このふたつのヘリックスの曲がりを支えている(Fig.3D)。
このようにこれまでGPCRファミリーでよく保存されているとして機能が注目されてきた側鎖は曲がった膜貫通ヘリックスの細胞質側だけにあって、7本の膜貫通ヘリックス間非共有結合に関わっており構造維持に大きく寄与している。
6.ロドプシンのクロモフォア11-シス-レチナール
ロドプシンのクロモフォアである11-シス-レチナールは、電子密度上で明らかにLys269のε-アミンとシッフ塩基を形成し、6s-cis, 12s-trans, anti-C=N コンフォメーションとなっている(Fig.4A)。このコンフォメーションは、11-シス-レチナールの単独の結晶構造、さらにM. IshiguroによるZINDによるコンフォメーション解析[6][6]M. Ishiguro:J. Am. Chem. Soc. 122(2000)444-451 .の結果とよく一致しており、結合した11-シス-レチナールはタンパク質により特別なひずみを受けているということはないと考えられる。アンチ配座を取っているレチナールのシッフ塩基はGlu113のδ-カルボン酸と塩橋を直接形成する距離にあり(それぞれの酸素原子とリジンのアミンの窒素原子間距離は3.3Åと3.5Å)、水素化し正に荷電していることを示唆している(Fig.4B)。レチナールのシッフ塩基が水素化していることはこれまでの多くの結果を支持するが、NMRのシグナルの主流の解釈として、Glu113との間に結合水を介した水素結合が予想されていたのに対し、周辺にはっきりとした結合水を示唆する電子密度はなく、Thr94とGlu113を含む水素結合ネットワークの距離関係から考えてこの結晶構造ではロドプシンのレチナールとのシッフ塩基は直接Glu113と塩橋をつくっていて、この間に介在している結合水は存在しないと結論した。
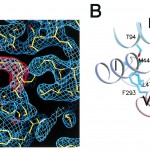
Fig. 4 The Environment of the Chromophore, 11-cis-Retinal in Connection with a Schiff-Base of ε-Amine in Lysine 269.
A:2Fo - Fc and retinal omit Fo - Fc maps calculated using model phases contoured at 1σ(blue)and 5σ(red) with the current refined model in the vicinity of the bound retinal.
B:Cartoon model of the bound retinal with side chains of neighbor residues within 4Å from the bound retinal.
GPCRでもよく保存されているTrp265のインドール環はレチナールのβ-イオノン環の平面とスタックしている。また、このβ-イオノン環周辺には芳香環側鎖が集まっている。また、同様に Lys269のアルキル側鎖の周りも疎水的であるのに対して、シッフ塩基は親水的環境にあり、プロトネーションしたシッフ塩基のデプロトネーションがロドプシンの活性化に関与していると示唆されていることからも、合理的である。
7.結 語
不活性型ウシ・ロドプシンの原子構造が決定できたことは、視物質の機能を分子機構として理解する上で多くの情報を与える。そして、これまで集積された多くの研究結果を明快に説明できたばかりでなく、議論の俎上に上らなかった多くの示唆を与えている。たとえば、レチナールのシッフ塩基の環境についてより多くのアミノ酸残基が関与していることを示唆しており、実験的に検証する手だてを与えた。今後は、計算化学的手法により、この構造の有効性と有用性を検証・利用することが可能となった。すでに、ホモロジーモデルにより色認識の理解のため錐体にある赤、緑そして青を認識する錐体色素の分子論的基礎について予備的研究を進めている。
さらには、ロドプシンの活性化のモデル構築についても多くの示唆を与えている。たとえば、最近、MⅡ状態の全トランス型レチナール類似体がヘリックスⅣにあるAla169とフォト・アフィニティー・ラベルされるという報告がされた[7][7]B. Borhan, M. L. Souto, H. Imai, Y. Shichida and K. Nakanishi:Science 288(2000)2209.。今回の不活性体でもシッフ塩基を形成した11-シス-レチナールの代わりにそのまま全トランス-レチナールをおくことで、大きな分子衝突なしでこのAla169にほぼ届く形におけることが明らかとなっている。しかし、その途上にはそのままではGlu122を含めていくつかの立体的に障害となる残基が存在する。これが、活性化機構の考察を進める一つの方向になり得るだろう。いずれにせよこの構造はロドプシンを含めたGPCRの活性化機構を実験的に検証するための分子論的基盤となるだろう。
8.おわりに
H. Michelたち[8][8]J. Deisenhofer, O. Epp, K. Miki, R. Huber and H. Michel:J. Mol. Biol. 180(1984)385.によって光反応中心の立体構造解析にはじまった膜タンパク質の構造生物についても15年あまりが過ぎて、イオンチャンネルなどを含めて、今回のGPCRであるロドプシンを含めた約30の膜タンパク質の原子構造のほとんどが放射光X線結晶構造解析により解かれるようになった。そして、長年の構造生物の焦眉であったリボソームの構造が50S[9][9]N. Ban, P. Nissen, J. Hansen, P. B. Moore and T. Steitz : Science 289(2000)905.、30S[10][10]F. Schluenzen, A. Tocilj, R. Zarivach, J. Harms, M. Gluehmann, D. Janell, A. Bashan, H. Bartels, I. Agmon, F. Franceschi and A. Yonath:Cell 102(2000)615.と相次いで原子レベルで報告され、日本でいえばPFにはじまり、SPring-8という放射光ファシリティーが日常的に使えるなかで、SPring-8サイトでの新たな放射光構造生物の目標を設定しなければならない時期が来ている。
まずは、(1)21世紀がライフサイエンスの世紀といわれるなかで、ポストゲノムの展開として創薬など応用研究の基盤としての方法論を見据えた網羅的研究と特定の個別課題への展開。(2)第4世代放射光が胎動しはじめた今、新たな光を構造生物に生かす道を考える努力をはじめることの2点を考えはじめてみよう。
最後に、このウシ・ロドプシンの構造研究は岡田哲二博士(現京都大学)による数年にわたる結晶化の努力に多くを負うとともにK. Palczewskiワシントン大学教授とそのグループとの共同研究の結果であることを付記する。また、この間この研究に直接間接に関わった多くの方々への感謝を表する。
参考文献
[1]“Receptor Classification”ed.D.G Trist,P.P.A.Humphrey, P.Leff and N.P.Shankley:Ann.N.Y.Acad.Sci.vol.812(1997).
[2]J.Klein-Seetharaman, E.V.Getmanova, M.C.Loewen, P.J.Reeves and H.G.Khorana, : Proc.Natl.Acad.Sci.USA 96(1999)13744.
[3]P.Herzyk and R.E.Hubbard:J.Mol.Biol.281(1998)741.
[4]K.Palczewski, T.Kumasaka, T.Hori, C.A.Behnke, H.Motoshima, B.A.Fox, I.L.Trong, D.C.Teller, T.Okada, R.E.Stenkamp, M.Yamamoto and M.Miyano:Science 289(2000)739.
[5]T.Okada, I.Le Trong, B.A.Fox, C.A.Behnke, R.E.Stenkamp and K.Palczewski:J.Struct.Biol.130(2000)73.
[6]M.Ishiguro:J.Am.Chem.Soc.122(2000)444-451 .
[7]B.Borhan, M.L.Souto, H.Imai, Y.Shichida and K.Nakanishi:Science 288(2000)2209.
[8]J.Deisenhofer, O.Epp, K.Miki, R.Huber and H.Michel:J.Mol.Biol.180(1984)385.
[9]N.Ban, P.Nissen, J.Hansen, P.B.Moore and T.Steitz : Science 289(2000)905.
[10]F.Schluenzen, A.Tocilj, R.Zarivach, J.Harms, M.Gluehmann, D.Janell, A.Bashan, H.Bartels, I.Agmon, F.Franceschi and A.Yonath:Cell 102(2000)615.
宮野 雅司 MIYANO Masashi
理化学研究所 播磨研究所
〒679-5148 兵庫県佐用郡三日月町光都1-1-1
TEL:0791-58-2815 FAX:0791-58-2816
e-mail:miyano@spring8.or.jp
熊坂 崇 KUMASAKA Takashi
理化学研究所 播磨研究所
〒679-5148 兵庫県佐用郡三日月町光都1-1-1
TEL:0791-58-2815 FAX:0791-58-2816
e-mail:kumasaka@postman.riken.go.jp
堀 哲哉 HORI Tetsuya
理化学研究所 播磨研究所
〒679-5148 兵庫県佐用郡三日月町光都1-1-1
TEL:0791-58-2815 FAX:0791-58-2816
e-mail:thori@spring8.or.jp
山本 雅貴 YAMAMOTO Masaki
理化学研究所 播磨研究所
〒679-5148 兵庫県佐用郡三日月町光都1-1-1
TEL:0791-58-2815 FAX:0791-58-2816
e-mail:yamamoto@postman.riken.go.jp








