Volume 02, No.5 Pages 28 - 31
4. 専用ビームライン/CONTRACT BEAMLINE
生体超分子構造解析(大阪大学)ビームライン(BL44XU)の概要
Outline of BL44XU Macromolecular Assemblies (Osaka University)
1.はじめに
この施設は生体超分子の立体構造を単結晶構造解析法及び溶液散乱法によって決定することを目的にし、学術振興会未来開拓学術研究事業より援助を受けて建設に取りかかっている。結晶化可能な如何なる大きさの生体物質のX線結晶構造解析するために、格子定数が2000 Åの結晶を2.5 Å分解能で測定可能にすることを究極の目標にしている。当面は、格子定数1500 Åの結晶を3.5 Å分解能までを目指している。その結果、生体超分子の溶液散乱実験にも十分適用できるものにしたい。
2.研究概要
目的生体内には様々な超分子と呼ばれる巨大な蛋白質・核酸集合体があり、これらが多様な機構で生体反応系を高度に制御している。これらの超分子の分子内で起こるアミノ酸残基やタンパク質サブユニット間の特異的な相互作用が、単一のタンパク質では不可能な秩序だった制御を可能にしている。神秘といわれる生命現象のもとを正せば、この高度に制御された秩序性に行き着く。従って、この生命の神秘を立体構造に基づいて理解することを目指す構造生物学は早晩、単独の蛋白質の構造を基にした展開からサブユニットが複雑に絡み合った生体超分子の構造に立脚した展開へと進んで行かねばならない。
今後、研究対象になる生体超分子は数多く有り、それらの一部を下に示す。
| A.DNA複製系 | |
| <機 能> | DNAは細胞に必要なタンパク質の情報をもっている。このDNAを必要に応じて複製し、遺伝情報を継承する。 |
| <タンパク質> | DNAポリメラーゼ、DNAプライマーゼ、DNAヘリカーゼ |
| B.DNA転写系 | |
| <機 能> | DNA上の遺伝情報に基づいて、タンパク質を合成するための第1段階として、RNAを合成する。 |
| <タンパク質> | RNAポリメラーゼI, II, III、基本転写因子複合体 |
| |
60万~ |
| C.RNAスプライシング | |
| <機 能> | DNAに基づいて合成されたRNAはタンパク質合成には不要な領域を含んでおり、この領域を切り取ってmRNAを作る。 |
| <タンパク質> | スプライソーム |
| D.タンパク質合成系 | |
| <機 能> | mRNAの塩基配列にしたがってアミノ酸を一つずつ繋ぎ合わせてタンパク質を合成する。 |
| <タンパク質> | リボソーム |
| <構成、分子量> | 数本のrRNAと数10分子のタンパク質サブユニットで構成され、分子量は300万から500万。 |
| E.タンパク質輸送 | |
| <機 能> | リボソームによって合成されたタンパク質を細胞内の特定の場所に運ぶ。 |
| <タンパク質> | リボソーム受容体、核腔 |
| <構成、分子量> | 数10万~1000万 |
| F.立体構造形成系 | |
| <機 能> | タンパク質の立体構造を作る働きを持つ。アミノ酸が一本に繋がってタンパク質ができるが、分子量が大きくなるにつれて自動的には立体構造ができにくくなるので必要である。 |
| <タンパク質> | シャペロニン |
| <構成、分子量> | 70万 |
| G.呼吸系 | |
| <機 能> | 呼吸によって得た酸素などを利用して、細胞が利用できる化学エネルギーに変換する。 |
| <タンパク質> | 呼吸鎖複合体I, II, III、ATP合成酵素複合体 |
| <構成、分子量> | 3~25サブユニット、分子量20万~100万 |
| H.光合成系 | |
| <機 能> | 光エネルギーを細胞が利用できる化学エネルギーに変換する。 |
| <タンパク質> | 光合成系複合体I, II |
| <構成、分子量> | 分子量30万~120万 |
| I.細胞間相互作用系 | |
| <機 能> | 細胞膜表面から突き出ていて他の細胞と相互作用しあい、細胞間の情報伝達を行う。 |
| <タンパク質> | アンカージャンクション、ギャップジャンクション |
| J.多機能酵素系 | |
| <機 能> | ひとつの機能だけでなく複数の機能を持ち、それらの機能を互いに連動して発揮するシステムを持っている。 |
| <タンパク質> | プロテアソームなど |
| <構成、分子量> | 50万~800万 |
| K.ウイルス | |
| <機 能> | タンパク質と核酸の複合体で、生物の細胞内に入り込んで、その細胞の一連の酵素を借用して、自己増殖する。その結果細胞に様々な障害をもたらす。 |
| <ウイルス> | イネ萎縮病ウイルス、タバコネクロシスウイルス |
| <構成、分子量> | 60以上のタンパク質サブユニット、分子量800万~8000万 |
いずれの場合もその構造決定は生命現象の理解を飛躍的に高めることは必至であるが、その分子量がきわめて大きく、今までX線結晶構造解析が経験した限界を超えている。それらの結晶格子の大きさは2000 Åに達すると見積もられる。このビームラインでは、精度の高い回折強度測定によって、こうした巨大な生体超分子複合体のX線結晶構造解析を行う。
3-1.回折強度測定法
生体超分子の結晶は単位格子が大きい。格子の大きさに反比例して回折斑点の間隔が狭くなることと、単位格子の体積に反比例して回折強度が低下することが、生体超分子のX線回折強度測定を困難にしている。回折斑点間の分離は、入射X線の平行性を高める、入射X線の大きさを小さくする、結晶のモザイク性を小さくする、回折強度記録媒体の位置分解能を高くする、カメラ半径を長くする、X線の波長を長くする、強度測定時における結晶の回転の振動幅を小さくすることなどによって克服する。回折強度の低下による構造因子の観測値のS/N値の低下を克服するためには、入射X線の強度を上げることに加えて、X線の平行性を高めることが極めて有効である。第3世代放射光は、これらの回折強度測定における問題を克服するためには、これまでにはない優れた光である。
実際には、強力で平行性の高い第3世代放射光を使用しても問題点も残ってくる。強力なX線を使用すれば、それだけ結晶の劣化も激しくなる。これを抑えるためには、結晶を急速凍結する方法がある。しかしこの方法だと、もともとモザイク幅が0.05度程度の結晶でも0.30度以上に大きくなり、そのために斑点の分離が不可能になる。斑点の重なりの問題を克服するために、一定間隔での静止写真撮影とその処理用の重なりのデコンボリューションを行うソフトウエアが必要である。結晶の急速凍結を避けて、結晶のモザイク幅を小さいままで、結晶が劣化すれば取り替え、多数の結晶を使って測定する方法を採用する場合もある。
格子定数が1000 Åを越えると、SPring-8でも簡単にルーチンワーク的に良質の回折強度を得る方法は、まだ確立されてない。しかし、第3世代放射光の特性を考慮すれば今でも、第2世代の放射光によって300 Åの格子の回折強度測定が行えるのと同等以上に可能であろう。しかし、構造解析のことを考えると、格子が大きくなればなる程、回折強度の精度を高める必要がある。そのためには、一定の小さい間隔での静止写真撮影法によるデータ収集が最も有効であり、この方法の開発を進める必要がある。
このビームラインでは、当初はイメージングプレート回折計と既存のソフトウエアを使用して振動法による回折強度データ収集を行う。そのために1500 Åの格子では3.5 Å分解能に限定される。将来的には静止法用の回折計とソフトウエアを開発して、2000 Åの格子では2.5 Å分解能を達成する。
生体超分子ビームラインでは、通常のタンパク質結晶用のビームラインでは無視される低角の回折斑点の測定も行えるようにする。これらは格子定数の大きな結晶の構造解析法として開発している方法に利用する。
3-2.結晶構造解析法
結晶構造解析は基本的には重原子同型置換法によって行う。分子量が100万のものならば、通常のタンパク質の結晶構造解析に使用してきた重原子が、十分使えることは判っている。さらに分子量が大きくなり格子定数が大きくなっても一般に予想されているほどには、差のパターソン関数による重原子位置の決定が困難になるものではない。なぜならば、分子量が大きくなり格子が大きくなると、差のパターソン図中の重原子間のベクトルの分離もよくなる。そのために、単位格子中に数多くの重原子が導入されても、重原子位置の決定が可能になる。もちろん回折強度の測定精度が高いほど、重原子同型置換法の適用できる分子量は大きくなる。現時点でその限界が500万を越えられるかどうかは定かでないが、挑戦したい。
生体超分子の結晶は格子定数が大きい。このことはきわめて低角にも回折斑点があることを示している。このことを利用した構造解析の可能性がある。低角の回折斑点は、通常のタンパク質の結晶構造解析では棄てられているが、分子の形状に関する情報を多く持っている。一方、分子の形状は溶液散乱からも求めることができ、それを利用して分子置換法によって500 Å〜30 Åの低分解能の位相決定を行う。続いて低分解能の差のフーリエ合成法により重原子位置を決め、高分解能での重原子位置の精密化、高分解能での位相決定へ進む。この方法も新しい挑戦であるが、十分可能であり、分子量限界は完全に取り払えるものである。
ウイルスなどそのもの自身の対称が高い場合には、非結晶学的対称が結晶中に生じて、その非結晶学的対称性を利用した位相決定法がある。われわれは、この方法が一般的に適用できることを実証した。この場合も、回折強度の測定精度は、その有効性を支配するものである。ウイルスほど非結晶学的対称要素数が多くなくても、これを利用して重原子同型置換法による位相の改良を行うことはきわめて有効である。
以上、精度の高い回折強度に基づいて、主として重原子同型置換法による位相決定によって生体超分子の結晶構造解析を行う。
4.ビームラインの特徴
前に述べたように、このビームラインでは回折斑点の分離を良くすることが最も重要である。そのために平行性の高い光を得ることを最優先する。ビームラインの概要は図1に示している。
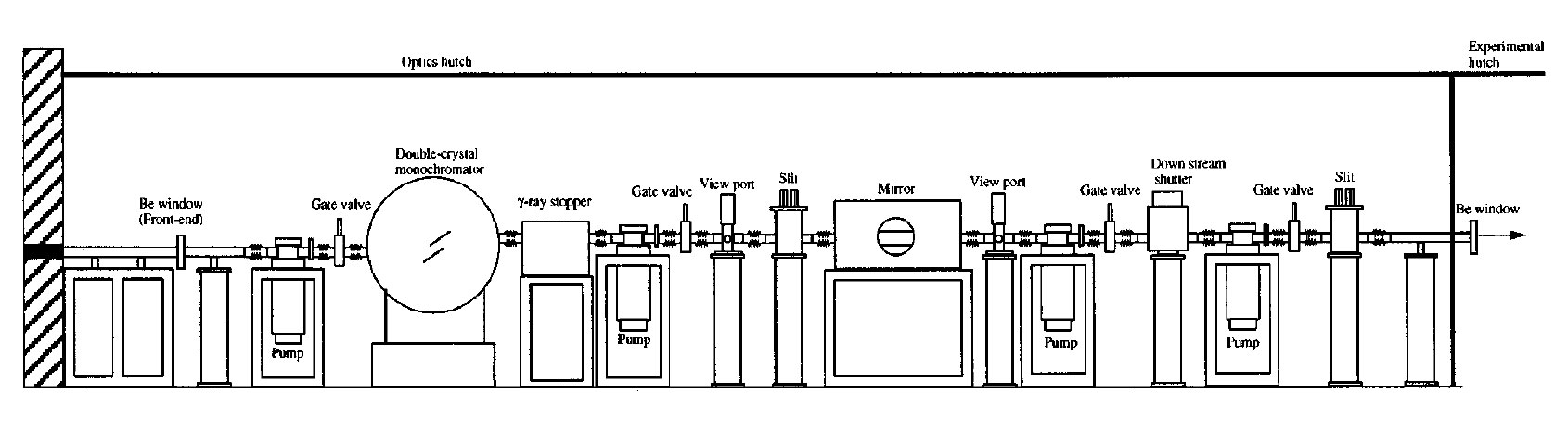
図1 光学ハッチの全容。左側が光源で右側が実験ハッチである。
4-1.光源および基幹チャンネル
光源には標準型真空封止型アンジュレータを使用し、偏光は利用しない。使用するエネルギー範囲は8〜18 keV(1次光)であるが、12.4 keV(1.0 Å)の準固定で使用する。低エミッタンスで、発散角を可能な限り抑えたい。設置場所は低βセクションであるので、将来さらに発散角が小さくなることを期待している。
基幹チャンネルはアンジュレータ同様にSPring-8標準仕様を用いる。
4-2.光学系
格子定数が大きいのでビームの発散角をいかに抑えるかが、最も重要であることはすでに述べた。分光器と1組の平面ミラーを設置して、できるだけ発散角を抑えて単色化した光にする。分光器は高熱負荷対応型分光器を設置し、XYスリットで光のサイズを決定する。エネルギー分解能はΔE/E=2 × 10-4程度にし、試料位置でのビームサイズは10〜100 µmにする。試料位置での光ビーム位置の安定性も1 µm以内に抑える。波長を準固定で用いるので、エネルギースキャンは行わない。できるだけ単純化しアンジュレータの特性を生かして、精度の高い回折強度データ収集を行える光を得ることを最優先する。
4-3.実験ステーション
測定装置は、当面は液体窒素試料冷却系と一体をなしたゴニオメータとイメージングプレート2次元検出器を用い、格子定数1500 Å、分解能3.5 Åのデータ収集を行う。この装置で、格子定数が500 Å、分解能2.5 Åは十分可能である。将来的には0.01度間隔でのステップスキャン方式によるデータ収集が可能な回折計を設置し、格子定数2000 Å、分解能2.5 Åのデータ収集を行う。また冷却系には液体ヘリウムを使用する冷却系の開発も行う。なお、ゴニオメータの回転中心の位置精度は3 µm以内にする。
強いX線を用いるために、構造解析された立体構造が、X線照射によって生じた非天然の構造ではないかという疑問はしばしば生じている。これを実験的に検証しておくことは極めて重要である。そのために、X線照射中の結晶のスペクトルを測定する結晶用スペクトルメータを設置する。
4-4.回折強度処理
振動法による回折写真の処理は、当面既存のソフトウエアを使用し、回折実験と平行して行う。結晶の分解能およびモザイク性の評価を迅速に行い、実験の継続か中断かを早期に判定する。そのために4 Gバイトのメモリーと1000 Gバイトのハードデイスクを備えたワークステーションを設置する。
新しい静止法ステップスキャン方式による回折写真のデータ処理ソフトウエアの開発を行い、格子定数2000 Å、分解能2.5 Åのデータ収集に備える。
5.おわりに
このビームラインは1996年より建設に入っているが、全体の予算には不十分な点もあり、新たな財源を模索しながら進めている。1999年3月までに完成させ、生体超分子構造の研究の飛躍に大きく貢献したい。計画および建設にあたって、理化学研究所をはじめ原子力研究所、高輝度光科学研究センターの多大な援助を受けてきたことに感謝すると共に、今後とも変わらぬご援助をお願いしたい。

月原 冨武 TSUKIHARA Tomitake
昭和19年5月25日生
大阪大学 蛋白質研究所
〒565 大阪府吹田市山田丘3-2
TEL:06-879-8604
FAX:06-879-8606
略歴:昭和42年大阪大学薬学部卒業、昭和44年同大学院理学研究科修士課程修了、昭和46年鳥取大学工学部、平成3年徳島大学工学部、平成7年大阪大学蛋白質研究所教授、理学博士、日本生物物理学会、日本結晶学会、日本生化学会、日本化学会、蛋白工学会、放射光学会、アメリカ結晶学会。

山下 栄樹 YAMASHITA Eiki
昭和45年2月26日生
大阪大学 蛋白質研究所
〒565 大阪府吹田市山田丘3-2
TEL:06-879-8605
FAX:06-879-8606
略歴:平成9年大阪大学大学院理学研究科博士後期課程修了(高分子専攻)、同年日本学術振興会特別研究員、同年8月大阪大学蛋白質研究所助手、理学博士、日本生物物理学会、日本結晶学会、日本化学会。








