Volume 01, No.4 Pages 41 - 44
4. 理研ビームライン/RIKEN BEAMLINE
構造生物学研究理研ビームラインⅠ(BL45XU)の概要
Riken BeamlineⅠfor Structural Biology(BL45XU)
理化学研究所 放射光構造生物学研究推進グループ The Institute of Physical and Chemical Research (RIKEN) SR Structural Biology Reseach Group
- Abstract
- This report focuses on the RIKEN Beamline1 for Structural Biology promoted by the Institute of Physical and Chemical Research (RIKEN). This beamline aims to advance structural biology research by using synchrotron radiation to gain a greater understanding of the functions of biological macromolecules in the aspects of higher order structures. Two experimental stations; a small-angle X-ray Scattering station (SAXS) and a protein crystallography station (PX) are simultaneously operated with two undulators in serial arrangement. The branched beams are generated by a beam-splitter (transparent diamond monochromator) . In the PX station, a trichromatic concept is developed to optimize for multi-wavelength anomalous diffraction (MAD) experiments. Trichromatic beams are provided by a trichromator. The main feature of this concept is to minimize errors in anomalous dispersion measurements for MAD. The SAXS station uses the monochromatized undulator beam that enables us to obtain (the) data with high smallangle resolution and high flux as well. The structure of proteins in solution under various conditions will be studied in this station. And the SAXS station uses a new type of detector; a two-dimensional microstrip proportional counter which can take data within a milisecond.
概要
理化学研究所では大型放射光施設SPring-8を利用して構造生物学研究を推進するために構造生物学研究理研ビームラインIの建設を進めている。
本ビームラインでは、ダイヤモンド結晶分光器を用いてアンジュレータ光を水平方向に分岐することにより、2つの実験ステーション(小角散乱実験ステーションと蛋白質結晶構造解析実験ステーション)での同時実験が可能である。
1.はじめに
構造生物学では、生化学や分子生物学などにより明らかにされた蛋白質・蛋白複合体・核酸などの生体高分子の機能を、その高次構造の側面から理解することを目標としている。理化学研究所では大型放射光施設SPring-8を利用して構造生物学研究を推進するために2本の構造生物学研究ビームライン(BL45XU・BL44B2)の建設を進めている。理研ビームラインⅠ(BL45XU)[1][1]M. Yamamoto et.al., Rev.Sci.Instrum. 66, 1833-1835(1995)は単色光を使用した結晶構造解析と小角散乱のための2つの実験ステーションを備えたアンジュレーターを光源としたビームラインである。また、理研ビームラインⅡ(BL44B2)は白色光を使用した結晶構造解析とXAFSのための2つの実験ステーションを備えたベンディングマグネットを光源としたビームラインである。本稿では理研ビームラインⅠの概要を紹介する。
2.理研ビームラインI(BL45XU)の特徴
理研ビームラインⅠは図1に示すように、小角散乱と結晶構造解析の2つの実験ステーションでの同時使用を想定したSPring-8ではじめての分岐ビームラインである。光源は1.5 m長のアンジュレーターを2台直列(タンデムアンジュレーター)に並べて各アンジュレーターを独立に制御することにより、2つの実験ステーションでの異なるエネルギーを使用した実験に対応可能である。また、2台のアンジュレーターはダイヤモンド結晶を使用した水平分岐に対応して、垂直偏光仕様である。タンデムアンジュレーターからの放射光は、小角散乱用の透過型2結晶ダイヤモンド分光器をビームスプリッターとして使用することにより、水平方向に分岐して小角散乱実験ステーションと蛋白質結晶構造解析実験ステーションに導かれる。
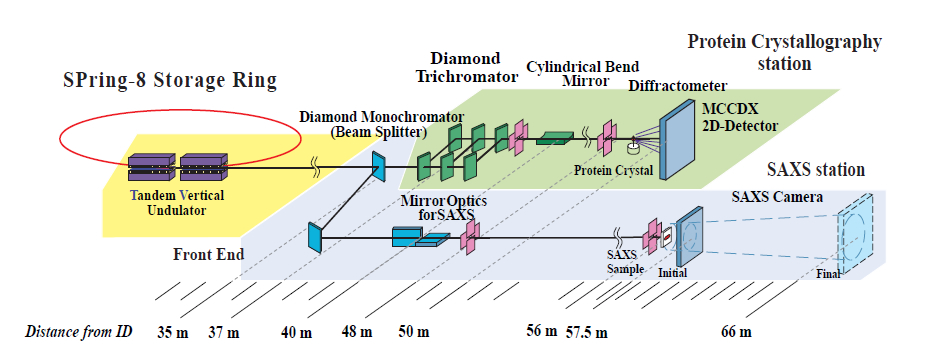
図1 理研ビームラインIの全体図
3.蛋白質結晶構造解析ステーション
構造生物学において結晶構造解析に最も期待される成果は原子レベルでの立体構造の解析であり、多くの構造機能相関の研究はX線結晶構造解析の結果に基づいて行われている。しかし、現在の結晶構造解析法には、“結晶化の問題”や“位相問題”という難関が待ちかまえている。“結晶化の問題”については、結晶化実験のデーターベース化や、結晶化のための試薬等も市販されるようになってきたが、まだまだ試行錯誤の段階であり今後の研究成果が期待される。“位相問題”に対しては、多重同型置換法や分子置換法が現在主流を占めており、数多くの“未知構造を知りたい”という要求にはなかなか答えきれない状況である。蛋白質結晶構造解析ステーションでは、多波長異常分散法(MAD:Multiwavelength Anomalous Diffraction Method)[2],[3][2]J. Karle, Int.J.Quant.Chem. 7, 357-367(1980)
[3]W. A. Hendrickson et.al., Proteins 4, 77-88(1988)に最適化した"Trichromatic Concept"を考案する事により、簡便に多くの蛋白質の未知構造を解明することを最大の目的にしている。
3.1 Trichromatic Conceptとは
MAD法とは異常分散原子を含む蛋白質結晶が、吸収端近傍の異なる波長のX線にたいして回折強度に異常分散差を生じる性質を利用して、位相決定を行う方法である。本実験ステーションの建設を進めるに当たり解決しなければいけないMAD法での最大の問題点は、位相決定の決め手となる同一波長内及び多波長間での異常分散差が大変微小(回折強度の数%)であり、充分な精度での回折強度測定の困難さである。
今までのMAD法の実験では、異なる波長での回折強度測定は、1つのモノクロメーターによる波長切り替えにより行っていたが、この方法では波長やX線ビーム強度の再現性や安定性に問題があり、さらに1つの結晶で全波長(3波長以上)の回折強度測定を行うためには波長切り替えのためのデッドタイムが多く必要であり、結晶のダメージも心配された。
本実験ステーションでは、同時に異なる3波長の光をもちいた回折強度測定が可能な"Trichromatic Concept"を新しく考案した。"Trichromatic Concept"では図2のように、タンデムアンジュレータからの異なる2波長のアンジュレータ光から、トリクロメータと呼ばれるダイヤモンド結晶を用いた透過型の3波長分光器により、吸収端近傍の2波長とリモート点の合計3波長を同時に切り出し、ビームチョッパーにより時系列に従って順番に3波長での回折強度測定が可能である。これにより、分光器や回折計のセッテングを変えることなく同じ結晶から短い時間内に3波長の回折強度の測定が可能であり、MAD法における回折強度測定での系統誤差を最小化する。

図2 Trichromatic Conceptの概要
現在、MAD法は金属蛋白質や良質の重原子誘導体結晶を主な対象としているが、広く一般の蛋白質結晶構造解析の“位相問題”解決に適用され必要不可欠な手法になる為に、部位特異的な化学修飾による金属ラベル蛋白質作成技術や、セレノメチオニンなどの非天然型アミノ酸を導入した蛋白質の生合成技術の開発が不可欠である。
4.小角散乱ステーション
小角散乱は、結晶とは違い3次元的に配列した試料からのX線の回折ではないので、得られる構造の分解能は限定される。しかしながら生物試料を生理的条件に近い状態で測定ができるという利点があり、その真価は“酵素反応や構造形成での蛋白質の姿の変化をみる”という点に集約される。このような目的を念頭に置いて、温度、圧力等環境を変えたときの構造の変化といった基本的な研究を行い、その上で基質と反応させたときの構造変化より蛋白質構造の構築原理、機能の発現原理を解明していくことにある。
4.1 光学系
小角散乱は散乱角の小さいところを計測するので結晶回折の場合と違いX線光束の性質、光学系がデーターの質と量に影響し、ひいてはサイエンスの結果にも表れるという面をもつ。そこでダイアモンドモノクロメーターの(111)面をブラッグタイプで使用して結晶ビームラインと分岐した後、縦横方向独立にミラーを設置し、2:1集光で集光させる光学系を採用した。ミラーはRh蒸着したSiO2ミラーで4 mradの反射角を用いる。用いるエネルギーは6 keV〜14 keVまで可変であるが基本的には12 keV近傍で使用する。
4.2 実験ハッチ
ハッチ内では試料位置は固定としカメラ長の変更は検出器架台(1.2 m × 2 m)を移動させ真空パスを付け替えることによりおこなう。当面1.5 mまでのカメラ長で実験を行うが、最終的に10 mのカメラ長にしたときの小角分解能は500 nmになる。検出器はサブミリ秒の時分割測定も可能な2次元マイクロストリップ型比例係数管を使用する。この検出器は理研が東工大の谷森博士と共同開発しているものでマイクロストリップの導体のパターンを絶縁体に付着させそれをガス増幅のための電極として用いるものである。計数率では10 Mevents/sec、局所的には104 photons/mm2/secのX線が入射しても安定に動作する。
試料槽は静的測定に使う通常のタイプの他、高収束、小断面積のアンジュレーター光の特性を利用して光照射付きストップドフロー装置、温度ジャンプ装置を用意する。現在のPFの小角ビームラインより2桁弱強度が強くなるのでより早い反応がおえるようになるだろう。また、このビームラインは12 keVと比較的エネルギーの高い所を利用するので窓材の吸収が減る。そこで高圧ストップドフロー装置を設置する。当面の実験課題は、1)巨大分子構造体の酵素反応に伴う構造変化、2)蛋白質の温度変性およびおれたたみ反応、3)高圧下における蛋白質の反応速度と構造変化などである。
参考文献
[1]M. Yamamoto et.al., Rev.Sci.Instrum. 66, 1833-1835(1995)
[2]J. Karle, Int.J.Quant.Chem. 7, 357-367(1980)
[3]W. A. Hendrickson et.al., Proteins 4, 77-88(1988)

山本 雅貴 YAMAMOTO masaki
昭和38年9月5日生
理化学研究所・生物物理研究室(兼)放射光構造生物学研究推進グループ
〒678-12 兵庫県赤穂郡上郡町SPring-8リング棟
TEL:07915-8-1844
FAX:07915-8-0830
e-mail:yamamoto@postman.riken.go.jp
略歴:平成3年9月大阪大学大学院理学研究科修了、理学博士。同年10月より理化学研究所研究員現在に至る。日本生化学会会員、日本化学会会員、日本結晶学会会員、日本放射光学会会員。最近の研究:SPring-8での新しいビームラインの建設。趣味:いろいろなところを散歩すること。

藤澤 哲郎 FUJISAWA tetsuro
昭和37年2月18日生
理化学研究所・生物物理研究室(兼)放射光構造生物学研究推進グループ
〒678-12 兵庫県赤穂郡上郡町SPring-8リング棟
TEL:07915-8-1844
FAX:07915-8-1838
e-mail:fujisawa@spring8.or.jp
略歴:平成元年大阪大学大学院基礎工学研究科生物工学専攻博士課程修了、工学博士。同年米国エール大学博士研究員を経て、平成2年10月より理化学研究所研究員現在に至る。平成7年度日本生化学会JB論文賞。日本生物物理学会会員、日本生化学会会員、日本農芸化学会会員、日本高圧力学会会員、放射光学会会員。最近の研究:高圧下のX線溶液散乱、超分子蛋白質構造体の小角散乱。趣味:温泉、食べ歩き。








