Volume 10, No.2 Pages 120 - 124
3. 最近の研究から/FROM LATEST RESEARCH
カルシウムポンプのイオン輸送機構の構造的解明
東京大学 分子細胞生物学研究所 Institute of Molecular and Cellular Biosciences, The University of Tokyo
- Abstract
- Calcium ATPase is an ATP-powered calcium pump and the best studied member of the P-type ion-transporting ATPases. Its crystal structures have been determined using SPring-8 for 5 different states that cover the whole reaction cycle. These structures show how the ion pump works and reveal what ATP and phosphorylation do.
カルシウムは骨や歯になるだけではない
生体は金属イオンを非常に巧みに使っている。蛋白質が安定に存在するために、また、酵素反応の触媒のために亜鉛や鉄、銅イオンを使い、また、細胞の内外で濃度差を作り、それを電気信号として使っている。例えば、同じ1価の陽イオンでもNa+は細胞外に多く、K+は細胞内に多く存在し、神経が興奮するときはNa+が外から濃度勾配に従ってチャネル蛋白質を通じて流入し、膜電位が変化する。これが、興奮の実体であり、電気信号と化学信号の橋渡しにもイオンが使われている。
数あるイオンのうち、生体反応の制御のためにもっとも広範に使われ重要な働きをするのは、カルシウムである。人体には1400グラムのカルシウムがあるが、その大部分は骨や歯で、信号の伝達に使われるのは10グラムにも満たないとされる。しかし、その働きは大変重要である。たとえば、筋肉の収縮弛緩を例にとって見ると、筋小胞体とよばれる筋繊維を取り囲む袋状の組織があり、カルシウムの貯めになっている。この貯めからカルシウムが放出されると収縮がおこり、もう一度カルシウムをポンプを使って汲み上げると弛緩が起こる。カルシウムを汲み上げるためには、小胞体内外でのカルシウムの濃度差に関係なく、一万倍の濃度差に打ち勝って、カルシウムを運搬(能動輸送)する必要があり、そのエネルギー源としてATPが分解される。
つまり、カルシウムポンプの実体は、小胞体膜に埋まった膜蛋白質であり、ATPを分解する酵素で、Ca2+-ATPaseと呼ばれる。このポンプは一個のATPを分解して2個のカルシウムを運ぶことができる。筋肉の収縮弛緩を十分な速さで行うために、筋小胞体膜の全膜蛋白質の60%をこのポンプ蛋白質が占めており、構造解析にあたって最初に解決しなければならない「量の問題」は存在しない。(実際、我々の競争相手であるデンマークグループは、膜結合蛋白質を除いただけの試料から結晶化に成功している。)
運搬に当たっては、カルシウム結合部位の構造を高親和性で細胞質を向いている(E1)状態から低親和性で細胞外を向いている(E2)状態に変化させて、濃度勾配に依存しない運搬を行っていると考えられている。この蛋白質の仲間には、高等生物ならどの細胞にもあるNa+K+ポンプや、胃のpHを低く保つのに使われるH+K+ポンプ(胃潰瘍の原因にもなる)があり、いずれも、細胞の恒常性を保つのに大変重要である。そのために、医薬品の対象にはなりにくいが、抗マラリア薬の標的がマラリアのカルシウムポンプであることが判明し、新薬の開発もされて話題になった。
SPring-8での回折実験
さて、私の研究室は1988年以来、この膜蛋白質の構造研究に集中してきた。最初は電子顕微鏡によるチューブ状結晶の解析で、分解能は8Å止まり(αへリックスが何とか見える分解能)であったが、1998年にX線結晶解析にかかる3次元結晶を作ることに成功した。それ以降、研究は順調に進み、反応サイクル全体をカバーする5つの状態の構造を2.3〜2.9Å分解能で解き、イオンのポンプ機構のほぼ全貌を明らかにすることが出来た[1-5][1]C. Toyoshima, M. Nakasako, H. Nomura and H. Ogawa : Crystal structure of the calcium pump of sarcoplasmic reticulum at 2.6 Å resolution. Nature 405 (2000) 647-655.
[2]C. Toyoshima and H. Nomura: Structural changes in the calcium pump accompanying the dissociation of calcium. Nature 418 (2002) 605-611.
[3]C. Toyoshima and T. Mizutani: Crystal structure of the calcium pump with a bound ATP analogue. Nature 430 (2004) 529-535.
[4]C. Toyoshima, H. Nomura and T. Tsuda : Lumenal gating mechanism revealed in calcium pump crystal structures with phosphate analogues. Nature 432 (2004) 361-368.
[5]C. Toyoshima and G. Inesi: Structural basis of ion pumping by Ca2+-ATPase of the sarcoplasmic reticulum. Annu. Rev. Biochem. 73 (2004) 269-92.。2000年の論文[1][1]C. Toyoshima, M. Nakasako, H. Nomura and H. Ogawa : Crystal structure of the calcium pump of sarcoplasmic reticulum at 2.6 Å resolution. Nature 405 (2000) 647-655.は、陽イオンのポンプとして初めての構造であり、広範な分野で注目を集めた。初期の回折実験はSPring-8の立ち上げ時期に重なっており、使用したビームラインもBL44B2(理研)、BL41XU(共用)、BL44XU(蛋白研)、BL40B2(共用)とさまざまであるが、最近はもっぱらBL41XUを利用している。特に、E2状態の結晶はc軸方向(脂質二重膜が積み重なる方向で座布団の厚さの方向)の格子の長さが600 Å近くあり、分解能は現在2.4 Åなので、R-AXIS Vが必須だからでもある。図1に一例を示すが、4,000 × 4,000のR-AXIS Vでもやっとであり、もっと大きな検出器が欲しい。カルシウムポンプの結晶は、いずれも、脂質二重膜が多数積み重なった形の三次元結晶であり、板状であることが多く、厚さも20μmに満たなかったりする。従って、SPring-8が立ち上がっていなかったら、この研究はほとんど不可能であった。独走しているつもりであったが、4年もすれば追いつかれるもののようで、2004年発表の2つの論文[3,4][3]C. Toyoshima and T. Mizutani: Crystal structure of the calcium pump with a bound ATP analogue. Nature 430 (2004) 529-535.
[4]C. Toyoshima, H. Nomura and T. Tsuda : Lumenal gating mechanism revealed in calcium pump crystal structures with phosphate analogues. Nature 432 (2004) 361-368.ではデンマークグループと熾烈な競争になった。

図1 骨格筋筋小胞体Ca2+-ATPase(ポンプ)のカルシウム非存在時の結晶とその回折パターン。この結晶は約1辺600 μm、厚さ50 μmほどあり、空間群はP41、格子定数は a = b = 71.4 Å、c = 591.0 Å。回折点(1, 29, 14)は1/2.46 Å-1にある。
イオンポンプのメカニズム
骨格筋の筋小胞体カルシウムポンプ(SERCA1a)は994個のアミノ酸残基がつらなった分子量約11万の一本のポリペプチド鎖によって構成されており、細胞質領域の3つのドメイン(A、NおよびP)と10本の膜貫通αヘリックス(M1-M10)より成る(図2)。細胞質領域には反応の途中で燐酸化が起こるPドメイン、ATPのアデニン環部分が結合するNドメイン、カルシウムの通路のゲートの開け閉めのレバー(actuator)となるAドメインがある。ATPaseとしての大きな特徴は、反応サイクルの途中で自己燐酸化が起こる(そのためにP型ATPaseと呼ばれる)ことであり、この点、ミオシンやF1とは大きく異なる。燐酸化される残基はAspであり、バクテリア型である。実際、二次構造要素の並び方は異なるものの、バクテリアの二成分制御系蛋白質と燐酸化反応に使われる残基は同一である。
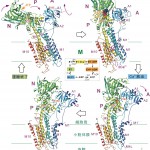
図2 Ca2+-ATPaseの4つの基本状態の構造。骨格筋筋小胞体Ca2+-ATPaseは10本の膜貫通へリックスと3つの細胞質ドメインを持つ分子量11万の膜蛋白質である。膜内に結合したCa2+は紫色の円で囲ってある。
得られた結晶構造は、Ca2+2個を結合したE1·2Ca2+、それにATPの非加水分解類似物であるAMPPCPが結合したE1·AMPPCP、ATPの代わりに、安定な燐酸類似物であるAlFxとADPが結合したE1·AlFx·ADP(状態としては燐酸の転移が起こった直後のE1P·ADPに相当)、Ca2+非存在下で燐酸の安定な類似物であるMgF42-が結合したE2·MgF42-(厳密にはE2Pではなく、product stateであるE2·Piに相当)、Ca2+非存在下のE2(但し、強力阻害剤であるthapsigarginで安定化)と5つあるが、E1·AMPPCPとE1·AlFx·ADPの構造はほとんど同一であるため、構造的には、反応サイクルは4つの基本状態からなると考えられる(図2)。Ca2+の運搬に伴う構造変化は図に示すように、極めて大きくかつ複雑であり、逆反応が起こらないよう、随所に構造的工夫が凝らされている。Ca2+の結合部位は膜貫通へリックスM5、M6、M8で作られるサイトⅠとほとんどM4へリックスの上にM4-M6で作られるサイトⅡから成り、サイトⅠが一個目のカルシウム結合サイトである(図3)。両方のカルシウムに配位するのはD800(M6)のみである。燐酸化残基であるD351とは約50 Å離れている。
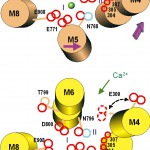
図3 膜貫通領域にあるCa2+結合サイトのCa2+存在時、非存在時の構造の模式図。円筒はαへリックスを示す。脂質二重膜にほぼ直角に細胞質側から見たもの。矢印はCa2+の離脱に伴うへリックスの動きを示す。
構造変化の大略を以下に記すが、重要なことはAドメインが膜内Ca2+通路のゲートの開閉を制御するアクチュエーターであり、他の二つのドメインはATPの結合や燐酸化によってAドメインとのインターフェースを変え、それによってAドメインの位置を制御していることである。
Ca2+が無い状態(E2、図2、4左下)では、三つの細胞質ドメイン(A、N、P)は寄り集まって、閉じた構造をとっている。M5へリックスは大きく湾曲しており、M3、M4へリックスは下に下がっている。古典的モデルと違って内腔側ゲートは閉じており、細胞質側ゲートは開いている。
そこにCa2+が来て、ポンプ蛋白質に結合すると(E1·2Ca2+)、M5へリックスはまっすぐになり、Pドメインが一緒に起き上がって、3つの細胞質ドメインは離れる(図2、4左上)。その結果、ATPは自由に動けるようになったNドメインに結合できる。
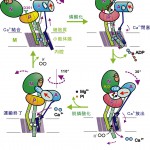
図4 Ca2+-ATPaseのイオン輸送に伴う構造変化の模式図。
Nドメインが傾斜してPドメインに近い位置に来ると、ATPの燐酸側がPドメインに結合できるようになる(E1·ATP)。その結果、ATPがNドメインとPドメインを橋渡し、Mg2+もPドメインに結合する結果、Pドメインは変形しAドメインとNドメインも結合する。このとき、Aドメインは30°傾斜し、M3へリックスとAドメインを結ぶループが引張られ、力のかかった状態が実現される。Aドメインの傾斜の結果、M1へリックスが引き上げられ、折れ曲がって、Ca2+の入り口をふさぐ。こうして、Ca2+の閉塞状態が実現される(図2、4右上)。
ATPが燐酸とADPに分解し、燐酸がポンプ蛋白質に渡され、燐酸化が起こる(E1P·ADP)。ADPがはずれると、Aドメインが、さきにATPによって引張られていたために、それを解消するよう水平に110°回転する。これがmain eventである。これに伴って、M1へリックスの向きが変わり、Ca2+結合部位を形成していたM4へリックスの下半分(M4L)が押され、向きが変わって、内腔側のゲートが開く。また、Pドメインが傾斜し、M5へリックスが湾曲し、M3、M4へリックスが手押しポンプのピストンのように下に下がって、カルシウムイオンを押し出す。この結果、Ca2+は小胞体内腔に放出される(E2P、図2、4右下)。
Aドメインの回転の結果、Pドメインに結合していた燐酸の真上に、AドメインのTGESモチーフが来て燐酸を攻撃する水分子が固定され、加水分解が起こり、その結果、脱燐酸化が起こる。これによってPドメインの変形がなくなり、同時に、AドメインをPドメイン側に引張っていたMg2+もはずれるので、Aドメインの傾きが変わり、M4Lの向きが変わって、内腔側ゲートが閉じられ、最初に戻る。これが、一番エネルギー的には低い状態(E2)である(図2、4左下)。
ATPは何をしているのか?
大事なことは、大きな運動のトリガーとなっているのはADPにせよ、燐酸にせよ、「外れる」ということである。つまり、実際にドメインを動かしているのは熱エネルギーである。ATPはここでは、cleavable crosslinker(切断可能な架橋剤)として働いており、ATPがないと実現できないような構造を蛋白質がとるために使われている[5][5]C. Toyoshima and G. Inesi: Structural basis of ion pumping by Ca2+-ATPase of the sarcoplasmic reticulum. Annu. Rev. Biochem. 73 (2004) 269-92.。それでは、ATPの加水分解によるエネルギーはどこにいったか。いわゆるパワーストロークは無いのであって、加水分解反応のエネルギーを使ってどこかを押すとかいったことは起こっていない。
そのエネルギーは逆反応を抑え、正反応しか実現しないために使われているのではないか。燐酸化にしても同様である。また、いずれの反応でもMg2+が必須であるのは、協同的にすることによって逆反応を抑えているのではないか。熱エネルギーを有効に利用するために、大きなドメイン運動を用い、ATPやMg2+などによってドメイン間インターフェースを変えるという「大きな」調節を行っている。ゲートの開閉にしても、残基レベルではなくへリックスの再配置を使っている。それによって、熱運動という方向性のない確率的に揺らいでいるものから、一定の方向への運動を生み出している。それが、この大きな構造変化が教えていることであろう。
謝 辞
結晶のほとんどは技官の野村博美さん(現、生理研)が、E1·AMPPCPの結晶は修士課程の学生であった水谷龍明君が作製したものである。E1·2Ca2+の最初のモデリング(1EUL)は中迫雅由博士(現、慶応大学)が行った。X線回折実験では他に小川治夫博士(現、ネバダ大学)、津田岳夫博士の協力を得た。SPring-8の実験では各ビームライン担当者の多大な協力を頂いているが、特に、BL41XUの担当者である河本正秀博士には本研究の当初から尽力頂いた。記して、深く感謝申し上げる。
参考文献
[1]C. Toyoshima, M. Nakasako, H. Nomura and H. Ogawa : Crystal structure of the calcium pump of sarcoplasmic reticulum at 2.6 Å resolution. Nature 405 (2000) 647-655.
[2]C. Toyoshima and H. Nomura: Structural changes in the calcium pump accompanying the dissociation of calcium. Nature 418 (2002) 605-611.
[3]C. Toyoshima and T. Mizutani: Crystal structure of the calcium pump with a bound ATP analogue. Nature 430 (2004) 529-535.
[4]C. Toyoshima, H. Nomura and T. Tsuda : Lumenal gating mechanism revealed in calcium pump crystal structures with phosphate analogues. Nature 432 (2004) 361-368.
[5]C. Toyoshima and G. Inesi: Structural basis of ion pumping by Ca2+-ATPase of the sarcoplasmic reticulum. Annu. Rev. Biochem. 73 (2004) 269-92.
豊島 近 TOYOSHIMA Chikashi
東京大学 分子細胞生物学研究所 教授
〒113-0032 東京都文京区弥生1-1-1
TEL:03-5841-8492 FAX:03-5841-8491
e-mail:ct@iam.u-tokyo.ac.jp
1999B0155-CL-np
2000A0236-CL-np
2000B0263-CL-np
2001A0048-CL-np
2001B0068-NL-np
2002A0015-NL1-np
2002B0270-NL1-np
2002B0271-NL1-np
2003A0470-NL1-np
2003A0471-NL1-np
2003B0363-NL1-np
2004A0455-NL1-np
(実験責任者 豊島 近)
使用ビームライン:BL41XU
シフト数:計75シフト
課題番号:C00B44XU-7139N
C01B44XU-7404N
C02A44XU-7333N
C02B44XU-7333N
(実験責任者 豊島 近)
使用ビームライン:BL44XU
シフト数:計28.5シフト








