Volume 28, No.4 Pages 344 - 348
1. 最近の研究から/FROM LATEST RESEARCH
放射光で視た甘味・うま味受容~味覚受容体T1rの構造解析~
Structural analysis of taste receptor type 1 by synchrotron
岡山大学 学術研究院医歯薬学域 Faculty of Medicine, Dentistry and Pharmaceutical Sciences, Okayama University
- Abstract
- 味覚は、日々の食事で食物に含まれる化学物質を感知する生理反応である。味覚の生理反応は、食物中の味物質を味覚受容体タンパク質が結合し、生体内にシグナル伝達するところから始まる。一方、これらの仕組みの理解に欠かせない味覚受容体の構造は、近年まで明らかになっていなかった。筆者らは以前、SPring-8を用いて、ヒトの甘味受容体やうま味受容体に該当するメダカT1r2a/T1r3の味物質結合領域の構造を、味覚受容体として初めて明らかにした。さらに最近、メダカの受容体に限らず、我々ヒトも含めた幅広い動物が持つT1r3に、塩化物イオン結合部位が存在することを、SPring-8を用いた実験で見出し、実際に塩化物イオンがT1rを介して味覚で感知されることを解明した。本稿では、我々にとって身近な現象である甘味やうま味の受容について、SPring-8での放射光実験から見えてきたことを報告する。
1. はじめに
味覚では、食物の中に含まれる化学物質を、甘味・うま味・苦味・酸味・塩味の基本の5つの味に分類して知覚する。我々の口腔内には、これらの味を呈する化学物質を感知する味覚受容体が存在し、味物質を結合して、生体内にシグナル伝達する役割を担っている[1][1] Taruno, A. et al.: Pflugers Arch. 473 (2021) 3-13.。味覚受容体は、基本五味それぞれに存在し、例えば甘味受容体やうま味受容体は、Taste receptor type 1(T1r)と呼ばれるタンパク質で構成されている。ヒトでは、T1r2/T1r3のヘテロ二量体が甘味受容体として機能し、糖などの甘味物質の受容を担う。また、T1r1/T1r3ヘテロ二量体がうま味受容体として機能し、アミノ酸や核酸などのうま味物質の受容を担う。T1rはクラスC型Gタンパク質共役型受容体(GPCR)と呼ばれるタンパク質に分類されており[2][2] Ellaithy, A., Gonzalez-Maeso, J., Logothetis, D. and Levitz, J.: Trends Biochem Sci. 45 (2020) 1049-1064.、細胞外に大きなリガンド結合ドメイン(LBD)を備え、このLBDで糖・アミノ酸・核酸などの主要な味物質を結合し、シグナル伝達することが報告されていた。一方、T1rの味物質認識の仕組みについては、T1rの構造解明が遅れていたため、近年まで明らかになっていなかった。
T1rの構造解明が阻まれていた理由は、構造解析に用いる試料調製のための組換え発現が、極めて困難なことにあった。実際、ヒトT1rの構造は、いまだに解明されていない。一方、上述した基本五味に分類する味覚受容システムは、脊椎動物で保存されており、T1rも、ほとんどの動物に存在する。筆者らは以前、さまざまな動物が持つT1rの発現スクリーニングを実施し、メダカが持つ味覚受容体・T1r2a/T1r3のLBDの試料調製を達成して[3][3] Nango, E., et al.: Sci Rep. 6 (2016) 25745.、SPring-8を利用して結晶構造を解明した[4][4] Nuemket, N. et al.: Nat Commun. 8 (2017) 15530.。この構造は、T1rだけでなく味覚受容体として初めての構造報告例となり、現在でも報告されている唯一のT1r構造である。さらに最近、メダカT1r3に塩化物イオン(Cl–)が結合することをSPring-8での実験から明らかにし、メダカだけでなくヒトも含めた幅広い動物のT1r3にCl–結合部位が存在しており、Cl–の結合によって味覚を引き起こすことを解明した[5][5] Atsumi, N. et al.: eLife 12 (2023) e84291.。本稿では、以前報告した構造決定から最近報告したCl–結合解析まで、SPring-8を利用して行ったT1r構造解析と、そこからわかってきた味覚受容との関連を概説する。
2. 実験方法
メダカ由来T1r2a/T1r3LBDは、ショウジョウバエS2細胞を用いて発現し、タンパク質に融合したFLAGタグを利用して、抗FLAGタグ抗体を用いたアフィニティークロマトグラフィーで、細胞培養上清から精製した。X線溶液散乱実験のための試料調製では、得られた精製タンパク質をさらにゲルろ過カラムクロマトグラフィーで精製した。結晶化のための試料調製では、精製タンパク質のFLAGタグ配列をプロテアーゼ(Factor Xa)で切断除去し、さらに糖鎖をグリコシダーゼ(Endo H)で切断除去した。ついで、抗メダカT1r2a抗体より調製したFab断片をタンパク質に結合させ、ゲルろ過カラムクロマトグラフィーを行なって、T1r2a/T1r3LBD-Fab複合体を精製した。いずれの場合でも、精製バッファーに各種アミノ酸を添加する(あるいはしない)ことで、目的とする味物質結合状態(または非結合状態)のタンパク質試料を調製した。
X線溶液散乱実験は、BL45XUにて、波長1 ÅのX線を用いて実施した。L-グルタミン存在下およびアミノ酸非存在下のT1r2a/T1r3LBD溶液についてそれぞれ測定を行い、PRIMUSを用いて解析したギニエプロットから回転半径を、GNOMを用いて解析した距離分布関数から粒子内最大距離を算出した。
結晶化は、T1r2a/T1r3LBD-Fab複合体を用いて、PEG1000とPEG500を沈殿剤とし、シッティングドロップ蒸気拡散法により行った。ただし、Br–結合結晶については、NaCl存在下で結晶を作製したのち、結晶化溶液中のNaClをNaBrに置換した溶液をソーキングして、結晶中のCl–をBr–に置換した。結晶のX線回折強度データは、BL41XUにて、検出器としてPILATUS3 6M(DECTRIS)を用いて収集した。L-グルタミン(Gln)、L-アラニン(Ala)、L-アルギニン(Arg)、L-グルタミン酸(Glu)、グリシン(Gly)結合状態結晶は波長1.0 Å、L-セレノメチオニン結合状態結晶は波長0.979 Å、Br– / L-グルタミン結合状態結晶は波長0.9194 Å、Cl– / L-グルタミン結合状態結晶は波長1.9 ÅのX線を用いてデータ収集を行った。得られたデータはHKL2000またはXDSを用いて処理し、Phaserを用いて、代謝型グルタミン酸受容体LBD(PDB ID: 2E4U)およびFab断片(PDB ID: 1A6T)構造を利用して、分子置換法により位相を決定した。
3. T1r2a/T1r3へのアミノ酸結合とその作用[3, 4][3] Nango, E., et al.: Sci Rep. 6 (2016) 25745.
[4] Nuemket, N. et al.: Nat Commun. 8 (2017) 15530.
T1r2a/T1r3LBDは結晶化が困難で、当初得られた結晶の回折能も高いものではなかった。そこで、BL41XUの高輝度X線を利用することで、2.2 Å分解能の回折強度データを収集し、立体構造を決定できた[4][4] Nuemket, N. et al.: Nat Commun. 8 (2017) 15530.(図1A)。T1r2a/T1r3LBDの結晶は、同受容体に対する味物質であるL-アミノ酸存在下で作製し、実際、味物質認識を担うと予想されていたT1r2aにL-アミノ酸が結合していることが確認できた。一方、T1r3の該当する部位にも、何らかの物質が結合していることを示す電子密度が観察された。T1r3は、甘味受容体T1r2/T1r3やうま味受容体T1r1/T1r3の共通サブユニットであり、それまで機能は明確になっていなかった。そこで、糖やアミノ酸などT1rの味物質として知られる物質について、BL41XUで異常分散効果を確認可能な核種を含む誘導体を添加して結晶を作製し、異常分散ピークの有無を指標にそれらの結合を調べた。その結果、Seを含有するL-セレノメチオニン存在下の結晶において、T1r3に明瞭な異常分散ピークが確認できたことから、T1r3もL-アミノ酸を結合することが明らかとなった。
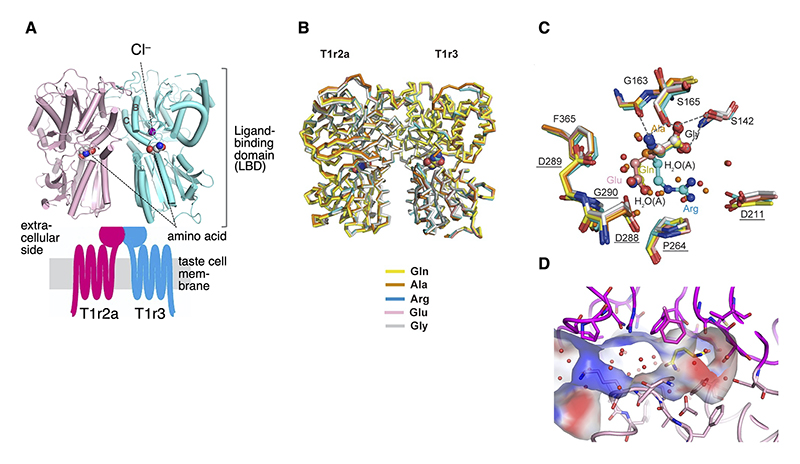
図1 メダカT1r2a/T1r3LBDの結晶構造。(A) T1r2a/T1r3構造の概略図。LBD部分は明らかになった結晶構造を示す。(B) L-グルタミン(Gln)、L-アラニン(Ala)、L-アルギニン(Arg)、L-グルタミン酸(Glu)、グリシン(Gly)結合T1r2a/T1r3LBD構造の重ね合わせ。(C) L-グルタミン、L-アラニン、L-アルギニン、L-グルタミン酸、グリシン結合T1r2aリガンド結合部位の重ね合わせ。図中のアルファベットと数字はT1r2a中の各アミノ酸残基のアミノ酸の1文字表記と残基番号を示す。(D) L-グルタミン結合T1r2aのリガンド結合ポケットの構造。青、赤はそれぞれポケット表面の正、負の静電ポテンシャルを示す。図は文献4, 5より改変転載。
T1r2a/T1r3LBDの構造は、クラスC型GPCRに共通する、Venus flytrap(ハエトリグサ)モジュール構造とよばれる、2つのサブドメインからなる構造をとっていた。そして、味物質となるL-アミノ酸は、この2つのサブドメインの間の隙間に存在する結合部位に結合していた。興味深いことに、L-グルタミン、L-アラニン、L-アルギニン、L-グルタミン酸、グリシンといった、大きさ・電荷・疎水性度などの物理化学的性質の異なるさまざまなL-アミノ酸は、いずれも、T1r2a、T1r3それぞれのサブユニットのアミノ酸結合部位におさまっており、どのアミノ酸が結合していても、T1r2a/T1r3LBDは同じコンフォメーションをとっていることが判明した(図1B, C)。
これらのアミノ酸の結合が、どのようにシグナル伝達を引き起こすのかを明らかにするため、アミノ酸非結合状態の構造解析を試みた。しかし残念ながら、アミノ酸非結合状態では結晶を得ることができなかった。そこで、アミノ酸存在下と非存在下におけるT1r2a/T1r3LBD溶液のX線散乱実験を行い、構造の違いを解析した[3][3] Nango, E., et al.: Sci Rep. 6 (2016) 25745.。その結果、アミノ酸非存在下とくらべ、アミノ酸存在下のT1r2a/T1r3LBDの回転半径や粒子内最大距離は小さく、結晶構造から見積もられる大きさと同程度であることが明らかとなった(同実験は分子科学研究所のNano-Viewerシステムを用いて再現性を確認した; 図2)。したがって、T1r2a/T1r3LBDはアミノ酸の結合に伴い、広がった構造からコンパクトな構造に変化することがわかった。他のクラスC型GPCRでも、アゴニストの結合により、LBDの二量体間が広がった構造から、コンパクトな構造に変化し、この構造変化がシグナル伝達を引き起こすと考えられている[2][2] Ellaithy, A., Gonzalez-Maeso, J., Logothetis, D. and Levitz, J.: Trends Biochem Sci. 45 (2020) 1049-1064.。これらの結果から、T1rについても、アミノ酸が結合することで同様の構造変化が起こっているものと考えられた。
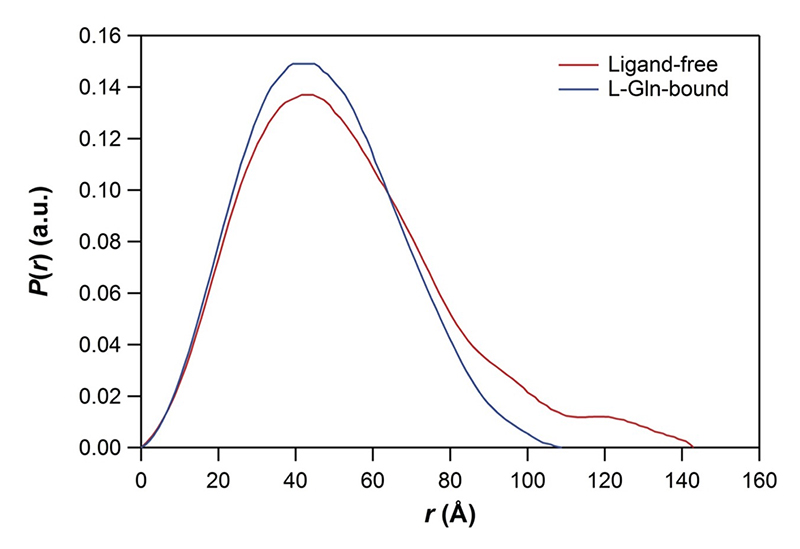
図2 メダカT1r2a/T1r3LBDのX線溶液散乱実験から求めた距離分布関数。赤色はアミノ酸非存在下、青色はアミノ酸L-グルタミン存在下での実験結果を示す。図は文献3より転載。
T1r2aやT1r3のアミノ酸結合部位の構造を調べると、アミノ酸の多様性を生み出す置換基部分を受け入れるポケットは、容量が大きく、モザイク状の電荷分布を示しており、大きさや電荷にかかわらず多様なアミノ酸が結合できる構造となっていた。一方、アミノ酸の共通構造であるα-アミノ基やカルボキシ基は、共通した水素結合ネットワークで結合し、この部分の結合がLBDの構造変化に重要であることがわかった[4][4] Nuemket, N. et al.: Nat Commun. 8 (2017) 15530.(図1C, D)。以上、放射光実験からわかったことと、実際の味覚との関連を考察すると、T1r2a/T1r3LBDの構造は、それまでに構造が報告されていた神経伝達物質などの生理活性物質の受容体とは異なる、味覚受容体特有の機能を示していることがわかった。生理活性物質受容体は、特定の生理活性物質を特異的に認識する機能が求められる。一方味覚では、食物に含まれる幅広い味物質を、限られた種類の受容体で認識する必要があることから、幅広い基質特異性を持つ受容体が多く見られる。例えばヒトの甘味受容体T1r2/T1r3が、単糖、二糖からオリゴ糖、さまざまな化学構造を持つ人工甘味料、甘味タンパク質まで、さまざまな物質に応答することもその一例である。実際、メダカT1r2a/T1r3は、幅広いL-アミノ酸に結合・応答することがわかっている[4, 6][4] Nuemket, N. et al.: Nat Commun. 8 (2017) 15530.
[6] Yoshida, T. et al.: PLoS One 14 (2019) e0218909.。今回放射光で視たT1r2a/T1r3LBDのアミノ酸結合部位は、幅広いアミノ酸を結合し、シグナル伝達につなげる仕組みをうまく説明できる構造を備えていた。
4. T1r2a/T1r3への塩化物イオン結合とその作用[5][5] Atsumi, N. et al.: eLife 12 (2023) e84291.
上述したアミノ酸結合状態の結晶構造解析を進めていた過程で、T1r3内のアミノ酸結合部位の上部に、アミノ酸の他に、水分子またはイオンと思われる物質が結合していることが見出された。結合距離や電子密度、結合部位を構成するアミノ酸の性質から、その物質がCl–なのではないかと推測された(図1A)。
そこでまず、この物質が本当にCl–であるかどうかを確認するために、タンパク質結晶化に用いた溶液中のCl–をBr–に置換した結晶を作製した。Br–であれば、BL41XUで実験可能な波長域で異常分散効果を確認することができるからである。実際に、Brの特性吸収端近傍波長でデータ収集を行ったところ、元の結晶ではCl–と思われる物質が結合していた部位に、Br–由来と思われる異常分散ピークが明確に確認され、この部位に確かにハロゲンイオンが結合できることを確認した(図3A)。
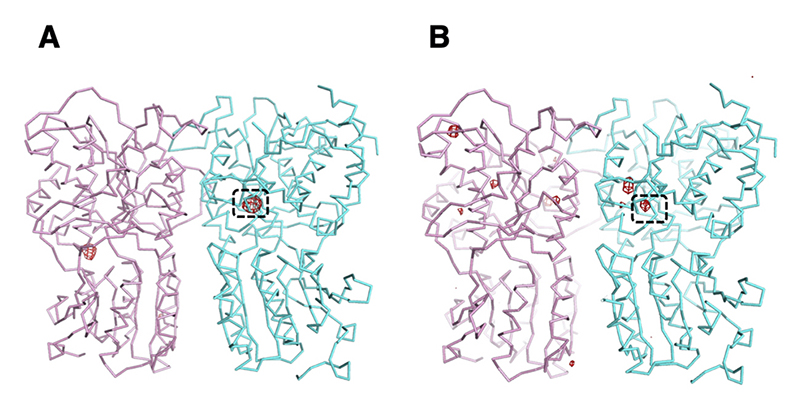
図3 異常分散効果を利用したメダカT1r2a/T1r3LBDにおけるイオン結合解析。(A) Br-結合結晶。(B) Cl–結合結晶。赤色の電子密度はいずれも4.5 rmsdの異常分散差フーリエピークを示す。図は文献5より転載。
さらに、元の結晶では実際にCl–が結合しているのかを確認するため、Cl–結合状態結晶の回折強度データを、BL41XUで実験可能な範囲としては最長の波長となる1.9 ÅのX線を用いてデータ収集した。この波長は、Clの特性吸収端波長(4.39 Å)からは離れているものの、Cl–も弱い異常分散シグナルを示すことが期待できる。一方で、Cl–だけではなく、タンパク質結晶に含まれうるSやCaなども同程度に弱いシグナルを示すことも予想される。そこで得られたデータを慎重に解析したところ、T1r3に結合しているCl–位置に異常分散ピークが確認され、その他に確認されたピークは全て、タンパク質のメチオニン残基やシステイン残基のS原子に由来するものであることがわかった。この結果は、Photon FactoryのBL-1Aにて、さらに長波長の2.7 ÅのX線を用いた実験でも、再現性を確認することができた(なお、原著論文[5][5] Atsumi, N. et al.: eLife 12 (2023) e84291.では、より長波長で測定したPhoton Factoryでの実験データを報告している; 図3B)。先ほどのハロゲンイオン結合実験結果とも考え合わせると、T1r3には確かにCl–が特異的に結合する部位が存在することが明らかになった。
メダカT1r3に結合しているCl–には、Thr105の側鎖の水酸基と、Gln148-Ser149の主鎖アミド基が配位していることがわかった(図4)。調べると、Thr105に相当するアミノ酸と、Gln148-Ser149近傍のアミノ酸配列は、メダカだけでなく、ヒトも含めたほとんどの動物のT1r3に保存されていることがわかり、これらの動物のT1rもCl–結合能を有することが示唆された。
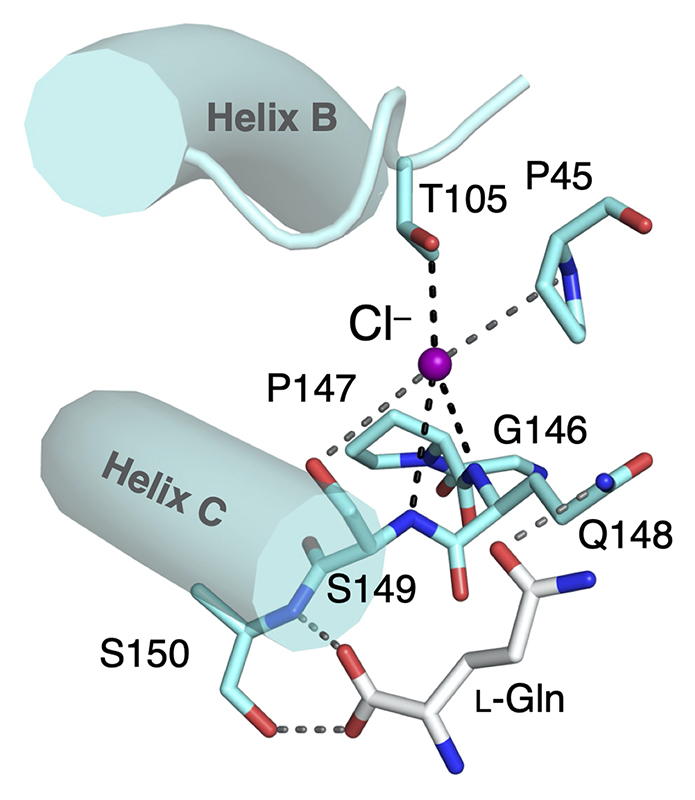
図4 メダカT1r3のCl–結合部位とアミノ酸結合部位。図中のアルファベットと数字はT1r3中の各アミノ酸残基のアミノ酸の1文字表記と残基番号を示す。Helix B, CはT1r2a/T1r3LBDの二量体界面を構成するヘリックス構造(図1A図中にB, Cと示すヘリックス構造)。図は文献5より転載。
放射光実験で初めて見つかったこのCl–結合が、T1rにどのような作用をもたらすかについては、知る限りにおいて、これまで調べられた例がなかった。そこでまず、メダカT1r2a/T1r3LBDを用いて調べたところ、Cl–は、結晶状態だけでなく溶液状態のタンパク質にも確かに結合し、結合によってLBDの構造変化を引き起こすことがわかった。さらにこの構造変化は、アミノ酸などの従来の味物質が引き起こすものと同様の変化であることが示唆された。実際、Cl–の結合部位も、味物質アミノ酸の結合部位も、シグナル伝達と関連する構造変化が起きるLBD二量体界面の近傍にあり(図1A、図4)、これらの結合と解離が二量体構造変化を引き起こすものと考えられる。
以上、放射光実験からわかったことと、実際の味覚との関連を考察すると、食塩の味覚受容にT1rが関与する可能性が考えられた。塩味は、食塩の成分であるNa+が塩味受容体ENaCに作用して引き起こされる味覚であると理解されている[1][1] Taruno, A. et al.: Pflugers Arch. 473 (2021) 3-13.。一方、ENaCがNa+に応答する濃度域よりも低い数mM程度の食塩水は、甘いと感じられることが報告されていた[7][7] Bartoshuk, L.M., Murphy, C. and Cleveland, C.T.: Physiol Behav. 21 (1978) 609-613.。上述したように、Cl–の結合部位が動物種を超えてT1r3に保存されていること、低濃度食塩水の甘味はヒト甘味受容体T1r2/T1r3の阻害作用を持つギムネマ酸で阻害されること[7][7] Bartoshuk, L.M., Murphy, C. and Cleveland, C.T.: Physiol Behav. 21 (1978) 609-613.、さらに上述したメダカT1r2a/T1r3に対するCl–の作用濃度(EC50値)が約1 mM程度であることを考え合わせると、食塩の塩味成分・Na+の対アニオンであるCl–は、実は甘味やうま味の受容に関わるT1rで感知されている可能性が考えられる。実際我々も、マウスを用いた検証実験を行い、T1rからのシグナルを伝達する味神経は、Cl–のみの添加でも応答を示すこと、マウスは純水よりもCl–を含む水を好んで多く飲むこと、これらの反応・行動は、T1rの阻害薬で阻害されることを確認した[5][5] Atsumi, N. et al.: eLife 12 (2023) e84291.。このことから、少なくともマウスでは、Cl–は実際にT1rを介して味覚で感知されることが証明された。
5. おわりに
我々は光を使って物を見る視覚によって、そのものがどういうもので、どういうことが起こっているのかを理解する。一方同じ五感の中でも、味覚は、化学物質を認識する化学感覚として知られる。今回の一連の実験では、日々経験しているはずの味覚においても、実際に放射光という光を使って視ることで、初めて明らかになる、あるいは実は経験しているはずの現象の仕組みがわかる、という結果がもたらされた。このことは、放射光を利用した構造研究の重要性をあらためて感じさせる。味覚受容には、まだまだ解明されていない様々な謎が多く残っている。今後も、放射光利用と他の手法による解析を連関した受容体構造研究を進めていくことで、生命を支える摂食と大きな関わりを持つ味覚受容の仕組みを明らかにしていきたい。
本研究はBL41XU、BL45XUを利用し、理研ビームライン利用研究課題No. 20120003、SPring-8利用研究課題No. 2013A1162、2013B1113、2014A1085、2014A1859、2014B1147、2014B2021、2015A1074、2015B2074、2016A2534にて実施しました。また、理研・南後恵理子博士、Nipawan Nuemket博士、芦川雄二博士(研究当時)、岡山大学・安井典久博士、渥美菜奈子氏をはじめとする多くの共同研究者のご協力のもとに実施しました。放射光実験について多大なご支援をいただいたJASRI・熊坂崇博士、長谷川和也博士、理研・山本雅貴博士、引間孝明博士をはじめとするビームラインサイエンティストの方々、共同研究者の方々にこの場を借りて心より感謝申し上げます。
参考文献
[1] Taruno, A. et al.: Pflugers Arch. 473 (2021) 3-13.
[2] Ellaithy, A., Gonzalez-Maeso, J., Logothetis, D. and Levitz, J.: Trends Biochem Sci. 45 (2020) 1049-1064.
[3] Nango, E., et al.: Sci Rep. 6 (2016) 25745.
[4] Nuemket, N. et al.: Nat Commun. 8 (2017) 15530.
[5] Atsumi, N. et al.: eLife 12 (2023) e84291.
[6] Yoshida, T. et al.: PLoS One 14 (2019) e0218909.
[7] Bartoshuk, L.M., Murphy, C. and Cleveland, C.T.: Physiol Behav. 21 (1978) 609-613.
岡山大学 学術研究院医歯薬学域
〒700-8530 岡山県岡山市北区津島中1-1-1
TEL : 086-251-7974
e-mail : a_yama@okayama-u.ac.jp








