Volume 27, No.1 Pages 2 - 5
1. 最近の研究から/FROM LATEST RESEARCH
保湿剤の肌ナノ構造への作用メカニズム解明と製品化
Elucidation of the Mechanism of Moisturizers on Skin Nanostructures and Commercialization of Moisturizers
[1]阪本薬品工業(株) 研究所 Research & Development Center, Sakamoto Yakuhin Kogyo Co., Ltd.、[2](公財)名古屋産業科学研究所 研究部 Department of Research, Nagoya Industrial Science Research Institute
- Abstract
- 代表的な保湿剤のグリセリンは保湿効果に優れるが、実際の皮膚への作用メカニズムは解明されていない。本研究では、ヒト角層に保湿剤を作用し乾燥時の構造変化をX線構造解析法にて評価した。構造の動的振舞いを30秒ごとに追跡することで、角層中の僅か0.1%程度の構造変化が評価可能となり、保湿剤の分子レベルでの作用メカニズムが明らかとなった。その結果、グリセリンが角層中の角層細胞に入りソフトケラチン構造に作用し水を蓄える機能を高め、また細胞間脂質の炭化水素鎖の充填構造を安定化し水分量を制御する機能を高めることを見出した。これまでグリセリンの保湿機序は、脂質モデル系の実験から液晶状態が誘起されることが因子とされていたが、これとは異なる機序であることを明らかにした。また、ジグリセリンは細胞間脂質の安定化に強く作用するため、グリセリン/ジグリセリン混合系が保湿能をさらに高めることが分かった。
1. はじめに
人の皮膚最外層には厚さ約20 μmの角層と呼ばれる組織が存在している。角層は角層細胞とそれを取り囲むような細胞間脂質がレンガ・モルタルのように積み重なって構成されており、水を蓄え体内からの過剰な水分蒸散を制御する機能を持つ。しかし、低湿度な乾燥条件に長く晒されることで、角層の水分が失われ乾燥肌が誘発される。この乾燥肌の改善を目的に、保湿剤を配合した化粧品が用いられる。
グリセリンは安全性が高く、角層の水分量を高める効果を示すため、古くから保湿剤として化粧品や外用剤に経験的に配合されてきた[1][1] M. Lodén: J. Eur. Acad. Dermatol. Venereol 19 (2005) 672-688.。しかし、汎用の保湿剤のグリセリンでさえ、実際の皮膚への作用メカニズムは十分に解明されておらず、ナノレベルでの保湿剤の作用メカニズムの解明と保湿効果に優れた保湿剤の開発が望まれていた。
角層の水のほとんどは、ソフトケラチンと呼ばれるタンパク質が詰まった角層細胞内に蓄えられており、角層細胞は角層内の水を保持する上で重要な役割を果たすと考えられている。細胞間脂質はセラミドを主成分とする両親媒性の脂質であり、ラメラ構造と呼ばれる層状の分子集合体を形成し、長軸方向の繰り返し周期間隔が異なる長周期ラメラ構造および短周期ラメラ構造で構成されている[2][2] J. A. Bouwstra, G. S. Gooris, J. A. van der Spek and W. Bras: J. Invest. Dermatol. 97 (1991) 1005-1012.。これらのうち短周期ラメラ構造には水層が存在し、角層の水分調節に重要な役割を果たすとされている。ラメラ周期方向に直交する横断面では炭化水素鎖の充填構造として0.42 nmの六方晶および0.42 nmと0.37 nmの直方晶の格子定数が広角X線回折によって観測される[3][3] J. A. Bouwstra, G. S. Gooris, M. A. S. Vries, J. A. van der Spek and W. Bras: Int. J. Pharm. 84 (1992) 205-216.。これらの炭化水素鎖の充填構造のうち直方晶系は、短周期ラメラ構造と同じドメインに由来することが報告されている[4][4] I. Hatta, N. Ohta, K. Inoue and N. Yagi: Biochim. Biophys. Acta 1758 (2006) 1830-1836.。これまでにヒト角層を用いた研究において角層細胞内のソフトケラチン構造は、角層の水分量に応じて変化する報告があり、細胞間脂質が形成する短周期ラメラ構造の層間の僅かな水に関しても、角層の水分制御に重要な役割を果たすと考えられている(図1)。しかし保湿剤の作用メカニズムに関しては未だ明らかとなっていない[5][5] H. Nakazawa, N. Ohta and I. Hatta: Chem. Phys. Lipids 165 (2012) 238-243.。
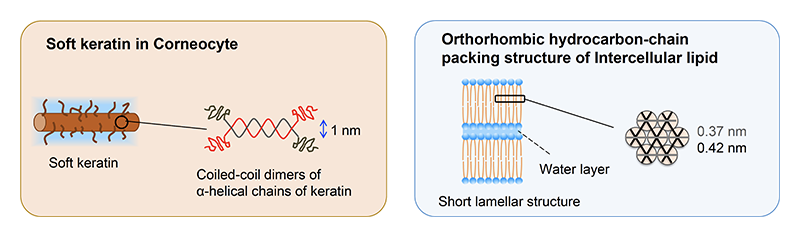
図1 水が作用することにより変化する構造。ここに示した角層構造の水が入る部分にグリセリン水溶液およびジグリセリン水溶液が入る。
本研究では、角層細胞と細胞間脂質中にある2つの構造に着目し、角層への保湿剤の作用メカニズムを検討した(図1参照)。角層のナノ構造の解析には高輝度放射光施設SPring-8のX線回折装置を用い、新たな評価方法を開発することで、従来の方法では検出が難しかった微細な角層構造の変化についての観察を可能とした。具体的には、これまで角層の溶液の湿潤評価に使われていた溶液セル[6][6] I. Hatta, H. Nakazawa, Y. Obata, N. Ohta, K. Inoue and N. Yagi: Chem. Phys. Lipids 163 (2010) 381-389.を応用し、保湿剤で湿潤した角層試料の乾燥過程における時間ごとの構造変化を動的に追跡した。
2. 実験方法
ここに示すX線回折実験はSPring-8のビームラインBL40B2とBL19B2にて実施した。角層試料は、乾燥したヒト皮膚角層を1 cm2に切り出し、八田らによって開発された溶液セルに無配向となるように充填した[6][6] I. Hatta, H. Nakazawa, Y. Obata, N. Ohta, K. Inoue and N. Yagi: Chem. Phys. Lipids 163 (2010) 381-389.。溶液セル中の角層試料は、ファイバーガラス製フィルターで固定し、セルの前面と背面をポリエーテルエーテルケトンフィルムで角層試料を挟み封入した。角層試料への溶液処理は、溶液セルに保湿剤の水溶液または精製水を注入し、角層を120分間浸漬した。角層の乾燥過程では、0.3 Lmin-1の乾燥窒素ガスを溶液セルに通して、溶液処理した角層を乾燥させた。乾燥工程中の角層の構造変化の検出には、2次元半導体検出器PILATUS 2Mを用いた。BL40B2での測定条件としてX線波長は0.083 nm、サンプルから検出器までの距離は約570 mm、X線照射時間を20秒に設定し30秒間隔の時間分解にて角層の構造変化を観察した。保湿剤の水溶液には、阪本薬品工業製のグリセリンまたはジグリセリンの10 wt%水溶液を用いた。
3. 実験結果と考察
水和した角層のX線散乱プロファイルの乾燥時の変化を図2に示す。角層細胞中のソフトケラチンに由来するブロードなピークが6 nm-1に観察された。これはソフトケラチンを構成する2つのケラチンのαヘリックス鎖の間隔(~1 nm)と考えられている[5,7][5] H. Nakazawa, N. Ohta and I. Hatta: Chem. Phys. Lipids 165 (2012) 238-243.
[7] J. C. Garson, J. Doucet, G. Tsoucaris and J. L. Leveque: J. Soc. Cosmet. Chem. 41 (1990) 347-358.。また、細胞間脂質が形成する短周期ラメラ構造の直方晶系炭化水素鎖の充填構造(格子定数0.42および0.37 nm)に起因する2つの鋭いピークが15 nm-1付近に観察された。
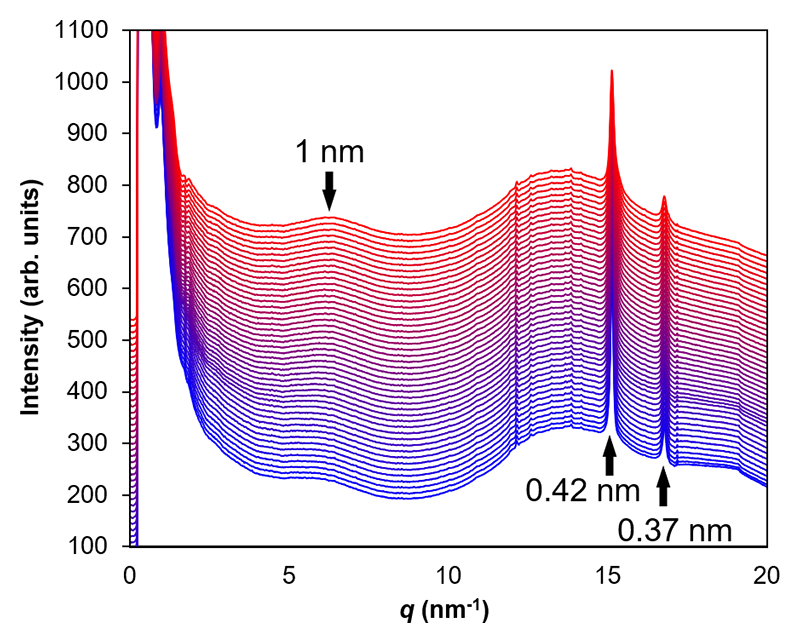
図2 X線散乱プロファイル。ソフトケラチン由来の構造(1 nm)と直方晶の炭化水素鎖の充填構造(0.42 nm、0.37 nm)。
水処理した角層の角層細胞中のソフトケラチンのαヘリックス鎖の約1 nm間隔の変化を図3(a)に示す。水和により拡大したソフトケラチン由来の構造の間隔は、乾燥の開始とともに急速に減少が見られた。乾燥により角層の水分が減少し、αヘリックス鎖間隔が収縮したと考えられる。一方、グリセリン水溶液で処理した角層においてもソフトケラチンの間隔は乾燥により減少が見られたが、水で処理した角層の傾きよりも緩やかに減少した(図3(b))。また、ジグリセリン水溶液で処理したものは水と同様に急激な現象が見られた。これらの結果は、水やグリセリンが角層細胞に浸透していることを裏付けており、グリセリンは角層細胞内からの水の蒸散を防ぐのに重要な役割を果たすことが示唆された。
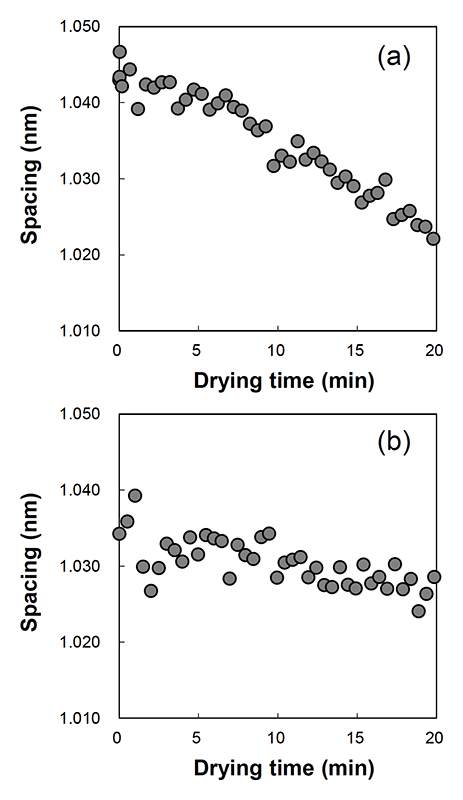
図3 (a) 水処理した角層、および、(b) グリセリン水溶液処理した角層のαヘリックス鎖の間隔。
細胞間脂質が構成するラメラ構造の炭化水素鎖の充填構造の変化を解析した。角層を用いたX線構造解析において細胞間脂質の炭化水素鎖の充填構造は、これまで着目されてこなかったが、本研究で見出した乾燥時の構造変化の動的な評価法を用いることで、僅か0.1%程度ではあるが、水の影響により特徴的な変化をすることを見出した。
格子定数0.42 nmと0.37 nmのピークは同様の振舞いであったため、代表として格子定数0.42 nmの結果を以下に示す。水処理した角層の炭化水素鎖の充填構造の格子定数の変化を示す(図4)。水和により拡大した充填構造の格子定数は、乾燥により急激に縮小し、縮小した状態を保ち、さらに乾燥すると増大した状態に変化した。また、格子定数0.42 nmのピークの半値全幅は、格子定数が縮小した状態において狭く、格子定数の増大に伴い広くなることが確認されたことより、乾燥時に見られた細胞間脂質の構造が縮小した状態は、秩序性が高い安定な構造であると考えられる。細胞間脂質が形成するラメラ構造は、その水層に適度な水が存在することで細胞間脂質の極性頭部に作用し安定化すると考えられている。また、ラメラ構造の安定化により過剰な水分蒸散が抑えられると考えられることから[5][5] H. Nakazawa, N. Ohta and I. Hatta: Chem. Phys. Lipids 165 (2012) 238-243.、角層の乾燥時における細胞間脂質の安定な構造の保持は、乾燥条件下においても皮膚の水分を正常に保つ仕組みがあることを意味する。
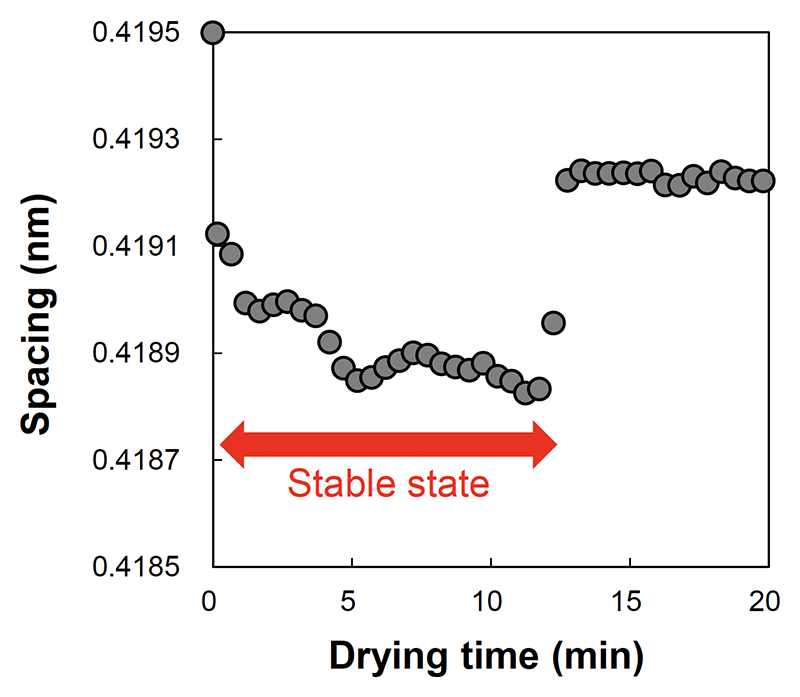
図4 水処理した角層の炭化水素鎖の充填構造の格子定数
角層中の水分を正常に保つと考えられる、充填構造が安定な時間について、水、グリセリンおよびジグリセリンの影響を比較した(表1)。充填構造が安定な時間は、水<グリセリン<ジグリセリンの順に長くなった。また、保湿剤で処理したものでは、格子定数が縮小し安定した状態からの変化が緩やかになった[8][8] T. Yamada, A. Habuka and I. Hatta: International Journal of Cosmetic Science 43 (2021) 38-47.。この結果より、保湿剤のグリセリン、特にジグリセリンは短周期ラメラ構造の水層間で細胞間脂質に作用することで短周期ラメラ構造を安定化し、角層が持つ水分を制御する機能を高めたと考えられる。ジグリセリンは炭素骨格がグリセリンよりも長く、やや疎水的な構造であり、細胞間脂質のより多くの極性頭部に作用できるため充填構造を安定化したと推察する。
表1 炭化水素鎖の充填構造が安定な状態の持続時間
| 溶 液 | 安定状態の 持続時間(min) |
| 水 | 12.8 |
| 10 wt% グリセリン | 13.5 |
| 10 wt% ジグリセリン | 16.3 |
4. まとめ
本研究では、保湿剤のグリセリンとジグリセリンがヒト角層にどのように作用するかをX線回折装置で検討した。結果、保湿剤のグリセリンは角層細胞内に浸透し、ソフトケラチンに作用し角層細胞の水を蓄える機能を増強したと考えられる。また、グリセリンやジグリセリンは細胞間脂質の構造を安定化させ、角層の水分を制御する機能を高めると考えられた。これまでグリセリンの保湿機序は、脂質モデル系の実験から液晶状態が誘起されることが因子であるという保湿メカニズムが支持されてきた[9][9] C. L. Froebe, F. A. Simion, H. Ohlmeyer, L. J. Rhein, J. Mattai, R. H. Cagan and S. E. Friberg: J. Soc. Cosmet. Chem. 41 (1990) 51-65.。しかし、角層による結果はこれと大きく異なることを明らかにした。また、本報告では詳しく触れなかったが、細胞間脂質に強く作用する保湿剤のジグリセリンをグリセリンと組み合わせた混合系は、相乗的に保水機能を高めることを裏付ける結果も得ている[8][8] T. Yamada, A. Habuka and I. Hatta: International Journal of Cosmetic Science 43 (2021) 38-47.。実際にグリセリンとジグリセリンの混合系を塗布した肌は高い角層水分量を保持することから、高機能な保湿剤として製品化に至った。これを応用することで科学的根拠に基づいた保湿効果の高い化粧品を開発することが期待できる。
謝辞
放射光実験はSPring-8一般課題 課題番号2016A1508、2016B1578、2017A1559、2017A1821、2017B1607、2017B1910、2018A1542、2018B1601、2019B1720として行われました。測定および解析にご支援をいただいたBL40B2の太田昇博士、BL19B2の大坂恵一博士に感謝の意を表します。
参考文献
[1] M. Lodén: J. Eur. Acad. Dermatol. Venereol 19 (2005) 672-688.
[2] J. A. Bouwstra, G. S. Gooris, J. A. van der Spek and W. Bras: J. Invest. Dermatol. 97 (1991) 1005-1012.
[3] J. A. Bouwstra, G. S. Gooris, M. A. S. Vries, J. A. van der Spek and W. Bras: Int. J. Pharm. 84 (1992) 205-216.
[4] I. Hatta, N. Ohta, K. Inoue and N. Yagi: Biochim. Biophys. Acta 1758 (2006) 1830-1836.
[5] H. Nakazawa, N. Ohta and I. Hatta: Chem. Phys. Lipids 165 (2012) 238-243.
[6] I. Hatta, H. Nakazawa, Y. Obata, N. Ohta, K. Inoue and N. Yagi: Chem. Phys. Lipids 163 (2010) 381-389.
[7] J. C. Garson, J. Doucet, G. Tsoucaris and J. L. Leveque: J. Soc. Cosmet. Chem. 41 (1990) 347-358.
[8] T. Yamada, A. Habuka and I. Hatta: International Journal of Cosmetic Science 43 (2021) 38-47.
[9] C. L. Froebe, F. A. Simion, H. Ohlmeyer, L. J. Rhein, J. Mattai, R. H. Cagan and S. E. Friberg: J. Soc. Cosmet. Chem. 41 (1990) 51-65.
阪本薬品工業(株) 研究所
〒594-1157 大阪府和泉市あゆみ野3-1-62
TEL : 0725-51-3317
e-mail : yamada@sy-kogyo.co.jp
阪本薬品工業(株) 研究所
e-mail : habuka@sy-kogyo.co.jp
(公財)名古屋産業科学研究所 研究部
e-mail : ichirohatta@gmail.com








