Volume 26, No.2 Pages 98 - 100
1. 最近の研究から/FROM LATEST RESEARCH
(JASRI理事長ファンド採択研究課題)
試料環境制御によるタンパク質結晶の構造多様性解析法の開発
Development of Protein Crystal Structural Analysis Method by Temperature and Humidity Control
(公財)高輝度光科学研究センター 放射光利用研究基盤センター タンパク質結晶解析推進室 Protein Crystal Analysis Division, Center for Synchrotron Radiation Research, JASRI
- Abstract
- X線結晶構造解析法は、タンパク質立体構造の解析手法として使われています。放射光ビームラインは高輝度なX線が利用でき、放射線損傷を低減するために100 K以下に凍結した結晶からの回折実験が広く利用されてきました。しかし近年、X線自由電子レーザーにより非凍結結晶からの無損傷での時分割実験が可能となり、放射光においても非凍結結晶からの構造解析の手法開発が進んでいます。我々は、SPring-8の高輝度X線を利用し、非凍結環境でタンパク質の構造多様性を解析する手法について開発を進めてきましたので、その成果を報告します。
1. はじめに
SPring-8のような大型放射光施設のX線を利用したタンパク質X線結晶構造解析においては、結晶のX線照射損傷の抑制が重要であり、抗凍結剤を用いて凍結したタンパク質結晶からのデータ測定が普及しました。近年、測定と解析のさらなる自動化が進み、高効率化が進んでいます。一方で、100 K以下に凍結された結晶から得られた構造は、室温の構造と比較して部分的な構造変化も報告されており、タンパク質の機能を理解する上で、生理活性状態を捉える室温測定の重要性が再認識され、測定方法についても検討が進んでいます。X線自由電子レーザー施設(XFEL)のフェムト秒のX線レーザーは無損傷での測定が可能となるため、非凍結結晶からの回折実験手法として光励起による結晶内での反応制御など、結晶内の化学反応の時分割実験が可能となりました。我々は、非凍結環境でタンパク質の構造解析を行う手法として、タンパク質結晶を水溶性高分子でコーティングし、調湿ガスを吹き付けて環境を制御する方法を開発しました。
2. HAG法を用いた構造多様性の解析
タンパク質の結晶は多くの水分(50%程度)を含んでいて脆く、環境の変化(温度、結晶周囲の溶媒組成の変化)によって劣化しやすく、結晶化溶媒から出した状態で品質を保持することが問題でした。抗凍結剤による結晶凍結が一般化する以前は、ガラスキャピラリーに結晶とともに母液を封入して結晶の質を保持する手法を用いて測定を行っていました。タンパク質結晶の凍結方法が普及して一般的に利用されるようになっても、非凍結での測定にはキャピラリーが用いられていました。しかし2000年代に、一定の湿度を保った気流を結晶に吹き付けて質を保持する調湿装置が開発され、湿度を調整することで結晶の品質を改善する方法なども報告されました。
我々は、結晶周囲の湿度を制御する調湿装置の開発のみでなく、結晶を水溶性高分子であるポリビニルアルコール(PVA)水溶液でコーティングする方法を組み合わせた新しい結晶マウント法(Humid Air and Glue-coating (HAG) method:HAG法)をBL38B1で開発しました[1][1] S. Baba, T. Hoshino, L. Ito and T. Kumasaka: Acta Cryst. D 69 (2013) 1839-1849. (doi: 10.1107/S0907444913018027)。PVAで結晶をコーティングすることで結晶の乾燥を防ぎ、結晶の品質を保持したまま回折実験を行うことが可能です(図1)。さらに、がんの発生に関わるタンパク質Rasの結晶構造解析においては、従来から解明されているGTP結合型のClose状態(State2)のみでなく、湿度制御による構造変化を解析することで、X線結晶構造解析ではこれまで得られなかったOpen状態(State1)の構造解析に成功しました(図2)[2][2] S. Matsumoto, N. Miyano, S. Baba, J. Liao, T. Kawamura et al.: Scientific Reports 6 (2016) 25931. (doi: 10.1038/srep25931)。

図1 HAG法を用いた回折実験。(A) 調温調湿装置で調湿気流をゴニオ上の試料へ向けて吹き付けた状態の回折実験の様子。(B) リゾチーム結晶を調湿した様子(ループ垂直方向)。(C) リゾチーム結晶を調湿した様子(ループ水平方向)。
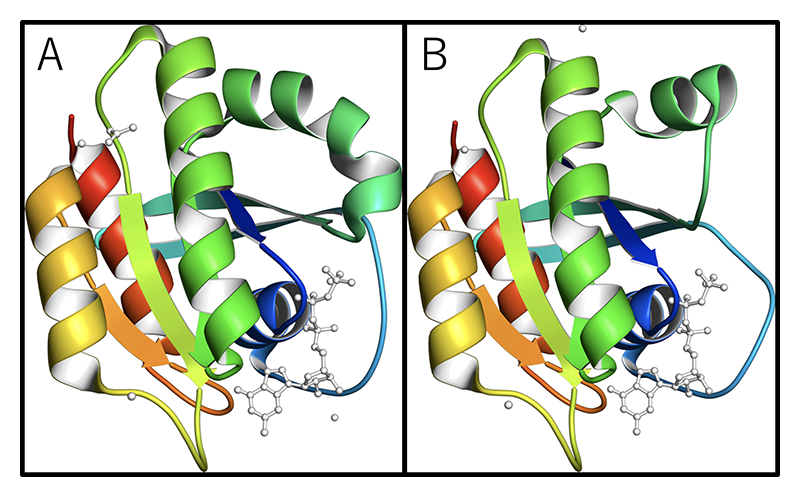
図2 Rasタンパク質結晶の構造解析。(A) State2(PDB ID:3K8Y)。(B) State1(PDB ID:5B30)。
タンパク質の結晶化条件として温度は重要な因子であり、4°Cなどの低い温度で得られた結晶は、室温などの昇温条件下で結晶の質が顕著に劣化する場合があります。牛由来のチトクロム酸化酵素(CcO)は4°Cで結晶化されており、結晶の質を保つためには実験中に結晶を4°Cに保持する必要がありました。そこで我々は、4°Cに保って結晶をハンドリングするワークベンチと、4−20°Cの温度制御機構を備えた独自の調湿装置を開発し、4°C環境下で90%RH以上の高湿度を保てる回折実験環境を構築しました[3][3] S. Baba, A. Shimada, N. Mizuno, J. Baba, H. Ago et al.: J. Appl. Cryst. 52 (2019) 699-705. (doi: 10.1107/S1600576719006435)。兵庫県立大の島田(現 岐阜大)らは、この技術を用いてSACLAでCcOの時分割実験に成功しています(図3)[4][4] A. Shimada, M. Kubo, S. Baba, K. Yamashita, K. Hirata et al.: Science Advances 3 (2017) e1603042. (doi: 10.1126/sciadv.1603042)。またSPring-8においては、大阪医科大の村川らが銅アミン酸化酵素結晶の温度、pH環境を変えた非凍結環境で構造を解析し、構造の平衡状態の変化を明らかにしました(図4)[5][5] T. Murakawa, S. Baba, Y. Kawano, H. Hayashi, T. Yano et al.: PNAS 116 (2019) 135-140. (doi: 10.1073/pnas.1811837116)。

図3 CcOタンパク質結晶の構造解析(PDB ID:5X1B)。
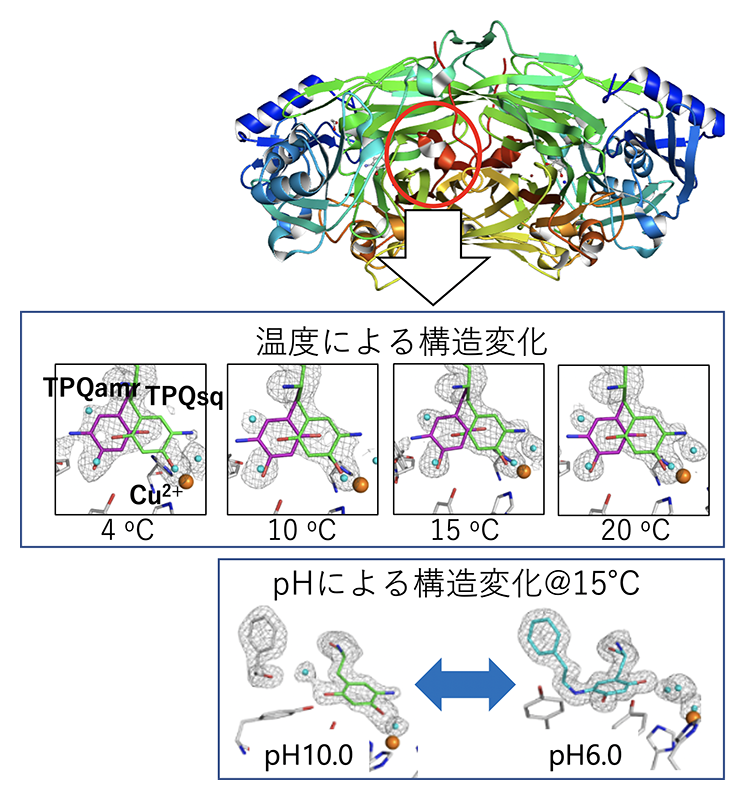
図4 銅アミン酸化酵素の結晶構造解析(PDB ID:5ZOU)。
3. 今後の展開
これまでベンディングマグネットビームライン(BM-BL)で研究開発を進め、100 μm以上のサイズの結晶をターゲットに温度(4−20°C)、湿度を回折実験環境下で制御し、タンパク質結晶からの多様な構造情報を得ることが可能となりました。さらに我々は、挿入光源ビームライン(ID-BL)のBL41XUの光源を用い、我々のグループの長谷川らが開発した多数の微小結晶にX線を網羅的に照射するデータ収集法serial synchrotron rotation crystallography(SS-ROX)[6][6] K. Hasegawa, K. Yamashita, T. Murai, N. Nuemket, K. Hirata et al.: J. Synchrotron Rad. 24 (2017) 29-41. (doi: 10.1107/S1600577516016362)とHAG法を組み合わせることで微小結晶からの非凍結データ測定手法を開発しています[7][7] K. Hasegawa, S. Baba, T. Kawamura, M. Yamamoto and T. Kumasaka: Acta Cryst. D 77 (2021) 300-312. (doi: 10.1107/S2059798321001686)。これらの技術を基に、今後もタンパク質の時分割構造解析や構造多様性の研究をSPring-8で進展していきます。
参考文献
[1] S. Baba, T. Hoshino, L. Ito and T. Kumasaka: Acta Cryst. D 69 (2013) 1839-1849. (doi: 10.1107/S0907444913018027)
[2] S. Matsumoto, N. Miyano, S. Baba, J. Liao, T. Kawamura et al.: Scientific Reports 6 (2016) 25931. (doi: 10.1038/srep25931)
[3] S. Baba, A. Shimada, N. Mizuno, J. Baba, H. Ago et al.: J. Appl. Cryst. 52 (2019) 699-705. (doi: 10.1107/S1600576719006435)
[4] A. Shimada, M. Kubo, S. Baba, K. Yamashita, K. Hirata et al.: Science Advances 3 (2017) e1603042. (doi: 10.1126/sciadv.1603042)
[5] T. Murakawa, S. Baba, Y. Kawano, H. Hayashi, T. Yano et al.: PNAS 116 (2019) 135-140. (doi: 10.1073/pnas.1811837116)
[6] K. Hasegawa, K. Yamashita, T. Murai, N. Nuemket, K. Hirata et al.: J. Synchrotron Rad. 24 (2017) 29-41. (doi: 10.1107/S1600577516016362)
[7] K. Hasegawa, S. Baba, T. Kawamura, M. Yamamoto and T. Kumasaka: Acta Cryst. D 77 (2021) 300-312. (doi: 10.1107/S2059798321001686)
(公財)高輝度光科学研究センター
放射光利用研究基盤センター タンパク質結晶解析推進室
〒679-5198 兵庫県佐用郡佐用町光都1-1-1
TEL : 0791-58-0833
e-mail : baba@spring8.or.jp








