Volume 24, No.4 Pages 365 - 370
1. 最近の研究から/FROM LATEST RESEARCH
(SPRUC 2019 Young Scientist Award受賞 研究報告)
エンドセリン受容体B型の構造機能活性相関の解明
Structural and Functional Analyses of the Human Endothelin ETB Receptor
東京大学 大学院理学系研究科 Graduate School of Science, The University of Tokyo
- Abstract
- ペプチドホルモンであるエンドセリン-1はGタンパク質共役受容体であるエンドセリン受容体を活性化し、体内の血圧制御等恒常性の維持に関わる様々なシグナル伝達に関与している。それゆえ、創薬標的としても非常に注目されており、エンドセリン受容体拮抗薬であるボセンタンが肺動脈性高血圧の治療薬として使われている。我々は、ヒト由来エンドセリン受容体B型とエンドセリン-1、およびリガンド非結合状態の結晶構造を決定し、エンドセリン-1による受容体の活性化機構を解明した。また、拮抗薬ボセンタンが結合した状態の結晶構造も決定し、エンドセリン受容体拮抗薬に共通の結合様式および受容体活性阻害機構を明らかにした。さらにB型選択的作動薬であるET-3やIRL1620、逆作動薬であるIRL2500が結合した状態の結晶構造を決定し、複数の結晶構造を比較することで受容体の活性化・不活性化にともなう一連の構造活性相関を明らかにした。
1. エンドセリンシステム
エンドセリンは日本人によって1988年に発見された21アミノ酸残基からなるペプチドホルモンであり、最も強力な血管収縮物質である[1][1] J. J. Maguire and A. P. Davenport: Br. J. Pharmacol. 171 (2014) 5555-5572.。その受容体として、細胞膜に存在するエンドセリン受容体A型およびエンドセリン受容体B型が発見された。エンドセリン受容体はGタンパク質共役受容体(GPCR)であり、エンドセリンはこれらの受容体を介して細胞内のGiやGqなどGタンパク質を活性化することにより、細胞膜を介しシグナルを伝達する(図1)。エンドセリン受容体A型とB型は血管収縮と拡張という拮抗した作用を示し、両者のバランスで体内の血圧を制御している(図2)。エンドセリン-1はエンドセリン受容体と見かけの上で不可逆的に結合し持続的な血圧の上昇に関わる。血流の制御の他にも、神経堤細胞の発生、細胞の増殖、体液の水分濃度の調整など、エンドセリンの関わるシグナル伝達は生体内の多岐にわたる生理現象に関与する。
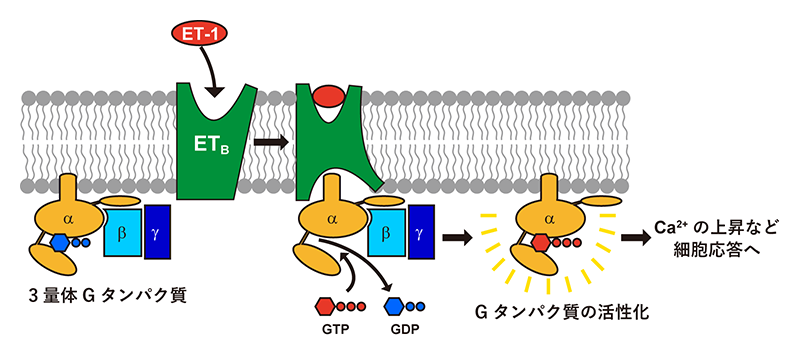
図1 エンドセリン受容体B型によるGタンパク質共役受容体の模式図
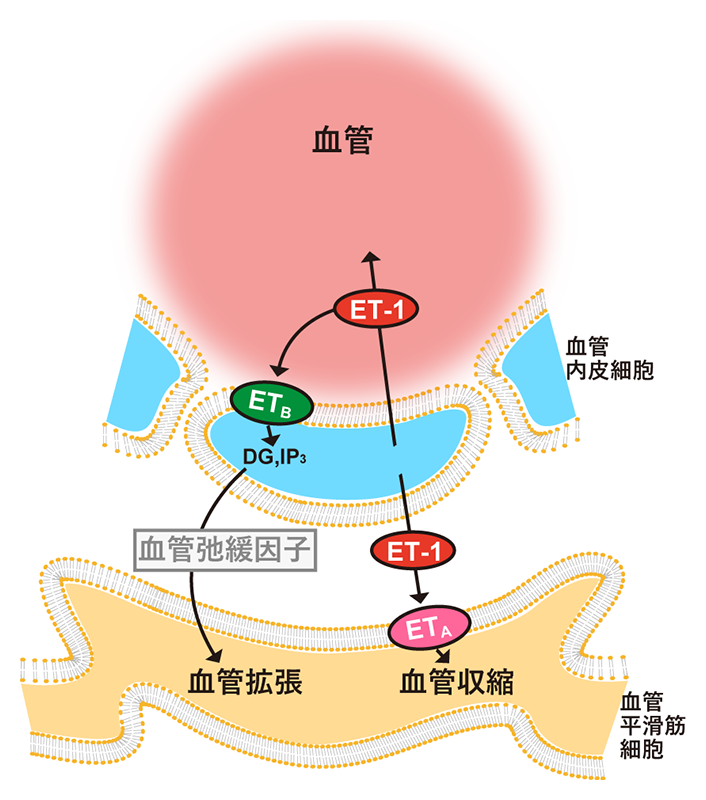
図2 血管系でのエンドセリン受容体のシグナル伝達
エンドセリン-1の異常な産生はがん、高血圧、心臓病など様々な疾患の原因となる。その作用を拮抗的に阻害するエンドセリン受容体拮抗薬はこうした疾患に対する薬剤として注目されている。実際に、非選択的な拮抗薬であるボセンタンは肺高血圧に対する治療薬として使われている。さらに、エンドセリン受容体B型に選択的な作動薬であるエンドセリン-1の誘導体IRL1620は、腫瘍細胞の血管を拡張させて血流を促進することにより抗がん剤や放射線治療の効能を高めるとされ、臨床研究が進められている。このように、エンドセリン受容体に対する選択的な作動薬や拮抗薬は、人類の医療を大きく向上させる可能性を秘めている。これまでに、エンドセリンに関する薬理的および医学的な研究は多くなされてきたが、エンドセリンや拮抗薬がどのようにエンドセリン受容体と結合し、これを活性化・不活性するのか、その分子機構の詳細は全く不明であった。そのため、エンドセリン受容体を標的とした新規の非ペプチド性の作動薬や拮抗薬の開発は停滞しており、エンドセリン受容体の構造の情報が待ち望まれていた。
2. エンドセリン-1結合型および非結合型のエンドセリン受容体B型の構造解析
ヒト由来膜タンパク質、特に、Gタンパク質共役受容体は構造が柔軟かつ不安定であり、結晶化が困難である。私の所属していた藤吉研究室においてヒト由来エンドセリン受容体B型のX線結晶構造解析は1994年から取り組みがあったものの困難を極めていた。そこで我々は、結晶化の促進のため膜貫通領域一つ一つにアラニンを導入することにより、安定性の向上した耐熱変異体の作製に成功した。さらに、構造が柔軟であった細胞内第3ループにT4リゾチームを挿入し脂質中間相を利用することにより、エンドセリン受容体B型とエンドセリン-1(ET-1)との複合体の結晶化に成功し、単結晶から2.8 Å分解能で構造を決定した。ET-1結合型の結晶は約50 μmと小さかったが、SPring-8 BL32XUのマイクロフォーカスビームで十分なデータを集めることができた。T4リゾチームを小型T4リゾチームに改変することにより、リガンドと結合していないエンドセリン受容体B型の構造を2.5 Å分解能で決定した。
エンドセリン-1はN末端側領域、αヘリックス領域とC末端側領域から構成され、主に後者二つの領域を介してエンドセリン受容体B型と密な相互作用を形成していた(図3)。受容体側の約40残基のアミノ酸残基がエンドセリン-1との相互作用に関わっており、その相互作用面積は1,500 Å2と広範なものであった。特に、細胞外第2ループ(ECL2)の長いβシートとN末端が、エンドセリン-1の上で蓋を形成していた。エンドセリン受容体B型とエンドセリン-1とは変性剤であるSDS存在下でも解離しない、超安定な複合体を形成することが知られている。こうした多数の相互作用と、エンドセリン-1の上部での蓋構造が、エンドセリン-1の不可逆的な相互作用を実現していると考えられた。
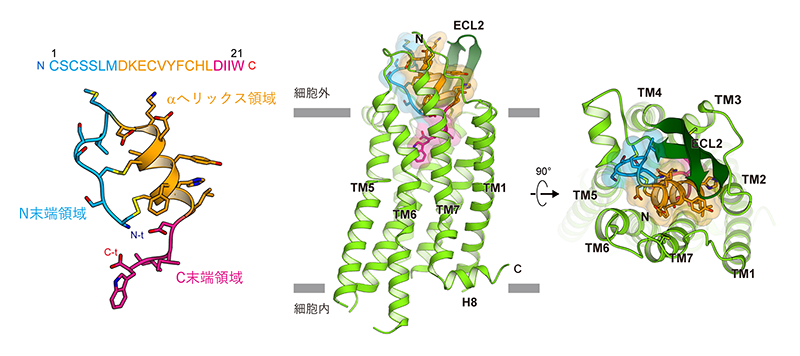
図3 エンドセリン-1結合型の全体構造
エンドセリン-1と結合した状態とリガンドが何も結合していない状態を比較すると、細胞外側の結合ポケットにおいてエンドセリン-1との結合にともなう大きな構造変化が観察された。受容体の膜貫通ヘリックス2、6、7がエンドセリン-1との結合にともない、それぞれ2.6 Å、4.1 Å、4.9 Åほど結合ポケットの内部へと動いていた(図4)。それにともない、受容体のコアでは正電荷を持つ残基が大きく動き、エンドセリン-1のC末端領域と塩橋ネットワークを形成していた。こうしたダイナミックな動きにより、エンドセリン受容体B型の結合ポケットは開いた状態から閉じた状態になり、エンドセリン-1と強固な相互作用を形成することが明らかになった。こうした構造変化はこれまでに明らかになったGPCRの構造変化の中で最も大きいものであり、エンドセリン-1という大きなペプチドを受容するために重要である。一方、こうした構造変化が受容体中間部のGPCRで極めて保存されたモチーフ、transmission switchの構造変化を促すことで受容体を活性化することが明らかになり、GPCRの普遍的な活性化機構を解明した。
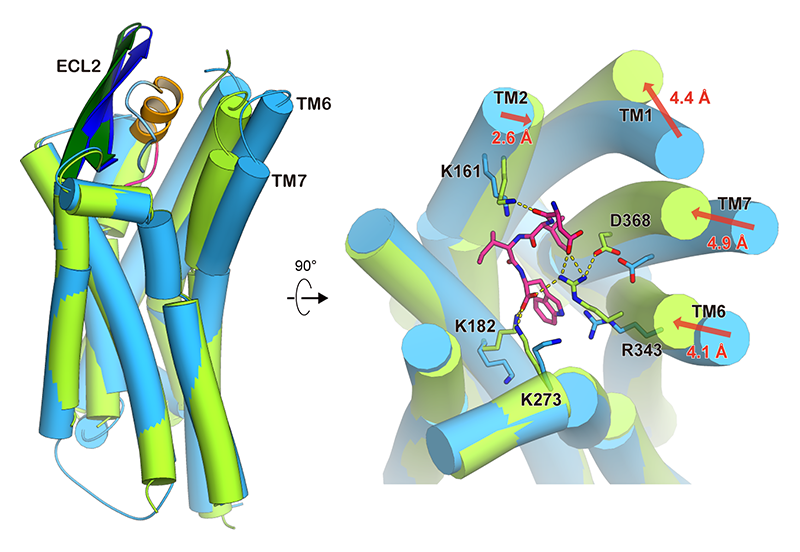
図4 エンドセリン-1結合型(緑)と非結合型(青)の構造比較
今回構造が解けたエンドセリン-1結合型の構造は、世界初の完全長のペプチド作動薬とGPCRの複合体構造である。また、受容体安定化技術によりリガンドが何も結合していない状態のGPCR構造を世界で初めて決定し、両者の比較により内在性ペプチド作動薬による受容体活性化機構を解明できた。こうした成果は国際的に高く評価され、Natureのarticleに掲載された[2][2] W. Shihoya, T. Nishizawa, A. Okuta, K. Tani, N. Dohmae et al.: Nature 537 (2016) 363-368.。さらにヒト由来エンドセリン受容体B型の構造はBL32XU初のヒト由来膜タンパク質構造、GPCR構造であり、高フラックス微小ビームビームラインBL32XUとその測定技術によってヒト由来の創薬標的の迅速な構造解析が可能であることの証明になった。
3. 阻害剤結合型のエンドセリン受容体B型の構造解析
ボセンタンはハイスループットスクリーニングにより選抜された低分子化合物であり、エンドセリン受容体のA型およびB型に非選択的な拮抗薬である。ボセンタンは、最初に認可された肺動脈性肺高血圧症に対する経口投与性の治療薬である。肺動脈性肺高血圧症それ自体は稀少疾患であるものの、特許が切れる前の全世界におけるボセンタンの売り上げは過去に年間1,000億円を超えていた。しかし、エンドセリン受容体に対するボセンタンの結合能は低く解離も速いため、より薬効の高い薬剤の創出を目指しボセンタンを基にして多数のエンドセリン受容体の拮抗薬が開発されてきた。しかし、ボセンタンあるいはその誘導体のエンドセリン受容体への結合様式については未知な点が多く、拮抗薬の新規創出は困難であった。
エンドセリン受容体B型と拮抗薬との複合体の結晶化に際しては、リガンド非結合状態の構造決定に用いた改変型のエンドセリン受容体B型を用いた。この改変体とボセンタンおよびボセンタンの高親和性の誘導体であるK-8794との共結晶化に成功し、それぞれ、分解能3.6 Åおよび2.2 Åで構造を決定した。ボセンタン結合型については、結晶が小さかったため、後述する通り開発中だった自動データ収集システムZOOを用いてデータ測定を完了させた。
ボセンタンはスルホンアミドを中心とした芳香族性の部分の多い化合物である(図5)。ボセンタンのスルホンアミドはエンドセリン受容体B型のリジンやアルギニンといった正電荷を持つ残基と電荷相補的な相互作用を形成していた。全体としては、ボセンタンのスルホンアミドとエーテル酸素が受容体の正電荷を持つアミノ酸によって水素結合を介し認識されており、他の芳香族性の部分が膜貫通部位のポケットを埋めていた。こうしたボセンタンの結合様式は、エンドセリン受容体との結合に対するスルホンアミド部分の重要性を示した過去の研究と非常に良く合致した。エンドセリン受容体拮抗薬の全ては、その分子中心に負電荷を持つスルホンアミドやカルボキシル基を共通して持ち、他の部分は芳香族部分で構成されている。本構造から明らかになったボセンタンの結合様式は他の拮抗薬でも共通していると考えられ、エンドセリン受容体拮抗薬の普遍的な受容体結合様式を解明することができた。さらに、エンドセリン受容体B型におけるボセンタンの結合部位はエンドセリン受容体A型においても保存されており、A型に対する拮抗薬の結合様式も推定可能になった。
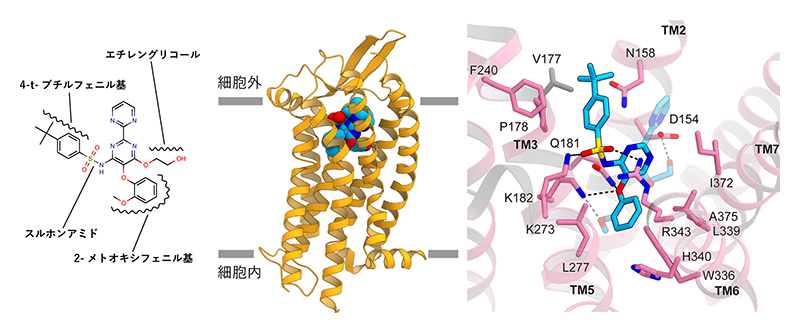
図5 ボセンタン結合型のエンドセリン受容体B型の構造。左がボセンタンの化学構造、中央が全体構造、右がボセンタンの結合部位。ピンクがAとBで保存されている個所で、灰色が保存されてない部分。
ボセンタンは内在性の作動薬であるエンドセリン-1を基に開発されたわけではなく、エンドセリン-1との化学構造における類似点は少ない。しかし、エンドセリン受容体B型とボセンタンとの複合体の構造をエンドセリン-1との複合体の構造と比較すると、ボセンタンはエンドセリン-1との結合部位の底部を占めており、エンドセリン-1のC末端の3つの残基と非常に良く重なっていた。特に、ボセンタンのスルホンアミドはエンドセリン-1のC末端のカルボキシル基と良く重なり、図6の紺色で示した正電荷を持つ残基により共通して認識されていた。一方、ボセンタンはその芳香族部分でエンドセリン受容体B型の構造変化を妨げることで、不活性化状態を安定化し拮抗薬として機能できることを見出した(図6)。
このように単に拮抗薬の結合様式を決定したことに留まらず、受容体の他の状態との比較からなぜ拮抗薬として機能できるかまで可視化した研究は国際的に高く評価され、Nature Structural and Molecular Biology誌に掲載された[3][3] W. Shihoya, T. Nishizawa, K. Yamashita, A. Inoue, K. Hirata et al.: Nat. Struct. Mol. Biol. 24 (2017) 758-764.。

図6 ボセンタンによる受容体不活性化の模式図
4. B型選択的作動薬結合型のエンドセリン受容体B型の構造解析
エンドセリン受容体拮抗薬は高血圧やがんへの治療薬となる一方で、エンドセリン受容体B型選択的作動薬は血管弛緩薬として研究されている。エンドセリン受容体A型とは異なり、B型の活性化は血管弛緩作用を示すためである。現在までに、エンドセリンの一部領域を欠損させて線状ペプチド化した、IRL1620というB型選択的作動薬が開発されている。IRL1620はエンドセリン-1と同等の親和性でB型に結合できるのに対して、A型には全く作用せず、10万倍以上の高いB型選択性を示す。IRL1620は抗がん剤や放射線治療による効能を高める併用療法として、臨床試験が行われている。B型選択的作動薬は他にもエンドセリン-3が存在するが、B型選択性は100倍程度であり弱い。
我々は、エンドセリン受容体B型とB型選択的作動薬であるIRL1620およびET-3の複合体の結晶化に成功し、それぞれ、分解能2.7 Åおよび2.0 Åで構造を決定した(図7)。特にET-3結合型構造については、BL32XUの自動データ収集システムZOOを使うことで高分解能を追求し、現時点で作動薬結合状態のGPCR構造の世界最高分解能を誇る。こうした構造から水分子を含めたエンドセリンと受容体の相互作用の詳細が明らかになり、B型選択性のメカニズムの一端を解明した。詳細な構造比較とそれに指南された機能解析によって、IRL1620は受容体を完全に活性化できない部分作動薬であることを示した。こうした成果は、IRL1620にはB型選択的作動薬として改善の余地があることを示すと共に、構造情報に基づいたIRL1620の改変や低分子化につながることが評価され、Nature Communications誌に掲載された[4][4] W. Shihoya, T. Izume, A. Inoue, K. Yamashita, F. M. N. Kadji et al.: Nat. Commun. 9 (2018) 4711.。
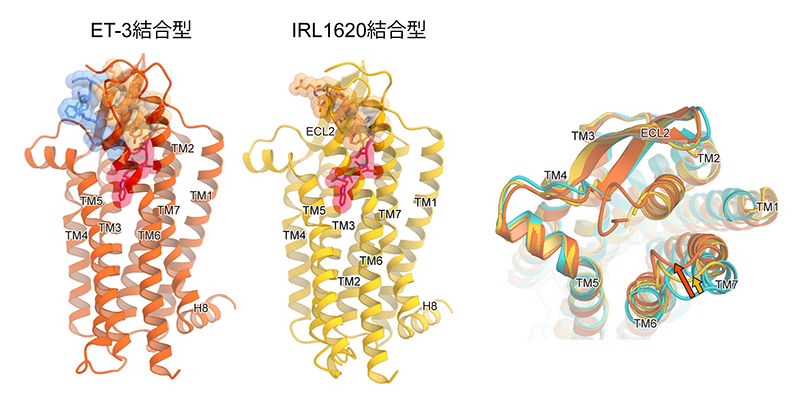
図7 ET-3結合型、IRL1620結合型の構造と、不活性状態(拮抗薬K8794結合型)との構造比較。IRL1620結合型では、エンドセリンのN末端領域に相当する部分と受容体の相互作用がないために、活性化に重要なTM6-7を内側へ引き寄せる動きが小さい。
5. 逆作動薬IRL2500結合型のエンドセリン受容体B型の構造解析
エンドセリン受容体拮抗薬は、今日までボセンタンを基に開発が進められている。そのため、エンドセリン受容体拮抗薬はみな類似した化合物骨格であり、多様性が少ない。薬理作用は化合物骨格に強く依存するため、エンドセリン受容体拮抗薬のさらなる臨床応用のためには化合物空間の拡張が必要である。ボセンタンとは異なる化合物骨格を持つ拮抗薬に、IRL2500というものがある。IRL2500はエンドセリンのC末端の一部を模倣して作られた拮抗薬であり、ボセンタンとは大きく異なっている。
我々は、IRL2500の結合様式を理解できれば、ボセンタン以外にも受容体を阻害し得る化合物骨格が同定できると考え、IRL2500結合型のエンドセリン受容体B型の構造を分解能2.7 Åで決定した。IRL2500はET-1とは全く異なる結合様式であった。IRL2500はボセンタンと同様に受容体の正電荷を持つアミノ酸と相互作用していたものの、IRL2500は受容体の結合ポケットのより深い位置で相互作用しており、強固に不活性化状態を固定していた(図8)。このことから我々は、IRL2500が単なる拮抗薬ではなく受容体の恒常的な活性をも抑制する、逆作動薬ではないかと考えた。機能解析を試みた結果、IRL2500が逆作動薬であることを解明した。こうした成果はエンドセリン受容体拮抗薬の化合物空間を広げるのみならず、GPCR一般の動作原理について理解を深めるものと評価され、Communications Biology誌に掲載された[5][5] C. Nagiri, W. Shihoya, A. Inoue, F. M. N. Kadji, J. Aoki et al.: Commun. Biol. 2 (2019) 236.。

図8 エンドセリン-1、ボセンタン、IRL2500結合型構造の比較。TM6やW336の内側への動きが受容体の活性化に重要であり、ボセンタンは立体障害によってその変化を防いでいる。IRL2500では、ビフェニル基が受容体の奥深くに刺さり、W336を挟み込む形でボセンタンよりも強固に構造変化を防ぎ、不活性状態を安定化している。
謝辞
本研究の2章は現東京医科歯科大学の藤吉好則教授ら、東京大学の土井知子准教授らとの共同研究、第3、4章では加えて東北大学の井上飛鳥准教授らやSPring-8の平田邦生博士らとの共同研究、第5章では東北大学の井上飛鳥准教授らとの共同研究である。また、X線回折像の取得は、全てSPring-8のBL32XUにおいて行った(課題番号2015A1024、2015A1057、2015B2024、2015B2057、2016A2527、2017A2527、2017B2578)。この場を借りて深くお礼申し上げる。
参考文献
[1] J. J. Maguire and A. P. Davenport: Br. J. Pharmacol. 171 (2014) 5555-5572.
[2] W. Shihoya, T. Nishizawa, A. Okuta, K. Tani, N. Dohmae et al.: Nature 537 (2016) 363-368.
[3] W. Shihoya, T. Nishizawa, K. Yamashita, A. Inoue, K. Hirata et al.: Nat. Struct. Mol. Biol. 24 (2017) 758-764.
[4] W. Shihoya, T. Izume, A. Inoue, K. Yamashita, F. M. N. Kadji et al.: Nat. Commun. 9 (2018) 4711.
[5] C. Nagiri, W. Shihoya, A. Inoue, F. M. N. Kadji, J. Aoki et al.: Commun. Biol. 2 (2019) 236.
東京大学 大学院理学系研究科
〒113-0033 東京都文京区本郷7丁目3-1
TEL : 03-5841-4391
e-mail : wtrshh9@gmail.com








