Volume 15, No.3 Pages 150 - 156
1. 最近の研究から/FROM LATEST RESEARCH
生分解性バイオポリエステルの高性能化
High Functionability of Biodegradable Microbial Polyesters
東京大学大学院 農学生命科学研究科 Department of Biomaterial Sciences, Graduate School of Agricultural and Life Sciences, The University of Tokyo
1.はじめに
近年、プラスチック廃棄物による環境破壊、地球温暖化、化石資源の枯渇など、高分子材料が関係する地球環境と資源・エネルギーに対する諸問題が提起され、地球環境と調和する人間社会の形成において、「環境に優しい高分子の創成と高機能化」が世界的な課題となっている。
現在、世界各国で研究および開発が進められている環境に優しいプラスチックは、大きく分けて2つのカテゴリーに分類できる。1つは、環境中の微生物の分泌する分解酵素により低分子量化合物に分解された後(一次分解、酵素分解)、微生物体内に取り込まれ二酸化炭素と水にまで完全に分解される(完全分解、微生物代謝)、生分解性プラスチックである。もう1つは、再生可能資源であるバイオマスを原料として生産されたバイオマスプラスチック(又はバイオベースプラスチック)である(表1)。
表1 プラスチックの分類
| 生分解性 | 原料 | |
| バイオマス | 石油 | |
| あり | 生分解性バイオマスプラスチック ・ポリ乳酸 ・微生物産生ポリエステル ・ポリアミノ酸 ・化学修飾多糖類 |
生分解性石油由来プラスチック ・ポリカプロラクトン ・ポリブチレンサクシネート ・芳香族導入ポリエステル ・ポリビニルアルコール ・ポリグリコール酸 |
| なし | 非生分解性バイオマスプラスチック ・セルロースエステル ・ポリテトラメチレンテレフタレート ・ポリウレタン ・(バイオポリエチレン) ・(バイオポリプロピレン) |
非生分解性石油由来プラスチック ・ポリスチレン ・ポリエチレンテレフタレート ・ポリ塩化ビニル ・ポリエチレン ・ポリプロピレン |
生分解性プラスチックは分解されることに大きな機能があるため、原料は必ずしもバイオマスである必要はなく、石油から合成されているものもある。実際、生分解性プラスチックとして最初に研究開発されたプラスチックは、石油から合成されたエステル結合を有するポリエステルであった。一方、バイオマスプラスチックは、再生可能資源であるバイオマスを原料としている点に特徴があるため、全てのバイオマスプラスチックが必ずしも生分解性という機能を持っているわけではない。従って、バイオマスプラスチックでは、最終的に焼却も処理方法の一つとして考えられ、二酸化炭素の循環を考慮した「カーボンニュートラル」の概念が先行している。さらに付け加えるなら、生分解性プラスチックやバイオマスプラスチックとは言え、製造工程で石油から得られる電気や燃料エネルギーを使用していることを理解しておく必要がある。
現在世界各国で研究が進められている環境に優しいプラスチックは、上記の観点から、バイオマスから生産され生分解性も有する生分解性バイオマスプラスチック(ポリ乳酸、微生物産生ポリエステル、ポリアミノ酸、多糖類など)、石油から合成され生分解性を有する生分解性石油由来プラスチック(ポリカプロラクトン、ポリブチレンサクシネートなど)、バイオマスから生産され生分解しない非生分解性バイオマスプラスチック(セルロースエステル誘導体、ポリテトラメチレンテレフタレート、バイオポリエチレンなど)、の大きく3つに分類される(表1)。
本報では、生分解性バイオマスプラスチックの一つである微生物産生ポリエステルを研究対象として行った、新規な成形加工技術の開発による生分解性繊維の高強度化、大型放射光を用いた構造科学研究、高強度繊維の酵素分解性、という一連の基礎研究の成果について紹介する[1-3][1] 岩田忠久:高分子論文集 60 (2003) 377.
[2] T. Iwata : Macromol. Biosci. 5 (2005) 689.
[3] 岩田忠久:植物由来プラスチックの高機能化とリサイクル技術 サイエンス&テクノロジー 東京 第25章 (2007).。
2.微生物産生ポリエステル
自然界に存在する多くの微生物は、植物がデンプンを貯蔵炭水化物として蓄積するのと同じように、ポリヒドロキシアルカノエート(PHA)と呼ばれるポリエステルをエネルギー貯蔵物質として体内に蓄積する。このポリエステルは、微生物が飢餓状態に陥ると、体内に持つ分解酵素によって分解されエネルギーとなることから、ちょうど動物の脂肪に相当する[4][4] R. W. Lenz and R. H. Marchessault : Biomacromolecules 6 (2005) 1.。図1は、ポリエステル(白い部分)を乾燥重量当たり86%にまで体内に蓄積した微生物の電子顕微鏡写真である。
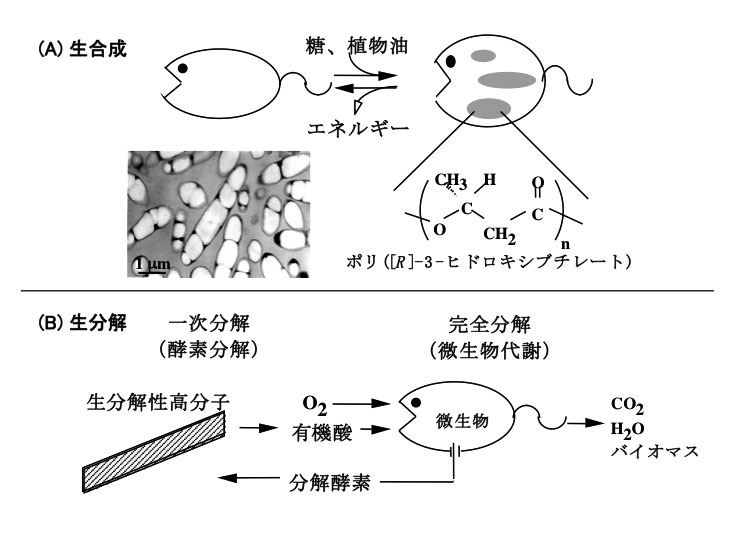
図1 微生物産生ポリエステルの(A) 生合成と(B) 生分解。写真は、80%以上のポリエステルを蓄積した遺伝子組み換え大腸菌の透過型電子顕微鏡像(図中の白い部分が蓄積したポリエステル)
微生物産生ポリエステルは、1925年にフランス・パスツール研究所のLemoigne博士により微生物培養中に発見され、光学的に100%R体の規則性を有する3−ヒドロキシブタン酸が直鎖状につながったポリ[(R)−3−ヒドロキシブチレート](P(3HB))である[5][5] M. Lemoigne: Ann. Inst. Pasteur 39 (1925) 144.。P(3HB)は、水素細菌、窒素固定菌、光合成細菌など100種類以上の原核生物によって、糖、有機酸、炭酸ガスなどの炭素源から合成されるバイオマスプラスチックであり、環境中の他の微生物が分泌する分解酵素によって完全に分解される生分解性プラスチックでもある(図1)。
P(3HB)は、生分解性ポリエステルの中でもポリプロピレン(PP)と同程度の高い融点(180℃)を持つ材料であり、破壊強度もPPに近く、PPと比較されることが多いが、破壊伸びが5%以下と低いため硬い材料である。さらに、ガラス転移温度が4℃と室温以下であるため、室温で保存中に結晶化が進行(二次結晶化)し、結晶性の高いもろい材料となる欠点がある。
物性を向上させる方法として、第2成分モノマーを導入する共重合体化が挙げられる。微生物の種類や用いる炭素源を変えることにより、様々な分子構造を持つ共重合ポリエステルが見出されており、共重合体の種類や組成を変化させることにより、結晶性の硬いプラスチックから弾性に富むゴム状まで、多様な物性を示すことが報告されている。現在、代表的な共重合ポリエステルとして、3-ヒドロキシバレリル酸(3HV)を導入したポリ[(R)-3-ヒドロキシブチレート-co-(R)-3-ヒドロキシバレレート](P(3HB-co-3HV))、3-ヒドロキシヘキサン酸(3HH)を導入したポリ[(R)-3-ヒドロキシブチレート-co-(R)-3-ヒドロキシヘキサノエート](P(3HB-co-3HH))、4-ヒドロキシブタン酸(4HB)を導入したポリ[(R)-3-ヒドロキシブチレート-co-4-ヒドロキシブチレート](P(3HBco-4HB))などが挙げられる(図2)。
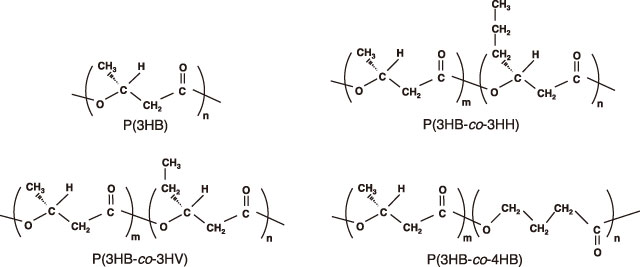
図2 代表的な微生物産生ポリエステルの化学構造式
3.超高分子量ポリエステルからの高強度繊維
自然環境中に存在する野生のポリエステル合成菌が生産する野生株産生P(3HB)の重量平均分子量は、約60万程度である。一般に高分子材料は、分子量が増大すると物性が向上することから、P(3HB)においても、まず高分子量化を検討した。
筆者らは、P(3HB)合成菌であるRalstonia eutropha H16由来のPHB生合成遺伝子(phbCAB)を導入した組み換え大腸菌Escherichia coli XL1-Blue(pSYL 105)を用い、炭素源としてグルコースを用い、Luria-Bertani培地中、2段回分培養において、通気酸素量、撹拌速度、炭素源濃度、培地温度、培地のpHなど様々な培養条件を検討した。その結果、遺伝子組み換え大腸菌を用いたP(3HB)の発酵合成において、培地のpHが分子量に大きな影響を与えることが分かった。培養時のpHを酸性側にシフトすることにより、重量平均分子量500〜2000万を有する超高分子量P(3HB)の生合成に成功した[6][6] S. Kusaka, T. Iwata and Y. Doi : J. Macromol. Sci.- Pure Appl. Chem. A35 (2) (1998) 319.。これは、分子量の増大を抑制する因子である連鎖移動剤の発生を、培地のpHを酸性側にシフトしたことにより抑制できたためと考えられる。しかし現在のところ、この連鎖移動剤が何であるかは解明されていない。
これまでP(3HB)は、結晶化速度が遅いことや二次結晶化に伴う室温での経時劣化のため、繊維化は困難であった。最初に繊維化に成功したのは、Gordeyevら[7][7] S. A. Gordeyev and Y. P. Nekrasov : J. Mater. Sci. 18 (1999) 1691.であるが、破壊強度190 MPaと汎用高分子の物性にはほど遠いものであった(表2)。Schmackら[8][8] G. Schmack, D. Jehnichen, R. Vogel and B. Tandler : J. Polym. Sci. B, Polym. Phys. 38 (2000) 2841.は、2000〜3500 m/minで高速紡糸を行った後、4.0〜6.9倍に延伸することにより、破壊強度330 MPa、ヤング率7.7 GPa、破壊伸び37%の繊維を得ている。また、Yamaneら[9][9] H. Yamane, K. Terao, S. Hiki and Y. Kimura : Polymer 42 (2001) 3241.は、28 m/minで紡糸を行った後、110℃で6倍に延伸、さらに100 MPaの張力をかけた状態で熱処理を施すことにより、破壊強度310 MPa、ヤング率3.8 GPa、破壊伸び60%の繊維を得ている(表2)。
表2 ポリヒドロキシアルカン酸繊維と他の高分子繊維の物性
今回筆者らは、超高分子量P(3HB)を用いて、新たな延伸法を開発することにより、高強度・高弾性率繊維の作製に成功した。まず、溶融押出したP(3HB)を氷水中に急冷し、非晶質繊維を作製した。次いで、この非晶質繊維を、氷水中で約6〜12倍に冷延伸することにより、配向非晶質繊維を作製した。さらに、この配向非晶質繊維を室温で約6〜8倍に延伸することにより、冷延伸・二段階延伸された高配向非晶質繊維を得た。この50倍以上に延伸された高配向非晶質繊維を熱処理することにより、破壊強度1.3 GPa、破壊伸び35%、ヤング率18.1 GPaの生分解性および生体適合性を有する高強度繊維の作製に世界で初めて成功した[10,11][10] T. Iwata, Y. Aoyagi, M. Fujita, H. Yamane, Y. Doi, Y. Suzuki, A. Takeuchi and K. Uesugi : Macromol. Rapid Commun. 25 (2004) 1100.
[11] T. Iwata, Y. Aoyagi, T. Tanaka, M. Fujita, A. Takeuchi, Y. Suzuki and K. Uesugi : Macromolecules 39 (2006) 5789.(表2)。
4.野生株産生ポリエステルからの高強度繊維
我々は遺伝子組み換え大腸菌を用いて生成した超高分子量ポリエステルを用いて高強度繊維の作製には成功したが、これでは汎用性に乏しく、コストパフォーマンスにも欠ける。そこで、前述の冷延伸・二段階延伸法を改良することにより、通常の分子量(60万程度)の野生株産生P(3HB)からでも高強度繊維を作製できる微結晶核延伸法を開発した[12,13][12] 岩田忠久、田中稔久、土肥義治:公開WO-A1-2006038373.
[13] 田中稔久、青柳佳宏、山根秀樹、土肥義治、岩田忠久:繊維学会誌 60 (2004) 309.。微結晶核延伸法とは、急激な結晶化を抑制しながら微小な結晶核を形成させ、その結晶核を起点として分子鎖を高配向させる延伸方法である。まず、溶融-急冷によって非晶質繊維を作製し、これを氷水浴中にて一定期間静置することで、微結晶核を形成させ、その後、室温で延伸することにより、分子量に依存することなく、高配向繊維の作製を可能にした。この微結晶核延伸法によって、市販のP(3HB)からでも破壊強度740 MPaを有する高強度繊維を得ることができた(表2)。
この微結晶核延伸法は、P(3HB)共重合体にも有効であった。P(3HB-co-3HV)は、これまでいくつか繊維化の報告例はあるが、破壊強度は200 MPa程度と低いものであった。しかし、今回我々が開発した微結晶核延伸法をP(3HB-co-3HV)に適用することで、低分子量である市販のP(3HB-co-3HV)ではこれまで得ることができなかった、破壊強度1.3 GPaという高強度繊維の作製に成功した[14][14] T. Tanaka, M. Fujita, A. Takeuchi, Y. Suzuki, K. Uesugi, K. Ito, T. Fujisawa, Y. Doi and T. Iwata : Macromolecules 39 (2006) 2940.。この微結晶核延伸法は、微生物産生ポリエステルだけでなく、他の生分解性ポリエステルの繊維化にも適用でき、簡便に高強度繊維を作製できる技術として期待されている。
5.大型放射光を用いた単繊維の局所構造解析
P(3HB)の結晶構造は、結晶系:斜方晶系、格子定数:a = 0.576 nm、b = 1.320 nm、c(繊維軸)= 0.596 nm、空間群:P212121、単位格子中に2本の分子鎖が存在し、それぞれの分子鎖は2回らせんの対称性を有している。今回作製したP(3HB)高強度繊維のX線繊維図において、結晶状態で最も安定とされる分子鎖構造である2回らせん構造(α構造)に加え、分子鎖が伸びきった平面ジグザグ構造(β構造)に由来する回折点が確認された。破壊強度の増大とともにβ構造の回折強度が強くなったことから、β構造の発現は、高強度化に重要な因子であると考えられる。
繊維内部をさらに詳細に解析するために、兵庫県播磨にある大型放射光施設SPring-8(BL47XUビームライン)において、0.5 µmに集束させたマイクロビーム(波長 = 1.54 Å, 8 keV)を単繊維(直径20 µm)に照射するマイクロビームX線測定を行った。SPring-8のビームは非常に平行性が高いため、このようにナノオーダーでの収束が可能であり、局所領域の回折実験が可能となる。単繊維の端から中心に対して順次マイクロビームX線測定を行ったところ、冷延伸・二段階延伸を施したP(3HB)高強度繊維は、外側がα構造を有する結晶のみで構成され、内部はα構造とβ構造の2種類の結晶が存在する、つまり2つの結晶構造が局在した芯鞘構造であることが分かった[10,11][10] T. Iwata, Y. Aoyagi, M. Fujita, H. Yamane, Y. Doi, Y. Suzuki, A. Takeuchi and K. Uesugi : Macromol. Rapid Commun. 25 (2004) 1100.
[11] T. Iwata, Y. Aoyagi, T. Tanaka, M. Fujita, A. Takeuchi, Y. Suzuki and K. Uesugi : Macromolecules 39 (2006) 5789.(図3)。
一方、微結晶核延伸法により作製したP(3HB)高強度繊維は、マイクロビームX線測定によりα構造とβ構造の2種類の結晶が繊維全体に均一に存在する構造であることが分かった[14][14] T. Tanaka, M. Fujita, A. Takeuchi, Y. Suzuki, K. Uesugi, K. Ito, T. Fujisawa, Y. Doi and T. Iwata : Macromolecules 39 (2006) 2940.。このように単繊維の局所構造解析を行い、P(3HB)の2種類の分子鎖構造を、材料中に目的に応じて配列することができれば、多様な物性の要求に応えられる生分解性材料の作製が可能となると考えられる。
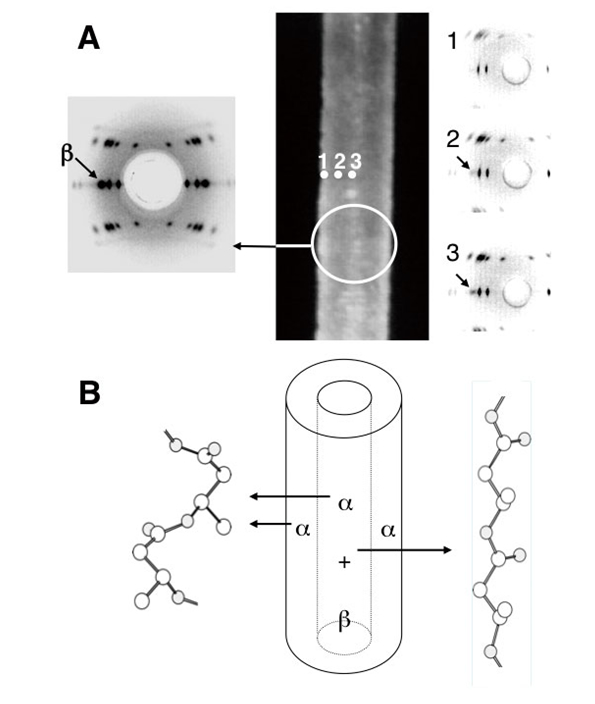
図3 微生物産生ポリエステルから作製した高強度繊維のマイクロビームX線回折図と芯鞘構造模式図:(A) 左は繊維全体からのX線回折図、右は真ん中の繊維写真における1〜3の箇所からそれぞれ得られマイクロビームX線回折図、(B) 芯鞘構造模式図とP(3HB)の2種類の分子鎖構造(らせん構造(α)と平面ジグザグ構造(β))
6.繊維内部の非破壊的観察
冷延伸・二段階延伸法と微結晶核延伸法で作製したPHA繊維の小角X線回折をBL45XUビームラインで撮影を行った。通常、単繊維一本の小角X線回折を研究室レベルでのX線回折装置では輝度が弱いため非常に困難であるが、SPring-8の強力線源を用いればミリ秒で測定できることから、静的な測定だけでなく、昇温下や延伸過程などの動的な測定も可能となる。
今回作製した2種類の繊維のうち、冷延伸・二段階延伸法で作製した繊維は子午線方向にラメラ結晶の周期性を示す回折点が観察されたが、微結晶核延伸法で作製した繊維では子午線方向の回折は観察されず、赤道線上に大きなストリーク回折が見られた(図4Aと4B)。高強度繊維の小角回折に於いて、赤道線上に見られるストリーク回折は一般に繊維中に存在するボイドの影響であると考えられているが、未だその直接的な証拠は示されていない。そこで、筆者らは大型放射光を用いて非破壊的に内部構造を可視化できるX線トモグラフィーの測定を行った。

図4 高強度繊維の小角X線散乱:(A) 冷延伸・二段階延伸法により作製されたP(3HB)高強度繊維、(B) 微結晶核延伸法により作製されたP(3HB-co-3HV)高強度繊維、(CとD) 微結晶核延伸法で作製されたP(3HB-co-3HV)繊維のX線トモグラフィー像、スケール = 20 μm
図4Cに、微結晶核延伸法で作製した高強度繊維の3次元X線トモグラフィー像を示す。繊維内部に存在する無数の小さなボイドの存在を、世界で初めて明らかにすることが出来た[15][15] T. Tanaka, K. Uesugi, A. Takeuchi, Y. Suzuki and T. Iwata : Polymer 48 (2007) 6145.。一方、冷延伸・二段階延伸法で作製した繊維にはボイドは認められなかった。従って、赤道線上のストリークは繊維内部に存在するボイドに起因すると考えられる。微結晶核延伸法により作製した繊維の破壊強度を、ボイドの平均サイズおよび繊維断面積に対するボイドの存在率を考慮して再計算すると、約2倍の2.2 GPaとなることがわかった。すなわち、PHA繊維は更なる高強度化が可能であることを示唆している。
さらに、繊維軸方向にきれいに入ったボイドにより、繊維自体の重量が約半分になっていると考えられる。考え方を変えれば、軽量高強度繊維の作製に成功したともいえ、高強度を保ちながら軽量化が必要な分野で本繊維の利用および作製方法の適用が期待できる。また、内部ポアに薬物などを含浸させれば、生分解性機能と合わせたスローリリース繊維を開発することが可能となると考えられる。
7.高強度繊維の酵素分解性
生分解性ポリエステルの生分解性試験評価法には、微生物由来のポリヒドロキシブチレート(PHB)分解酵素を用いる酵素分解法と、土壌、堆肥中、海洋、河川などに埋設、浸漬し自然環境中に生息する微生物によって分解を行う微生物分解法がある。精製酵素を用いて加水分解実験を行った場合、材料の分解速度は、用いた酵素の特性や材料の固体構造によって変化する。一方、自然環境中での微生物分解は、多種多様な微生物や酵素の共存のもとに加水分解を受けるとともに、季節や気候によって大きな影響を受ける。従って、現実的な生分解性の評価のためには、両者を併用することが望ましい。
高強度繊維の微生物分解を荒川河川水を用いて行ったところ、2週間程度で生物化学的酸素要求量(BOD)生分解度が80%に達し、28日間試験後では重量生分解度100%を示したことから、高強度繊維は完全に微生物分解されることが示された[16][16] 青柳佳宏:学位論文 埼玉大学大学院理工学研究科 (2003).。
図5に、PHB分解酵素による分解前後の高強度繊維の走査型電子顕微鏡像とX線回折パターンを示す。図5Bの写真から、酵素分解は繊維表面から一様に分解されるのではなく、虫食いが起こるように繊維内部へと進行していく様子が観察された。通常、繊維内部には結晶領域と非晶領域が存在し、酵素はまず非晶領域を優先的に分解しているためと考えられる。次に、前述のように、高強度繊維には2回らせん構造(α構造)と平面ジグザグ構造(β構造)の2種類の分子鎖構造が存在する。分解前後のX線回折において、α構造の回折強度は変化しないのに対し、β構造の回折強度は極端に減少したことから、β構造の方がα構造より早く分解されることがわかった[11][11] T. Iwata, Y. Aoyagi, T. Tanaka, M. Fujita, A. Takeuchi, Y. Suzuki and K. Uesugi : Macromolecules 39 (2006) 5789.。この結果は、同じ化学構造を有していても、分子鎖構造により分解速度をコントロールできることを示唆している。

図5 P(3HB)高強度繊維の酵素分解前(A)と酵素分解途中(B)の走査型電子顕微鏡像および(C)X線回折パターン
最近我々は、大型放射光を用いたタンパク質構造解析により、世界で初めてPHB分解酵素の結晶構造解析に成功した[17][17] T. Hisano, K. Kasuya, Y. Tezuka, N. Ishii, E. Oroudjev, H. Hansma, T. Kobayashi, M. Shiraki, T. Iwata, Y. Doi, T. Saito and K. Miki : J. Mol. Biol. 356 (2006) 993.(図6)。PHBの2種類の分子鎖構造(2回らせん構造と平面ジグザグ構造)を分解酵素の触媒部位に結合させるシミュレーションモデルを構築したところ、平面ジグザグ構造の方が触媒部位にうまく収まることがわかった。本結果は、高分子材料学からのアプローチと構造生物学からのアプローチが相補しあえることを示している。また、分子レベルで分解酵素の機能を解明することにより、生分解性速度をコントロールするだけでなく、難分解性高分子材料を分解する新規な分解酵素の構築も可能になると考えられる。
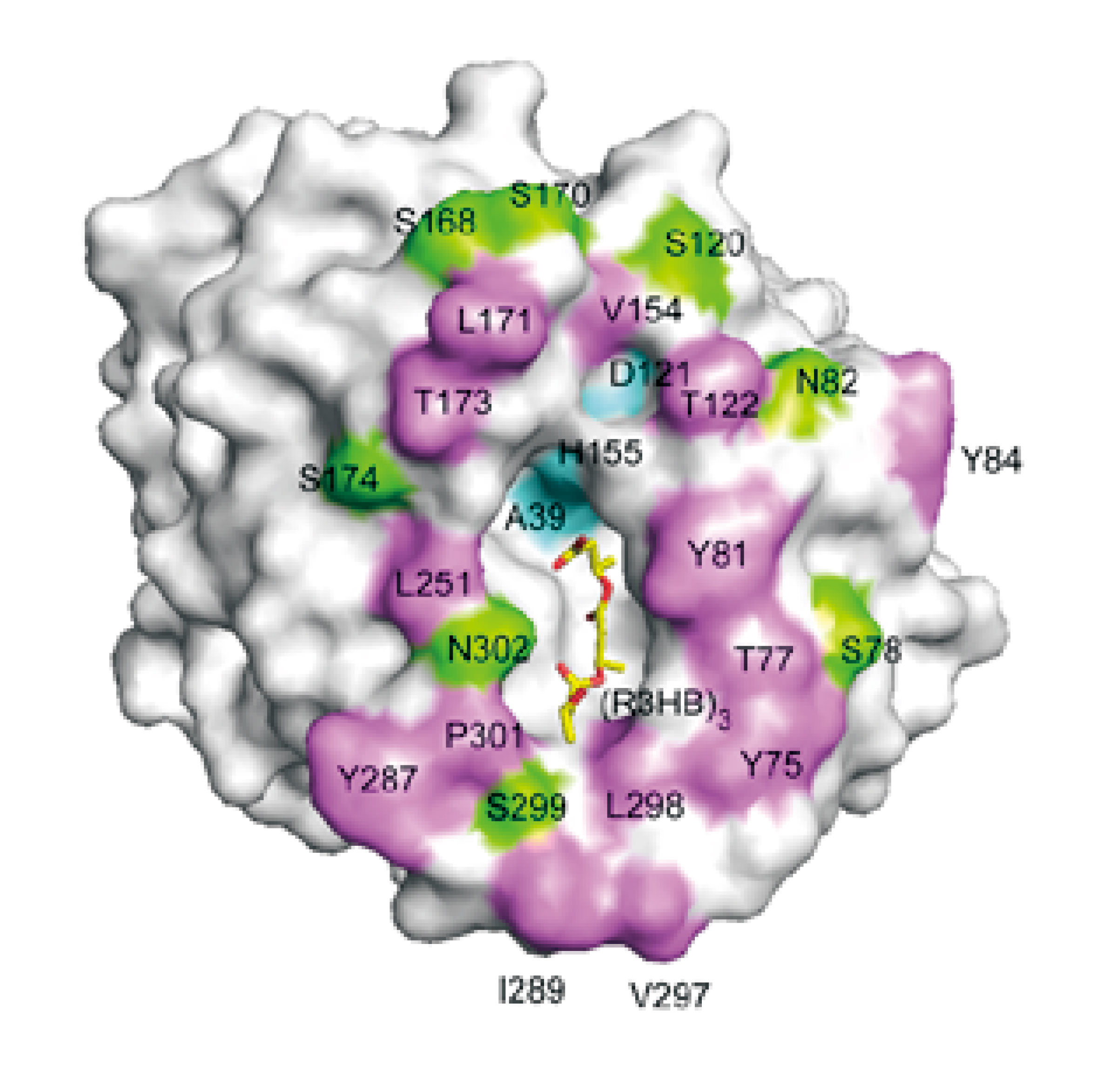
図6 PHB分解酵素の立体構造と3HBトリマーとのドッキングモデル
8.おわりに
炭素物質の循環型社会を構築するには、バイオマスを原料とした生分解性を有するバイオマスプラスチックの生産を第一に考えなければならない。しかし、現在開発されているバイオマスプラスチックは、トウモロコシやサトウキビなどから得られるデンプンを原料として生産されている。穀物を利用した高分子生産から脱却し、稲わらやコーン残渣などの農業廃棄物あるいは牧草などの草本類、さらには廃材や木質チップなどを含む木質バイオマスへとその原材料を変えていかなければならない。いかにして、食料と競合しないバイオマス資源から、新規で高性能なバイオマスプラスチックを生み出すかが今後の最も大きな課題である。
謝 辞
本研究を遂行するにあたり、一貫してご指導いただきました理化学研究所の土肥義治理事および共に研究に邁進してくれた高分子化学研究室卒業の博士研究員並びに学生諸氏に深く感謝いたします。また、播磨SPring-8の伊藤和輝博士、竹内晃久副主幹研究員、鈴木芳生副主席研究員、上杉健太朗研究員にも厚く御礼申し上げます。本研究は、理化学研究所環境分子科学研究II、文部科学省の科学研究費補助金(若手研究A、基盤研究B)で実施しており、ここに感謝いたします。
なお、本研究は大型放射光のBL47XUビームライン(2005B0039、2006A1064、2007A1991、2008A1651、2008B1775、 2009A1688、2009B1741)および理研ビームラインBL45XU(20070096、20080080、20090005)で行われた成果であり、関係者各位に感謝する。
参考文献
[1] 岩田忠久:高分子論文集 60 (2003) 377.
[2] T. Iwata : Macromol. Biosci. 5 (2005) 689.
[3] 岩田忠久:植物由来プラスチックの高機能化とリサイクル技術 サイエンス&テクノロジー 東京 第25章 (2007).
[4] R. W. Lenz and R. H. Marchessault : Biomacromolecules 6 (2005) 1.
[5] M. Lemoigne: Ann. Inst. Pasteur 39 (1925) 144.
[6] S. Kusaka, T. Iwata and Y. Doi : J. Macromol. Sci.- Pure Appl. Chem. A35 (2) (1998) 319.
[7] S. A. Gordeyev and Y. P. Nekrasov : J. Mater. Sci. 18 (1999) 1691.
[8] G. Schmack, D. Jehnichen, R. Vogel and B. Tandler : J. Polym. Sci. B, Polym. Phys. 38 (2000) 2841.
[9] H. Yamane, K. Terao, S. Hiki and Y. Kimura : Polymer 42 (2001) 3241.
[10] T. Iwata, Y. Aoyagi, M. Fujita, H. Yamane, Y. Doi, Y. Suzuki, A. Takeuchi and K. Uesugi : Macromol. Rapid Commun. 25 (2004) 1100.
[11] T. Iwata, Y. Aoyagi, T. Tanaka, M. Fujita, A. Takeuchi, Y. Suzuki and K. Uesugi : Macromolecules 39 (2006) 5789.
[12] 岩田忠久、田中稔久、土肥義治:公開WO-A1-2006038373.
[13] 田中稔久、青柳佳宏、山根秀樹、土肥義治、岩田忠久:繊維学会誌 60 (2004) 309.
[14] T. Tanaka, M. Fujita, A. Takeuchi, Y. Suzuki, K. Uesugi, K. Ito, T. Fujisawa, Y. Doi and T. Iwata : Macromolecules 39 (2006) 2940.
[15] T. Tanaka, K. Uesugi, A. Takeuchi, Y. Suzuki and T. Iwata : Polymer 48 (2007) 6145.
[16] 青柳佳宏:学位論文 埼玉大学大学院理工学研究科 (2003).
[17] T. Hisano, K. Kasuya, Y. Tezuka, N. Ishii, E. Oroudjev, H. Hansma, T. Kobayashi, M. Shiraki, T. Iwata, Y. Doi, T. Saito and K. Miki : J. Mol. Biol. 356 (2006) 993.
[18] T. Ohura et al.: Polym. Degrad. Stab. 63 (1999) 23.
[19] T. Yamamoto et al.: Int. Polym. Processing XII (1997) 29.
[20] D. P. Martin and S. F. Williams : Biochemical Engineering J. 16 (2003) 97.
[21] 未踏科学技術研究会 エコマテリアル研究会 監修:エコマテリアル学 日科技連出版社 東京 (2002)
岩田 忠久 IWATA Tadahisa
東京大学大学院 農学生命科学研究科 生物材料科学専攻
〒113-8657 東京都文京区弥生1-1-1
TEL:03-5841-7888 FAX:03-5841-1304
e-mail:atiwata@mail.ecc.u-tokyo.ac.jp








