Volume 18, No.2 Pages 69 - 74
1. 最近の研究から/FROM LATEST RESEARCH
長期利用課題報告 膜輸送体作動機構の結晶学的解明
Long-term Proposal Report: Crystallographic study on the mechanism of membrane transporters
東京大学 分子細胞生物学研究所 Institute of Molecular and Cellular Biosciences, The University of Tokyo
1. はじめに
2009B期からBL41XUを利用して、長期利用課題「膜輸送体作動機構の結晶学的解明」を、研究室のメンバー(小川治夫准教授、三村久敏助教、金井隆太助教、米倉慎一郎助教)とともに遂行した。この長期課題は、大きくは、イオンポンプ蛋白質の作動機構の原子構造による完全な理解を目指すものであり、具体的には4つのテーマから成る。すなわち、(ⅰ)10年以上にわたって追求してきた筋小胞体カルシウムポンプ(Ca2+−ATPase、SERCA1a)の反応サイクルの、本質的には最後の未決定の中間体ともいえるE1状態の結晶解析を完成させるとともに、ようやく大量発現・精製に成功した変異体の構造解析を進めること、(ⅱ)医学的生物学的にはより重要ともいえ、そのために激しい国際競争が続いているナトリウムポンプ(Na+,K+−ATPase)の複数の状態の結晶解析を進めること、(ⅲ)植物のプロトンポンプでありATPのかわりにピロ燐酸をエネルギー源とするH+−PPaseの構造研究を発展させること、(ⅳ)コントラスト変調法を用いて膜蛋白質結晶中の脂質二重膜を可視化すること、である。この4つのテーマそれぞれに関し大きな前進があったが、Nature誌2013年3月14日号にカルシウムポンプのE1·Mg2+状態の構造を発表したので[1] [1] C. Toyoshima, S. Iwasawa, H. Ogawa, A. Hirata, J. Tsueda and G. Inesi: Nature 495 (2013) 260-264.、本稿ではその解説を行うことにしたい。
2. カルシウムポンプのE1·Mg2+状態とは
細胞や細胞内の小器官は燐脂質からなる二重膜で外界から隔離されており、内と外でイオンの組成は大きく異なっている。脂質二重膜はイオンを通さないので、運搬のためにはチャネルやポンプが使われる。チャネルはゲート付の孔であり、濃度勾配(正確には化学ポテンシャル)に従ってイオンを輸送する。たとえば筋肉の収縮は、筋小胞体(筋細胞中にあって筋原繊維を取り囲むように存在する袋状の構造)に蓄えられていたCa2+イオンがチャネルを通して放出されることによって開始される。それを元の弛緩状態に戻すためには、放出されたCa2+イオンを筋小胞体中に汲み戻す必要がある。この汲み戻しを行うのがポンプ蛋白質であり、脂質二重膜に埋まった膜蛋白質である。汲み戻しの過程では濃度勾配に逆らった輸送が必要になり、エネルギーが必要である。生体中では多くの場合にエネルギー源として、エネルギーの通貨であるATP(アデノシン三燐酸)が使われる。すなわち、ATPがADP(アデノシン二燐酸)と無機燐酸(Pi)に加水分解されるときに放出される自由エネルギーが利用される。そのため、ポンプ蛋白質はATP加水分解酵素(ATPase)でもある。また、カルシウムポンプの場合、ATPがADPとPiに直接加水分解されるのではなく、いったん蛋白質のアスパラギン酸残基(Asp351)に燐酸が渡され、燐酸化アスパラギン酸が加水分解されるため、P型ATPaseと呼ばれる(例えば文献[2][2]C. Toyoshima: Arch. Biochem. Biophys. 476 (2008) 3-11.を参照)。
濃度勾配に逆らった輸送をするためには、ゲートが2つあり、順番に開閉することが必要である。カルシウムポンプを例にとると(図1に反応サイクルを示す)、E1状態では膜内にあるCa2+結合部位は細胞質側(細胞の内側)を向いており、Ca2+に対し高い親和性を持つ(強く結合する)。一方、E2状態ではCa2+結合部位は小胞体内腔側(細胞にとっては外側)を向き、Ca2+に対する親和性は低い。つまり、輸送の本質はCa2+に対する親和性の変化と同期したゲートの開閉である。蛋白質によるCa2+の結合もキレート剤のような化学物質による結合と本質的な差はなく、負の電荷を持つ酸素原子が6〜7個配位することによって行われる。蛋白質の場合は、アスパラギン酸やグルタミン酸のカルボキシル基に加え、主鎖のカルボニル基の酸素原子等も配位に使われる。即ち、カルシウムポンプの膜貫通部位にある結合部位は複数の荷電を持った酸素原子の集まりである。その結果、小胞体内腔側にCa2+を放出した後では荷電残基間の反発が起こるのは必然であり、蛋白質が不安定になるのを防ぐためにH+が代わって結合する。つまり、Ca2+の放出はCa2+とH+の交換反応である。これが、E2(正確にはE2·nH+)と呼ばれる状態であるが、pHが7以上では安定に存在できず、H+は自発的に細胞質側に放出され、E1状態になる。E1状態ではH+が外れているために、Ca2+結合部位はCa2+に対し高い親和性を持つ。
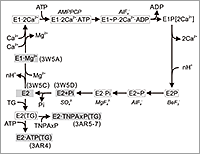
図1 筋小胞体カルシウムポンプ(Ca2+-ATPase、SERCA1a)の反応サイクル(簡略版)。
中間体を固定するために用いた燐酸アナログを斜体字で示す。PDBの登録番号を記載してあるのが今回の長期課題の成果。ATPはさまざまな中間体に結合でき、調節的役割を持つ。
すなわち、生理的条件下でCa2+が存在しない時、カルシウムポンプ(骨格筋白筋のものをSERCA1aと呼ぶ)はE1状態にあり、E2ではない。この点に関しては、現在でも、多くの文献に混乱が見られる。さらに、生理的条件下ではmMのMg2+が存在し、SERCA1aの多くはMg2+を結合している。このMg2+の親和性は低く(mMの解離定数)、Ca2+によって容易に追い出される。ここで重要なことは、このMg2+の結合によって、Ca2+の結合が促進されることである。図2に示すように、Ca2+結合に伴う(或いは必要とされる)構造変化は、蛋白質全体にわたる非常に大規模なものだが、その大部分はMg2+の結合によって実現されるのである。この促進効果はCa2+濃度が低いところで著しい。生理的にはµMかそれ以下のCa2+濃度での振舞いが重要であるが、こういう低濃度では、Ca2+イオンはなかなかSERCA1aに到達せず、それから構造変化を起こしたのでは遅すぎる(或いはCa2+を結合できるように構造変化している分子と遭遇する確率は小さすぎる)、ということが考えられる。Mg2+の方はCa2+の1000倍以上多く存在するから、それを加速に利用しない手はない、ということなのであろう。
いずれにせよ、生理的条件下ではこのE1·Mg2+状態がCa2+非存在下での安定的な状態と考えられ、構造的にはE2よりも2個のCa2+を結合したE1·2Ca2+状態に近いと考えられる。一方、生理的条件下ではmMレベルのATPが常に存在しており、ATPはかなり高い親和性を持ってE2状態、E1·Mg2+状態のSERCA1aにも結合できる。しかし、ATPからSERCA1aへの燐酸の転移は起こらない。転移が起こるためには、2個のCa2+結合が必須である。それでは、E1·Mg2+とE1·2Ca2+状態はどう違っていて、Ca2+の結合によって発生する「活性化シグナル」とは構造的には何なのか、それがこの研究の主題である。
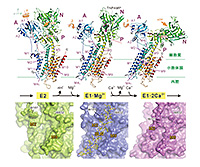
図2 SERCA1aのCa2+結合に伴う構造変化とサルコリピン(SLN)。
上段にはSERCA1aのみのリボンモデルを示す。N末端が青、C末端が赤である。細い赤線と1-3の幅広矢印は次の状態に移るときのAドメインの回転運動の軸と方向を示す。緑色の小球はMg2+を、紫色はCa2+を示す。下段は膜内領域のファン・デル・ワールス面とSLNの原子モデルを上段とほぼ同じ向きから見たもの。M2の運動によってM2-M9間の隙間は状態によって大きく変化し、E1·Mg2+のときにちょうどSLNがはまり込む大きさになることに注意。
3. カルシウムポンプE1·Mg2+状態の結晶構造解析
E1状態の結晶化には困難が予想された。実際、天然の筋小胞体膜中にあってもSERCA1aはこの状態だと急速に失活する。その理由を理解してもらうためには、分子全体の構造を概観しておく必要があろうかと思う。図2に得られた構造を、前段階のE2状態、2個のCa2+を結合した後のE1·2Ca2+状態と比較して示す。SERCA1aは分子量11万、994個のアミノ酸残基の単一ポリペプチド鎖よりなりNa+、K+−ATPaseなどに比べて単純な構造を持つ。3つの明瞭に分離した細胞質ドメイン(A、N、P)と10本の膜貫通ヘリックス(M1-M10)で構成され、Aドメインはイオン通路のゲートのactuatorとして働く。P(phosphorylation)ドメインには燐酸化されるアスパラギン酸残基Asp351やMg
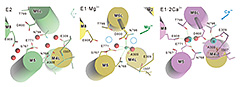
図3 SERCA1aの高親和性Ca2+結合部位の段階的形成。
E1·Mg2+状態のM4L ヘリックスを重ねて示す。緑色の小球はMg2+、水色はCa2+、赤は水分子を示す。E1·Mg2+状態での破線の円はE1·2Ca2+状態におけるCa2+の位置を示す。細胞質側から膜にほぼ垂直に見たもの。
M5は内腔側の表面からPドメインの端まで達する約60 Åの長いヘリックスであり、分子全体の背骨の働きをする。N末端側はPドメインの一部となっており、燐酸化サイトの近傍に位置する。Ca2+−ATPaseではM7〜M10は大きな構造変化を起こさず、膜に対する錨のようなものと考えられる。
膜貫通領域の運動は、M2、M5へリックスの動きに大きく依存する。E2状態では細胞質ドメインは寄り集まってコンパクトな構造を採る。そうでないと、Ca2+結合部位を形成する負の荷電を持った残基間の反発から、膜貫通へリックスは安定に存在できないであろう。それに対し、E1状態では細胞質ドメインは開いており、M2、M5も自由である(図2)。安定化するH+も無い。従って、膜貫通領域の運動もE2状態に比べてずっと大きいであろう。つまり、E1状態はSERCA1aの反応サイクル中最も不安定な状態と考えられる。E1·Mg2+状態では、2価陽イオンが1個膜内に結合するから、かなりの安定化を期待できるとはいえ、結合は弱くその効果は限定的と考えられる。実際、初期の結晶は半円形であり、非常に薄い層状の結晶が角度を変えて積み重なったものであった。これは細胞質ドメインが開いているためと考え、NドメインがPドメインに架橋されるよう、ATPの類似物であるTNPAMP (trinitrophenyl adenosine monophosphate)を加えたところ[3][3]C. Toyoshima, S. Yonekura, J. Tsueda, S. Iwasawa: Proc. Nat. Acad. Sci. USA 108 (2011) 1833-1838.、得られる結晶は棒状に変わった。しかし、これも実はさらに細い針の集まりであり、モザイク幅が巨大であることが多く、良い結晶が得られる確率は非常に低かった。結晶格子も2軸が長いうえに一定せず、難物である。5年を費やすことになったが、それでも分解能3.0 Åでの構造決定に成功したのは、ひとえに結晶を作ってくれた岩澤志穂さんの頑張りによるものである。
さて、図2を見ると、細胞質ドメインの開き方は小さく、E1·Mg2+の構造は、一見、E2に近い印象を受けるかもしれないが、はるかにE1·2Ca2+の方に近く、Mg2+によるCa2+結合の促進効果をよく説明するものである。E2状態とE1·2Ca2+状態を比べると、大きくは5つの構造変化が起こっている[2][2]C. Toyoshima: Arch. Biochem. Biophys. 476 (2008) 3-11.。(ⅰ)コンパクトな構造をとっていた細胞質ドメインの集合が開き、Aドメインが膜に垂直な軸の周りに〜110º回転する。(ⅱ)折れていた膜貫通ヘリックスM1、M2がまっすぐになるとともに、Aドメインの回転によって大きく位置を変える。(ⅲ)M3、M4ヘリックスが細胞質側にαヘリックスの一巻き分移動する。(ⅳ)M5ヘリックスがまっすぐになる。(ⅴ)M6のヘリックスがほどけている部分が大きく回転する。この5つは相互に関連している。たとえば、M5ヘリックスがまっすぐになることによって、Aドメインと水素結合を作っていたNドメインがAドメインから引きはがされ、Aドメインの回転をもたらす。この結果、ATPからAsp351への燐酸転移が可能になる。E1·Mg2+ではこのようなE1·2Ca2+に特徴的な構造変化のほとんどが実現されているが、M1ヘリックスだけはE2状態のまま、折れた構造を採っている。これは、膜内Ca2+結合部位へ通じるイオン通路が大きく開くことに対応している[1] [1] C. Toyoshima, S. Iwasawa, H. Ogawa, A. Hirata, J. Tsueda and G. Inesi: Nature 495 (2013) 260-264.。
では、肝心のMg2+結合部位はどうなっているのか。構造が出るまで、Mg2+は二つあるCa2+結合部位のうち、一つ目のCa2+の結合サイト(サイトⅠ)に結合すると予想していた。サイトⅡはCa2+結合蛋白に良く見られるEFハンド様の構造を持ち、主鎖カルボニル基の酸素原子3つが寄与するのに対し、サイトⅠは同じ7配位であっても、すべて側鎖と水分子の酸素原子から成る。つまり、サイトⅠは自由度が大きくMg2+でも結合できるサイト、サイトⅡはCa2+に特異的なサイトと考えたのである。この予想は見事に裏切られた(図3)。Mg2+はⅠとⅡの中間のⅡ寄りに、サイトⅠの側鎖もサイトⅡの主鎖も配位できるように位置していた。この配置は実に巧妙である。サイトⅠ Ca2+の配位に使われる酸素原子はMg2+の配位には使われていないから、Ca2+の結合はMg2+の解離を待つ必要がない。一方、Ca2+がサイトⅠに結合すると、この側鎖の配置は許されないから、Mg2+は追い出される。さらに、Ca2+サイトⅡに主鎖酸素原子を提供するM4LはMg2+の結合によってM6から離れて固定されており、サイトⅡは完全に破壊されている。従って、Ca2+は(サイトⅡの奥に位置する)サイトⅠに容易に到達できる。つまり、サイトⅠへCa2+が結合することによって、M4がM6の側に引き寄せられ、高親和性のサイトⅡが形成されるということになっているのである。しかも、この状態では、サイトⅠにCa2+が容易に達することができるよう、イオン通路は最も大きく開いている。これは、M1ヘリックスが折れ曲がっているためであり、二個のCa2+が結合するとM1ヘリックスはまっすぐに成る。実に良く出来ているではないか!さらに進んで「活性化シグナルとは何か」であるかを検討したいのだが、これは難問であって、実はこの答えが分からないために論文が書けずに随分苦しんだ。長くなるので、この説明[1] [1] C. Toyoshima, S. Iwasawa, H. Ogawa, A. Hirata, J. Tsueda and G. Inesi: Nature 495 (2013) 260-264.はまたの機会にしたい。
4. カルシウムポンプの調節蛋白質サルコリピン
実は、もっと驚くべきことがこの結晶構造には見つかった。この結晶は、非対称単位中に2分子のSERCA1aを含む。分解能が向上した結果、そのうちの1分子についてだけ、SERCA1aの他の結晶構造では見たことが無い膜貫通へリックスがM2、M9間に解像されたのである(図2)。このヘリックスは膜外領域をほとんど持たないことから、サルコリピン(sarcolipin、SLN)と呼ばれる31残基の小さな膜蛋白質であると予想された。SLNは主に速筋に存在しCa2+−ATPase活性のCa2+濃度依存性を改変する作用を持つ。
サルコリピンはこれまでホモログであるフォスフォランバン(phospholamban>、PLN と略す)との関連で議論されることが多かった。PLNは心臓におけるアドレナリンシグナルの直接的な標的として医学的に非常に重要な蛋白質である。SLNよりは長く52残基あり、2箇所の燐酸化部位を持つ。アドレナリンシグナルによる燐酸化が起こらない場合、PLNは心筋におけるカルシウムポンプSERCA2aの阻害剤として働く。つまり、アドレナリンシグナルに従って収縮力を強めることを可能にするため、普段はSERCA2aの活性を抑制し、いわば「貯め」をつくっているのである。SLNはその骨格筋版と考えられてきた。ところが、昨年になって、SLNは筋肉由来の熱発生と脂肪の燃焼に非常に重要な働きがあることが報告された[4] [4] N.C. Bal et al.: Nature Med. 18 (2012) 1574-1579.。これまでも、SLNはSERCA1aのATPあたりのCa>2+輸送能を低下させ、その代わりに熱を発生させるという報告は確かにあったが、広く認められて来たとは言いがたい。しかし、マウスでの実験では、高脂肪食を与えるとSLNの発現が増えて脂肪を燃焼させ、SLN欠損マウスではそれが出来ないために体脂肪が大きく増加することが報告されたのである。確かに、カルシウムポンプが熱発生に利用されることは魚類の発熱器官等でよく知られてはいたが、SLNが突如表舞台に登場することになったのである。
さて、まずは、このヘリックスがサルコリピンであることを証明しなければならない。その方策の一つとして、サルコリピンが存在しない発現蛋白質を用いて結晶化を行うことにした。これは、SERCA1aが分子量11万の大型膜蛋白質であるために、大変困難な課題である。Inesi博士と協力して10年以上前から取り組んできたが、小川准教授の頑張りにより、アデノウィルスと高等動物培養細胞を用いて、大型膜蛋白質の大量生産・精製がようやく自由にできるようになった。これは非常に大きな進歩であり、研究対象が大幅に広がったことを意味する。変異体は勿論であるが、これまで試料調製の困難さから手のつけようがなかったSERCA2aの結晶化に関しても、今や、PLNとの複合体の構造決定までが視野に入っている。いずれにせよ、SLNを含まない発現SERCA1aの結晶化に成功し、3.2 Å分解能で構造を決定した結果、SLNの有無による構造の違いが明らかになった。すなわち、SLNはM2−M9間の隙間に入り込んでM2−M9間を広げ、M2の運動を邪魔するのである。
このことは、図2を見てもらうと理解できると思う。前に述べたように、Ca2+の結合に伴って、Aドメインは110°回転し(図2の回転1)、それに伴ってM2の位置も大きく変化する。その結果、M2−M9間はE2では大きく開いており、E1·2Ca2+では狭くなる(図2、下段)。E1·Mg2+ではその中間であり、ちょうどSLNを結合できる隙間がある。SLNは従ってE1·Mg2+を安定化することになり、Ca2+結合時と非結合時の自由エネルギーの差を小さくするから、見かけ上、非結合状態の方へ平衡をずらす、つまり阻害剤として働くことになる。一方、SLNがサイトIへのCa2+の結合を阻害するかどうかは、今後の研究課題である。また、どうして、SLNがCa2+の運搬効率を下げることが出来るのかに関しては、まだ皆目わからない。これまでにSERCA1aの結晶構造解析はやり尽くした感があったが、易しいものが無くなったというだけであって、課題は実はどんどん広がっている。2013Aからの長期課題ではそれを追求したい。
参考文献
[1]C. Toyoshima, S. Iwasawa, H. Ogawa, A. Hirata, J. Tsueda and G. Inesi: Nature 495 (2013) 260-264.
[2]C. Toyoshima: Arch. Biochem. Biophys. 476 (2008) 3-11.
[3]C. Toyoshima, S. Yonekura, J. Tsueda, S. Iwasawa: Proc. Nat. Acad. Sci. USA 108 (2011) 1833-1838.
[4]N.C. Bal et al.: Nature Med. 18 (2012) 1574-1579.
東京大学 分子細胞生物学研究所
〒113-0032 東京都文京区弥生1-1-1
TEL: 03-5841-8492
e-mail:ct@iam.u-tokyo.ac.jp








