Volume 17, No.3 Pages 222 - 226
1. 最近の研究から/FROM LATEST RESEARCH
リチウムイオンを内包したC60フラーレンの岩塩型結晶
Rock-Salt-Type Crystal of C60 Fullerene with Encapsulated Lithium Cation
[1]名古屋市立大学大学院 システム自然科学研究科 Department of Information and Biological Sciences, Nagoya City University、[2]名古屋大学大学院 工学研究科 Department of Applied Physics, Nagoya University、[3]名古屋大学大学院 理学研究科 Department of Chemistry, Nagoya University
- Abstract
- リチウムイオンを1個内包したフラーレンLi+@C60は、正電荷を持った球形の分子であるために、分子それ自体が陽イオンに似た性質を示す。対となる陰イオンにPF6−を用いた場合、Li+@C60とPF6−が交互に配列した岩塩型構造を持つ結晶が得られる。Li+@C60はその結晶中で、高温においてほぼ自由に回転運動している。370 K付近の相転移を境にC60は回転運動を停止し、それより低温で特定の分子配向を持つ。一方、内包されたリチウムイオンは、100 K付近でもC60内部をかなり自由に運動している。100 K以下でリチウムイオンは、C60外部のPF6−との間に働く静電的な引力により、特定の2つの位置に等確率に占有するように温度の低下に伴い徐々に局在していく。
1.はじめに
空洞の球状炭素分子フラーレンに金属原子を内包させた“金属内包フラーレン”は、これまで走査型トンネル顕微鏡(STM)観察や理論計算などにより分子スイッチング機能を示すことが報告されており、単分子メモリーなどの分子デバイスへの応用が期待されている[1-4][1]Y. Yasutake, Z. Shi, T. Okazaki, H. Shinohara and Y. Majima: Nano Lett. 5 (2005) 1057-1060.
[2]M. Iwamoto et al.: J. Phys. Chem. C 114 (2010) 14704-14709.
[3]T. Huang et al.: Nano Lett. 11 (2011) 5327-5332.
[4]R. Jorn, J. Zhao, H. Petek and T. Seideman: ACS Nano 5 (2011) 7858-7865.
。しかしその合成収量は一般に極めて低く[5-7][5]K. Kikuchi et al.: Chem. Phys. Lett. 216 (1993) 67-71.
[6]H. Shinohara et al.: J. Phys. Chem. 97 (1993) 4259-4261.
[7]H. Shinohara: Rep. Prog. Phys. 63 (2000) 843-892.
、産業応用への道のりは険しい。著者らは近年、(株)イデアルスター、東北大学、(公財)高輝度光科学研究センターと共同で、リチウムイオン内包フラーレンLi+@C60の大量合成と分子構造決定に成功した[8-10][8]S. Aoyagi et al.: Nature Chem. 2 (2010) 678-683.
[9]青柳忍、西堀英治、澤博:日本結晶学会誌 53 (2011) 257-263.
[10]青柳忍、西堀英治、澤博:放射光 24 (2011) 73-80.
。Li+@C60は、現在イデア・インターナショナル株式会社より製品として販売されており、今後の産業応用が期待される金属内包フラーレンのひとつである。
Li+@C60は正電荷を持つために、SbCl6−のような陰イオンとイオン対を形成しやすい。SbCl6−との塩である [Li+@C60](SbCl6)− の結晶では、リチウムイオンは、C60の外側にあるSbCl6−に引き寄せられるように、C60の中心から変位した位置に観測された[8-10][8]S. Aoyagi et al.: Nature Chem. 2 (2010) 678-683.
[9]青柳忍、西堀英治、澤博:日本結晶学会誌 53 (2011) 257-263.
[10]青柳忍、西堀英治、澤博:放射光 24 (2011) 73-80.
。リチウムイオンのC60内での位置と運動は、対陰イオンの種類と配置によって変化する可能性がある。もしリチウムイオンの内包状態が、C60外部の環境に応答して変化するならば、その性質を利用した新しい分子デバイスを開発できるかもしれない。
本研究では、陰イオンをSbCl6−からPF6−に置換した [Li+@C60](PF6)− の結晶を作製し、その結晶構造をSPring-8の高輝度放射光を用いたX線回折実験によって調べた[11][11]S. Aoyagi et al.: Angew. Chem. Int. Ed. 51 (2012) 3377-3381.
。実験はビームラインBL02B1およびBL02B2で行った。本稿ではその結果を紹介する。
2. [Li+@C60](PF6)− の結晶構造と相転移
[Li+@C60](PF6)− の結晶は、Li+@C60とPF6−が交互に配列した立方晶系の岩塩型構造を持つ(図1)。岩塩型構造はイオン結晶の構造のうち、最も代表的で最も安定な構造のひとつである。岩塩型構造を持つ金属内包フラーレンの結晶はこれまで例がない。この構造的特徴から、Li+@C60が分子でありながら陽イオン的な性質を持つことが分かる。
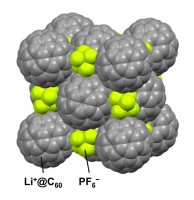
図1 [Li+@C60](PF6)− の結晶構造(低温相)。Li+@C60とPF6−が交互に配列した立方晶系の岩塩型構造である。370 K以上の高温相ではLi+@C60がほぼ自由に回転運動している。
[Li+@C60](PF6)− のC60の分子配列は、リチウムイオンを内包していない空のC60の結晶の分子配列に類似している。空のC60の結晶は、球形のC60分子が立方最密充填した面心立方(fcc)構造を形成する。 [Li+@C60](PF6)− の格子定数はα=14.3666(4) Å(300 K) であり、空のC60の結晶のα=14.17(1) Å(300 K) [12][12]P. A. Heiney et al.: Phys. Rev. Lett. 66 (1991) 2911-2914.
に比べて大きい。C60分子の大きさは、後述するとおり両者で大きな違いはない。従って [Li+@C60](PF6)− では、Li+@C60の分子間にPF6−陰イオンが入り込んで分子間距離を押し広げるために、格子が膨張していると言える。
C60の分子配向に着目すると、 [Li+@C60](PF6)− と空のC60の結晶とで大きな違いがある。 [Li+@C60](PF6)− では、室温(300 K)でC60分子は図1に示す特定の向きに配向している。一方、空のC60の結晶では、室温でC60分子はほぼ自由に回転運動している[12][12]P. A. Heiney et al.: Phys. Rev. Lett. 66 (1991) 2911-2914.
。当然空間群は異なっており、室温で [Li+@C60](PF6)− はPa3であるのに対し、空のC60はFm3mである。
C60の回転運動は、 [Li+@C60](PF6)− の結晶でも温度を上昇することで引き起こされる。図2に [Li+@C60](PF6)− の粉末X線回折パターンの温度変化を示す。室温から温度を上昇していくと、370 K付近で回折ピークの位置が不連続に変化する一次相転移が観測される。高温相への相転移に伴い、晶系は立方晶系のまま変化がないが、格子定数は0.7%ほど膨張する。消滅則も変化し、高温相では指数h k lが全て偶数のものと全て奇数のものを残して、それ以外の回折ピークは消滅する。つまり [Li+@C60](PF6)− の高温相は、空のC60の室温相と同じ、fcc構造を持つ。結晶構造解析の結果、高温相でC60がほぼ自由に回転していることが確かめられた(空間群はFm3m)。
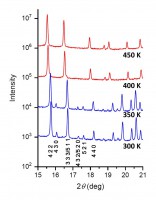
図2 [Li+@C60](PF6)− の粉末X線回折パターンの温度変化。370 K付近で、単純立方構造の低温相から、面心立方構造の高温相に一次相転移する。回折ピークの下の数字は指数h k lである。測定に用いたX線の波長は0.8 Åである。
これと似た相転移は、実は空のC60の結晶でも観測される。ただし相転移温度は室温よりも低い260 K付近である。これより低温でC60分子の回転運動は停止するが、分子配向は2種類の配向が許された無秩序構造となる(空間群はPa3)[13][13]W. I. F. David, R. M. Ibberson, T. J. S. Dennis, J. P. Hare and K. Prassides: Europhys. Lett. 18 (1992) 219-225.
。この無秩序構造は低温でガラス状態となって完全に秩序化することはない。5 Kでの2種類の分子配向の存在確率はおよそ8:2である。 [Li+@C60](PF6)− の低温相ではこのような無秩序構造は見られず、室温でもC60は特定の分子配向に完全に秩序化している。 [Li+@C60](PF6)− のC60の分子配向は、空のC60の結晶の2種類の分子配向のうち、存在確率の高い分子配向とほぼ同一である。
[Li+@C60](PF6)− の相転移と空のC60の相転移には類似性が見られるが、相転移温度と低温相の分子配向の点で大きく異なっている。 [Li+@C60](PF6)− では、相転移温度が高く(370 K)、低温相で分子配向の無秩序構造が見られない。このことは、 [Li+@C60](PF6)− ではC60の分子配向を秩序化させる相互作用が存在することを示している。この相互作用について後ほど議論する。
3.フラーレンケージの歪みと負の熱膨張
[Li+@C60](PF6)− のC60は完全に秩序化しているため、分子構造の精密解析に適している。溶液中のLi+@C60およびC60の13C NMRスペクトルは、どちらも単一ピークを示す[8][8]S. Aoyagi et al.: Nature Chem. 2 (2010) 678-683.
。従って溶液中では、分子を構成する60個の炭素原子は全て等価である。一方 [Li+@C60](PF6)− および空のC60の結晶中では、60の炭素原子は全て等価ではなく10の結晶学的に独立なものに分けられる。もしC60分子に歪みがなければ、10の独立な炭素の、C60の中心から原子位置までの距離(rC)は、誤差範囲内で一致するはずである。
単結晶構造解析で得たrCから [Li+@C60](PF6)− の結晶中のC60の歪みを調べた。rCの最も短い炭素原子は、分子中心からみて〈100〉に近い方向にあり、rC=3.541(1) Å(22 K) である。一方、rCの最も長い炭素原子は、分子中心からみて〈111〉に近い方向にあり、rC=3.556(1) Å(22 K) である。つまりC60は [Li+@C60](PF6)− の結晶中で、3つの主軸方向から圧縮されるように、わずかに歪んでいる。なお、22 KでのrCの平均値(すなわち分子半径)は3.550(1) Åである。この値は、粉末中性子回折で求められた空のC60の結晶の3.548(6) Åと誤差範囲内で一致する[14][14]W. I. F. David et al.: Nature 353 (1991) 147-149.
。
rCの温度変化からC60の熱膨張率を見積もった。熱膨張率は温度変化に対する体積変化の割合であり、温度の上昇に対して体積が増加する通常の物質では、熱膨張率は正の値である。rCは10の独立な炭素原子全てについて、300 K以下で温度の低下に対して長くなる傾向を持つ。300 Kと105 KでのrCの平均値は、それぞれ3.544(2) Åと3.548(1) Åである。つまり [Li+@C60](PF6)− のC60は、温度の低下に対して体積が増加する負の熱膨張を示す。この場合、熱膨張率は負の値である。rCの平均値から見積もった100 KでのC60の体積膨張率は、およそ−2×10−5 K−1である。C60分子の負の熱膨張は、過去に理論計算[15][15]Y.-K. Kwon, S. Berber and D. Tománek: Phys. Rev. Lett. 92 (2004) 015901-1-4.
やAr@C60のEXAFS測定[16][16]N. Dragoe et al.: Phys. Rev. B 84 (2011) 155448-1-4.
によっても報告されており、それぞれ、−1×10−5 K−1、−5×10−5 K−1と見積もられている。なお、 [Li+@C60](PF6)− の格子定数の熱膨張率は300 Kから25 Kまで正の値である。100 Kでの格子の体積膨張率はおよそ 6×10−5 K−1である。これはC60分子の負の熱膨張と相反するが、分子間距離の増大によって格子が熱膨張することを意味している。
4.リチウムイオンの熱運動と局在化
低温相でC60分子の回転運動は停止しているのに対し、リチウムイオンはC60内部の複数の位置を占有している。最大エントロピー法(MEM)によって求めた155 Kでのリチウムイオンの電子密度の分布を図3(a)に示す。半径1.5 Å程度の球殻状に電子密度が分布している。球殻上の電子密度は完全に一様ではなく、C60の6員環の中心近傍で電子密度がやや濃くなっている。このことから、リチウムイオンは20個ある6員環の中心近傍を、動的に熱運動しているか、静的にランダムに占有していると考えられる。
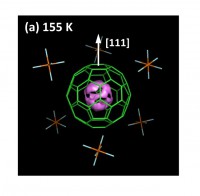
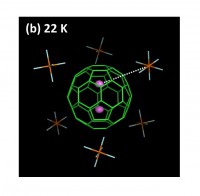
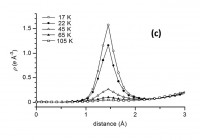
図3 [Li+@C60](PF6)− のC60内部のMEM電子密度の分布。(a)と(b)は単結晶X線回折により求めた電子密度から、リチウムイオンを仮定していないモデル電子密度を差し引いた差電子密度のC60内部の等電子密度面である。(a)は155 Kの0.015 eÅ−3の等電子密度面、(b)は22 Kの0.100 eÅ−3の等電子密度面を示す。(b)中の白い点線は、リチウムイオンとPF6−を結ぶ直線で、両者の間にC60の6員環があることが分かる。(c)は、C60中心を原点にとった3回回反軸([111]軸)上の電子密度プロファイルの温度変化。温度低下に伴うリチウムイオンの局在化により100 K以下で電子密度ピークが高くなっていく。
C60内部のリチウムイオンは100 K以下で、温度低下に伴い徐々に局在していく。22 Kでのリチウムイオンの電子密度の分布を図3(b)に示す。C60の中心から1.40 (1) Å変位した、3回回反軸([111]軸)上の反転対称の関係にある等価な2つの位置に、電子密度が局在している。C60の中心を原点にとった3回回反軸上の電子密度プロファイルの温度変化を図3(c)に示す。リチウムイオンの局在化は、50 K以下で急激に進行する。リチウムイオンの局在化が温度低下によって引き起こされることから、100 K以上での非局在な電子密度分布(図3(a))は、リチウムイオンの動的な熱運動によるものであると考えられる。
リチウムイオンの大きな熱運動は、PF6−陰イオンの配置から理解することができる。C60の6員環の中心近傍がリチウム原子の安定位置であることは理論計算でも示されており[17][17]M. Zhang, L. B. Harding, S. K. Gray and S. A. Rice: J. Phys. Chem. A 112 (2008) 5478-5485.、100 K以上でリチウムイオンが20個の6員環の中心近傍を占有することは不自然でない。しかし [Li+@C60](SbCl6)− の結晶では、370 Kの高温でもリチウムイオンは、Li+@C60に配位したSbCl6−陰イオンに引き寄せられるようにC60内に局在している[8-10][8]S. Aoyagi et al.: Nature Chem. 2 (2010) 678-683.
[9]青柳忍、西堀英治、澤博:日本結晶学会誌 53 (2011) 257-263.
[10]青柳忍、西堀英治、澤博:放射光 24 (2011) 73-80.
。 [Li+@C60](PF6)− では、6つのPF6−陰イオンが1つのLi+@C60の周囲に、対称的に正八面体の頂点位置になるように配位している(図1、図3(a, b))。その結果PF6−からリチウムイオンに働く静電的な引力が弱め合うために、リチウムイオンがC60内で局在化しにくいものと考えられる。
リチウムイオンが100 K以下で局在化する位置は、リチウムイオンにとって最安定な位置である。この位置は、3つのPF6−陰イオンが等距離で配位している(図3(a, b))。そのような位置は合計で8つあるが、そのうち3回回反軸上の2つはC60の6員環の中心近傍で安定であるのに対し、それ以外の6つは炭素と炭素の結合の近傍であるために安定でない。22 Kの低温でも2つの位置を等確率に占有している状態は、リチウムイオンが、静的に2つの位置のうちのどちらかをランダムに分子によって二者択一して占有しているか、量子的に分子内の2つの位置をトンネリングしているモデルによって説明できる。
リチウムイオンとPF6−陰イオンとの間の静電的相互作用は、C60の分子配向にも影響している。6員環の中心近傍がリチウムイオンの安定位置であるため、リチウムイオンがPF6−陰イオンに引き寄せられたとき、C60は6員環の中心をリチウムイオンとPF6−陰イオンの間に置く配向をとる方が安定である(図3(b))。空のC60の結晶で現れる2種類の分子配向のうち、存在確率の高い分子配向では6員環中心がリチウムイオンとPF6−陰イオンの間に位置する。一方、存在確率の低い分子配向では5員環中心がリチウムイオンとPF6−陰イオンの間に位置する。その結果 [Li+@C60](PF6)− では、空のC60の存在確率の高い分子配向は安定化されるが、存在確率の低い分子配向は不安定となるため出現しない。存在確率の高い分子配向が安定化された結果、 [Li+@C60](PF6)− ではC60分子を回転させるのに空のC60の結晶より大きなエネルギーが必要となる。そのために、C60の自由回転を引き起こす相転移温度は高温側にシフトする。
5.おわりに
[Li+@C60](PF6)− の岩塩型結晶構造は、Li+@C60の陽イオン的な性質と共に、C60の6員環を隔てて働くリチウムイオンと対陰イオンとの間の強い引力的相互作用の存在を証明している。SPring-8の高輝度放射光を利用することで、X線では観測が困難なリチウムイオンの熱運動の温度変化に加えて、C60のわずかな歪みや負の熱膨張も捉えることに成功した。
Li+@C60の内包構造は、対陰イオンの種類や配置、温度に応答して変化する。分子デバイスへの応用を考えたとき、外部から印加した電場に対してどのような応答をするかに興味が持たれる。 [Li+@C60](PF6)− では低温でリチウムイオンは2つの位置を等確率に占有しているが、外部電場を印加することで、この2つの位置の占有率に不均衡が生じるかもしれない。今後、誘電率測定や電場下X線結晶構造解析による、Li+@C60の外部電場応答特性の解明が望まれる。
謝辞
本研究は、イデア・インターナショナル株式会社 笠間泰彦博士、東北大学 飛田博実教授、東京大学 岡田洋史博士との共同研究により進められた。SPring-8での実験は、長期利用課題(2009B0027)、重点パワーユーザー課題(2009A0083、2009A0084) の中で行われた。実験にご協力頂いた(公財)高輝度光科学研究センター 杉本邦久博士、安田伸広博士に厚くお礼を申し上げる。本研究は、文部科学省科学研究費補助金(20360006、19051015)、名古屋市立大学特別研究奨励費の助成のもと行われた。
参考文献
[1]Y. Yasutake, Z. Shi, T. Okazaki, H. Shinohara and Y. Majima: Nano Lett. 5 (2005) 1057-1060.
[2]M. Iwamoto et al.: J. Phys. Chem. C 114 (2010) 14704-14709.
[3]T. Huang et al.: Nano Lett. 11 (2011) 5327-5332.
[4]R. Jorn, J. Zhao, H. Petek and T. Seideman: ACS Nano 5 (2011) 7858-7865.
[5]K. Kikuchi et al.: Chem. Phys. Lett. 216 (1993) 67-71.
[6]H. Shinohara et al.: J. Phys. Chem. 97 (1993) 4259-4261.
[7]H. Shinohara: Rep. Prog. Phys. 63 (2000) 843-892.
[8]S. Aoyagi et al.: Nature Chem. 2 (2010) 678-683.
[9]青柳忍、西堀英治、澤博:日本結晶学会誌 53 (2011) 257-263.
[10]青柳忍、西堀英治、澤博:放射光 24 (2011) 73-80.
[11]S. Aoyagi et al.: Angew. Chem. Int. Ed. 51 (2012) 3377-3381.
[12]P. A. Heiney et al.: Phys. Rev. Lett. 66 (1991) 2911-2914.
[13]W. I. F. David, R. M. Ibberson, T. J. S. Dennis, J. P. Hare and K. Prassides: Europhys. Lett. 18 (1992) 219-225.
[14]W. I. F. David et al.: Nature 353 (1991) 147-149.
[15]Y.-K. Kwon, S. Berber and D. Tománek: Phys. Rev. Lett. 92 (2004) 015901-1-4.
[16]N. Dragoe et al.: Phys. Rev. B 84 (2011) 155448-1-4.
[17]M. Zhang, L. B. Harding, S. K. Gray and S. A. Rice: J. Phys. Chem. A 112 (2008) 5478-5485.
名古屋市立大学大学院 システム自然科学研究科
〒467-8501 愛知県名古屋市瑞穂区瑞穂町山の畑1
TEL:052-872-5061
e-mail:aoyagi@nsc.nagoya-cu.ac.jp
名古屋大学大学院 工学研究科
〒464-8603 愛知県名古屋市千種区不老町
TEL:052-789-3702
e-mail:eiji@mcr.nuap.nagoya-u.ac.jp
名古屋大学大学院 工学研究科
〒464-8603 愛知県名古屋市千種区不老町
TEL:052-789-4453
e-mail:hiroshi.sawa@cc.nagoya-u.ac.jp
名古屋大学大学院 理学研究科
〒464-8602 愛知県名古屋市千種区不老町
TEL:052-789-3660
e-mail:sado.yuki@g.mbox.nagoya-u.ac.jp
名古屋大学大学院 理学研究科
〒464-8602 愛知県名古屋市千種区不老町
TEL:052-789-2477
e-mail:r.kitaura@nagoya-u.jp
名古屋大学大学院 理学研究科
〒464-8602 愛知県名古屋市千種区不老町
TEL:052-789-2482
e-mail:noris@cc.nagoya-u.ac.jp








