Volume 08, No.6 Pages 401 - 405
3. 最近の研究から/FROM LATEST RESEARCH
X線回折法によるタンパク質の光誘起反応中間体構造解析
〜ヒトヘモグロビンにおける光誘起構造変化の直接観測〜
X-ray structure analysis of photo-induced reaction intermediates of proteins
– Direct observation of photo-induced tertiary structural changes in human hemoglobin –
[1]高エネルギー加速器研究機構 物質構造科学研究所 Institute of Materials Structure Science, High Energy Accelerator Research Organization (KEK)、[2]理化学研究所 播磨研究所 Harima Institute, RIKEN、[3]横浜市立大学大学院 総合理学研究科 Graduate School of Integrated Science, Yokohama City University、[4]自治医科大学 生理学講座 Department of Physiology, Jichi Medical School
- Abstract
- Proteins are encoded in genes and play a wide variety of functions in life. Three dimensional (3-D) protein structures, determined by conventional X-ray crystallographic technique and also by multidimensional nuclear magnetic resonance (NMR) spectroscopy, have provided a solid base for understanding their 3-D architecture. However, relatively little information has been extracted from these studies about how the proteins do their tasks, because the 3-D structural information is essentially static. To understand the mechanistic details of how proteins function, it is crucial to know the dynamic features of the events that give rise to their designed functions. We have been working on cryogenic trapping technique of photoactive intermediates of proteins at the BL44B2, SPring-8, and here we present our experimental setup and direct observation of photo-induced tertiary structural changes in human hemoglobin.
1.はじめに
生体内のタンパク質の働きには、タンパク質構造の何らかの動き(構造変化、ダイナミクス)が必ず伴っている。それは、自分の体の中で日常的に行われている生理作用(例えば、呼吸や消化や筋肉の収縮・弛緩といったこと)を思い浮かべれば自ずと明らかである。現在、多くの大規模タンパク質構造解析プロジェクトにより蓄積されつつある構造情報のほとんどはタンパク質の安定な平衡状態の構造に関するものであるが、これらの構造情報にさらにタンパク質のダイナミクスに関する構造情報が加わることにより、我々のタンパク質構造に対する知見はより重層的なものとなり、例えば新規医薬品の開発に対してより多角的な方針を与えることができると期待される。
結晶構造解析法と構造ダイナミクスとの関連を考えた場合、結晶構造解析の結果は原理的に平均構造付近の熱振動に関する情報を含んでいる。さらに、光や熱、圧力などの外的刺激により結晶全体または一部においてコヒーレントに非平衡状態を生成させることができる場合には、平衡状態から非平衡状態へ至る過程の構造解析が可能となる。非平衡状態を構造解析する方法としては、低温条件下で非平衡状態を安定に蓄積する方法、ポンププローブ法によりトランジェントに生成した非平衡状態を短時間で測定する方法などが可能であるが、本稿では前者の方法で低温条件下でタンパク質の非平衡状態の結晶構造解析を行った例について紹介する。
2.タンパク質結晶学における試料冷却法
タンパク質結晶学の分野では、試料の放射線損傷による測定データの劣化が古くからの問題となっており、その対策として1980年代後半から液体窒素温度付近での結晶試料冷却法の開発が進められてきた [1,2] 。タンパク質結晶における放射線損傷は、放射線照射によって試料中の水分子がイオン化し、これによって生成する水和ラジカルがタンパク質分子を攻撃して、S-S結合の切断や脱カルボニル化といった構造変化を引き起こすことにより進行すると考えられており、その対処法として結晶試料凍結法が開発された。この方法では試料を液体窒素温度付近で凍結することにより試料中でのラジカルの拡散を抑えることができ、試料の損傷を劇的に低減することが可能となった。一方国内においては、試料冷却技術の導入が海外に比べて比較的遅れていたが、1997年からSPring-8においてタンパク質結晶のX線回折実験が開始されて以降、室温実験では高輝度X線による試料の放射線損傷が致命的で全く測定にならないことが明白となり、試料冷却の技術が国内で爆発的に普及したという経緯がある。現在、SPring-8のすべてのタンパク質結晶構造解析用のビームラインにおいて低温の窒素ガスを試料に吹き付けるタイプの試料冷却装置が備え付けられており、ほとんどの場合90〜100K付近の試料温度で実験が行われている。
一方、試料冷却技術の普及は、試料凍結法による短寿命反応中間体の結晶構造解析という別の重要な利用法も生み出した。この方法は低温下でタンパク質結晶中での反応速度を低下させ、結晶中に生成・蓄積する短寿命反応中間体を低温条件下で安定に捕捉(凍結トラップ)する方法である。これまでに、バクテリオロドプシンなどの光反応性タンパク質や、X線によるラジオリシスを受ける酸化酵素、光反応性のある基質(ケージド化合物)を含んだ酵素の結晶を試料として、反応中間体の凍結トラップによる構造解析が行われている [3-5] 。現在では試料冷却法があまりにも当たり前の技術になったため、低温トラップ実験をどこのビームラインにおいても手軽に試してみることが可能になった。我々は、理研構造生物学ビームラインBL44B2において、より進んだ低温トラップ実験を行うための装置整備を行い、その利用実験を進めてきた。そして最近、一酸化炭素結合型ヘモグロビン結晶を用いた光誘起短寿命中間体の結晶構造解析を行い興味深い結果を得たので、その成果について報告する。
3.測定装置
我々は反応中間体構造解析を進めるために、理研構造生物学ビームラインⅡ(BL44B2)において装置の整備を進めてきた。それらは主に顕微分光装置とヘリウム吹き付け式の試料冷却装置の2点である。回折計、X線CCD検出器、測定制御装置、回折データ解析ソフトウエア等に関しては従来BL44B2で使用しているものをそのまま流用している。
3-1. 顕微分光装置 [6]
結晶に何らかの摂動を加えて反応を開始させ反応中間状態を作り出す場合、その摂動による結晶内反応の進行をモニターするために何らかの指針が必要となる。一般にタンパク質は、紫外から可視部に電子遷移に由来する吸収を持つので、反応進行に伴う吸収スペクトル変化をモニターすることが原理的に可能である。ただし一般に、放射光ビームラインで測定に用いるタンパク質結晶のサイズは約100ミクロン角程度であり、またその形状も様々なので、その紫外可視吸収スペクトル測定は一般には容易ではなく、顕微光学系を使った分光測定が必要となる。また、結晶中のタンパク質濃度は溶液中とは比べ物にならないほど高いので、試料によっては入射光に対する透過光の比率が10-5程度といった厳しい条件で測定をしなければならない。
図1に顕微分光装置を示す。我々は市販の落射蛍光型顕微鏡を改造し、これに分光部と検出部をつけることにより顕微分光装置を構築し、ビームラインの実験ハッチ内に設置した。そしてX線回折データ測定と同じセットアップでの結晶の顕微分光スペクトル測定を実現した。この装置は反応中間体のモニターだけでなく、X線照射による結晶試料の放射線損傷をモニターする上でも有用であることが示されている [7] 。

図1 BL44B2に設置された顕微分光装置
3-2.ヘリウム吹き付け式試料冷却装置 [8]
通常タンパク質構造解析ビームラインで使用されている冷却窒素ガス吹き付け式の冷却装置は最低温度90K程度までの設定が可能である。一般に、タンパク質結晶の放射線損傷を防ぐためにはこの程度の温度で十分であるが、結晶中の分子の熱振動をさらに低下させたい場合や、反応中間体をトラップするという目的のためには、より低い温度設定が必要となる場合も考えられる。この目的のために、25Kまで温度設定が可能なヘリウム吹き付け式試料冷却装置(理学電機製)をビームラインに設置した。この装置では冷却ガスとして、乾燥窒素ガスの代わりにヘリウムガスを使用しており、2段階式のコールドヘッドによりコールドヘッド先端部は10Kに到達する。吹き出し口から5㎜の位置に試料をおいた場合、最低到達温度25Kが可能である。
4.ヘモグロビンの光誘起反応中間体の低温結晶構造解析 [9]
我々はよく知られている酸素運搬タンパク質であるヘモグロビンを試料として、その光誘起反応中間体の低温結晶構造解析を試みた。肺において空気中から体内に取り込まれた酸素は、赤血球中にあるヘモグロビンに結合し、血管を通って体内の各組織へと運ばれる。この際に、ヘモグロビンは単に酸素を着脱するだけではなく、酸素濃度の高い肺では酸素親和性を高くして、より多くの酸素を結合させ、逆に酸素濃度の低い末端組織では酸素親和性を低くして、組織により多くの酸素を与えることができる。このような、ヘモグロビンの酸素結合における酸素親和性調節の現象はアロステリック効果による協同性のモデルとして、古くから多くの研究者の研究対象となってきた。1960年代のMax PerutzらによるX線結晶構造解析研究から [10]、ヘモグロビンは高酸素親和性型(relaxed型またはR型)と低酸素親和性型(tense型またはT型)の2つの4次構造をとることが明らかとなり、酸素結合が「引き金」となってR型とT型の間を構造転移するというtriggerモデルが提唱されている。 しかし、R型でなぜ酸素親和性が高く、逆にT型で酸素親和性が低くなるのかという最も基本的な問題については、これまで多くの状況証拠が蓄積されているものの、それを直接的に証明する実験結果は得られていなかった。我々は、R型とT型ヘモグロビンの結晶を別々に調製し、低温条件下で結合した配位子分子を光によって解離させるという方法を用い、特にT型における構造歪みと低酸素親和性の関係を明らかにすることを試みた。
ヘモグロビンはα、βという構造の類似した2種類のサブユニットそれぞれ2つずつが組み合わさって構成されるα2β2タイプの4量体タンパク質である。それぞれのサブユニットはヘムと呼ばれる鉄含有補欠分子を含み、全体として4個の配位子分子を結合させることができる。我々は、配位子として酸素の代わりに酸素と同様な構造を持ち、より光解離効率の高い一酸化炭素(CO)分子を用い、ヘモグロビンに4つのCOが結合したR型ヘモグロビン結晶と、COが4つのサブユニットのうちの2つにだけ結合したT型ヘモグロビン結晶を作成した。T型結晶については、T型を保ったままCOを2個だけ結合させるために、ヘモグロビンに含まれる4個の鉄のうちα、βどちらかのサブユニットに含まれる2個の鉄をニッケルに置換することにより、このような状態の結晶を作成し、これらの結晶を用いてX線回折データ測定を行った。この測定では、結晶を25Kに冷却し、結晶に連続的にHe-Neレーザー(632.8nm,15mW)を照射することによりヘモグロビンに結合したCOを解離させ、擬似的にヘモグロビンにCOが結合する直前の準安定状態を比較的長時間安定に作り出すことに成功した。この準安定状態を保ったまま、1.45Å程度のX線回折強度データを得て、RおよびT型ヘモグロビンのCOが光解離した準安定状態の構造を決定することができた。測定データの統計精度と精密化パラメータの詳細については文献を参照していただきたい。
解明された構造から、光照射によって鉄から解離したCOは、タンパク質内部の鉄周辺の疎水的なポケット内で捕捉された状態でとどまっており、この実験によって、まさにヘモグロビンにCOが結合する直前の準安定状態が作り出されていることがわかる(図2)。さらにCO光解離によるヘモグロビン内部での構造変化をより詳細に見てみるために、(│Flight│-│Fdark│)を係数としたフーリエ合成図を計算した。各反射の位相は、光解離していない状態の構造解析から得られた原子座標を用いて計算した。図3に、T型構造でαサブユニットにCOが結合した結晶についての差フーリエ図を示す。T型とR型結晶の比較から、T型結晶ではCOの光解離に伴ってヘム上部(COが結合した側)で構造変化が起こると同時に、鉄とヒスチジン残基(H(F8))との結合を介して、ヘム下方のタンパク質部分が押し出されるように移動する動き(ヘム下部の赤青色交互の電子密度に対応)が明瞭に観測された。すなわちT型結晶ではCO結合位置周辺に大きな構造歪みが蓄積されていることが明らかとなり、これらの構造歪みがT型ヘモグロビンの低酸素親和性の直接的な原因であると考えられる。さらに同じT型でもαサブユニットとβサブユニットでは、構造歪みの蓄積されている場所が有意に異なり、αサブユニットではその歪みが鉄原子とヒスチジン残基(H(F8))との結合を介してFへリックス方向に伝達されてゆくのに対して、βサブユニットでは、鉄に結合したCOとその周辺のバリン側鎖(V(E11))の間の立体障害が主要な構造歪みとなっていることを明瞭に示すことができた。
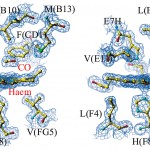
図2 T型ヘモグロビンCOにおいて、COが光解離した準安定状態の構造(αサブユニットヘム周辺の2Fo-Fcマップ、1.3σレベル、ステレオ図)。
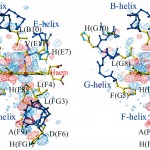
図3 T型ヘモグロビンαサブユニットヘム周辺におけるCO光解離前後の電子密度変化。(│Flight│-│Fdark│)を係数としたフーリエ図(±3σレベル、ステレオ図)で表示した。赤の電子密度(負)は光解離前、青の電子密度(正)は光解離後の構造にそれぞれ由来する。
5.今後の展開
前述のとおり、ヘモグロビンに限らず生体内のすべてのタンパク質はその機能を発現するために「動き」を伴っている。この機能発現のための構造変化に迫るためには、単に通常の静的構造のX線結晶構造解析のアプローチだけでは困難であり、この研究のような機能発現に連携した動的構造解析が必須である。構造ゲノム科学の発展で多くのタンパク質の静的構造が解析されつつある今日、タンパク質の機能発現機構を包括的に理解するためには、このようなアプローチが今後ますます重要になると考えられる。
6.おわりに
理研ビームラインⅡにおける上記の装置開発は理研内部予算によって行われた。関係の方々に感謝いたします。
参考文献
[1]H.A.Hope : Acta Cryst.B44(1988)22.
[2]T.-Y.Teng : J.Appl.Cryst.23(1990)387.
[3]H.Luecke et al. : Science 286(1999)255.
[4]G.I.Berglund et al. : Nature 417(2002)463.
[5]T.Ursby et al. : Acta Cryst. D58(2002)607.
[6]K.Sakai et al. : J.Appl.Cryst.35(2002)270.
[7]Y.Matsui et al. : J.Mol.Biol.324(2002)469.
[8]M.Nakasako et al. : Rev.Sci.Instrum.73(2002)1318.
[9]S.Adachi et al. : Proc.Natl.Acad.Sci.USA 100(2003)7039.
[10]M.F.Perutz : Nature 228(1970)726.
足立 伸一 ADACHI Shin-ichi
高エネルギー加速器研究機構 物質構造科学研究所 物質科学第二研究系
〒305-0801 茨城県つくば市大穂1-1
TEL:029-879-6022 FAX:029-864-3202
e-mail:shinichi.adachi@kek.jp
城 宜嗣 SHIRO Yoshitsugu
理化学研究所 播磨研究所 生体物理化学研究室
〒679-5148 兵庫県佐用郡三日月町光都1-1-1
TEL:0791-58-2817 FAX:0791-58-2818
e-mail:yshiro@postman.riken.go.jp
朴 三用 PARK Sam-Yong
横浜市立大学大学院 総合理学研究科 生体超分子システム科学専攻
〒230-0045 神奈川県横浜市鶴見区末広町1-7-29
TEL:045-508-7229 FAX:045-508-7366
e-mail:park@tsurumi.yokohama-cu.ac.jp
Jeremy R. H. Tame
横浜市立大学大学院 総合理学研究科 生体超分子システム科学専攻
〒230-0045 神奈川県横浜市鶴見区末広町1-7-29
TEL:045-508-7228 FAX:045-508-7366
e-mail:jtame@tsurumi.yokohama-cu.ac.jp
柴山 修哉 SHIBAYAMA Naoya
自治医科大学 生理学講座 生物物理学部門
〒329-0498 栃木県河内郡南河内町大字薬師寺3311-1
TEL:0285-58-7308 FAX:0285-40-6294
e-mail:shibayam@jichi.ac.jp








