Volume 04, No.4 Pages 35 - 40
5. 最近の研究から/FROM LATEST RESEARCH
水素酸化還元酵素のX線構造化学
X-ray Structural Study for Hydrogenase
京都大学大学院 理学研究科 Division of Chemistry, Graduate School of Science, Kyoto University
- Abstract
- Hydrogenases are enzymes which are responsible for the hydrogen metabolism in bacteria. The active site of the [NiFe] hydrogenase has been reported as a hetero binuclear Ni-Fe complex with four non-protein ligands. The Ni atom is coordinated by four sulfur atoms of cysteinyl residues, and two of them coordinate to the Fe atom making the bridges between two metal atoms. The four non-protein ligands of the [NiFe] hydrogenase from D. vulgaris Miyazaki F in the oxidized form were assigned as SO, CO, CN and S. In contrast, those in the hydrogenase from D. gigas were reported as CO, CN, CN and O. Recently we found that the hydrogenase of Miyazaki strain liberated H2S upon reduction with H2 in the presence of its electron carrier. The x-ray crystal structure of the H2-reduced form of the Miyazaki enzyme at 1.4 Å resolution was successfully solved and refined to a crystallographic R-factor of 21.8 %. Though the structure was almost identical to that of the oxidized form, the non-protein monatomic bridge which was observed between the Ni and Fe atoms in the oxidized form disappeared. Considering the experimental results mentioned above, we have concluded that the monatomic bridge ligand between the Ni and Fe atoms must not be a oxygen species but a sulfur species, and this ligand should be removed as H2S when the enzyme is activated upon reduction with H2. This sulfur bridging ligand may have an essential key role for the catalytic cycle of the [NiFe] hydrogenase.
1.はじめに
水素酸化還元酵素はヒドロゲナーゼと呼ばれ、広くバクテリアに見られるタンパク質である。一般には鉄、ニッケル、などを持つ金属タンパク質であるが、最近これらの金属を全く持たない新規のヒドロゲナーゼも発見されている。この分子が水素を分解して生じる電子は菌体内の様々な酸化還元反応を円滑に進めていくのに利用される。また、細胞の膜表層で膜内外のプロトン濃度勾配を直接支配するため、ATP合成分解酵素との関連も含めて細菌内のエネルギー代謝系で重要な役割を担っていると考えられている。この酵素の研究の歴史は長く、白金などと同様の触媒能を持つことから、化学反応のための新しい触媒として注目されていた。さらにこの分子の水素合成・分解の触媒能は近年の石油エネルギーの過剰利用による環境汚染問題に絡めて、水素エネルギー源や燃料電池など、工業的応用の可能性も示唆されている。
我々が研究しているヒドロゲナーゼは硫酸還元菌・Desulfovibrio vulgaris Miyazaki F 株という偏性嫌気性菌のもので、その活性中心の金属原子の構成から[NiFe]ヒドロゲナーゼと呼ばれている。この酵素は周辺質膜に結合した膜タンパク質である。D. vulgaris Miyazaki F株のヒドロゲナーゼの特徴を表1に示す。
表1 Desulfovibrio vulgaris Miyazaki Fの[NiFe]ヒドロゲナーゼの特徴

2.2つの立体構造 −金属活性中心における異なる配位子の同定
我々は1987年に世界で初めてヒドロゲナーゼの結晶化には成功したが[1]、酵素の全体構造はフランス・構造生物学研究所のX線のグループに先を越された。彼らはDesulfovibrio gigasという別種の硫酸還元菌の水溶性[NiFe]ヒドロゲナーゼの結晶構造を2.85Å分解能で発表した[2]。当初のレポートでは活性中心の細かい構造について誤りやあいまいな点が多かったが、1996年に、活性部位はNi-Fe金属中心であり、そのFe原子には4個の非タンパク質配位子が配位していることを報告した[3]。またオランダ・アムステルダム大学の分光学のグループが同位体標識したChromatium vinosumの[NiFe]ヒドロゲナーゼの赤外吸収スペクトルの結果から非タンパク質配位子のうちの3本はCN 2本とCO 1本であることを示した[4]。
1997年、我々は硫酸還元菌Desulfovibrio vulgaris Miyazaki F株の膜結合性[NiFe]ヒドロゲナーゼの1.8Å分解能におけるX線結晶構造解析に独立に成功した(R-因子=22.9%)[5]。活性部位のNiとFe原子は両方ともそれらの金属の異常分散効果から完全に同定できた[5]。また活性中心の近くに新たにMg原子の存在を見出した。D. gigasと同様に活性部位のNi原子には4つのシステイン残基のS原子が配位し、それらのうちの2つはFe原子にも配位してブリッジを形成していた。Fe原子には4つの非タンパク質由来の配位子が結合していた。Fe原子に配位している非タンパク質由来の4つの配位子のうち3本は電子密度の大きさと構造パラメータ(温度因子、結合距離、結合角)および精密な熱脱着マススペクトルおよび赤外吸収スペクトルの結果から2原子分子であり、SO,CN,CO分子と同定した[5]。一方、残りのひとつの配位子はNiとFeの間をブリッジしており、これは単独のS原子(あるいはSH)であると同定した[5]。つまり、NiとFeには都合3つのブリッジS配位子(システイン残基の側鎖のS原子2つと単独のS原子ひとつ)が存在していた。配位子をまとめると、(SO、CO、CN、SまたはSH)となり、すでに報告されている(CO、CN、CN、OまたはOH)[3,4]とは異なるものであった(図1)。このような特異な配位子構造を示す金属活性中心を持つ生体酵素はもちろんこれまでに見つかっていなかった。
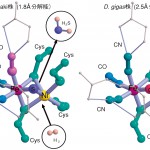
図1 2種類の[NiFe]ヒドロゲナーゼのNi-Fe活性中心の配位子構造比較
左:Desulfovibrio vulgaris Miyazaki Fの(SO,CO,CN,S)配位子[5,7] Ni原子に水素分子(円内)が結合して反応が進むと単原子ブリッジ配位子が硫化水素(円内)として遊離することを仮説として提案[6]
右:Desulfovibrio gigas の(CO, CN, CN, O)配位子[2,3]
3.ブリッジS(SH)配位子の証明
3-1.水素還元による硫化水素の遊離
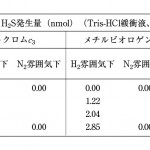
上記の非タンパク質配位子のうち、第3のブリッジ配位子がS(SH)なのか、あるいはO(OH)なのかについては、以下に述べるように最近明らかにすることができた。Ni-Fe活性中心のブリッジS配位子は、その構造の対称性の低さから立体構造的に不安定な要素を持つと考えられる。そこで、分子が水素還元されるとこのブリッジ配位子は活性部位から遊離するという仮説を立てた。つまり、図1左下の円内に示すように、基質である水素はNiの空位の第6配位子部位に結合する。その結果、第3のブリッジ配位子が最も大きな影響を受けてこの金属錯体中心からはずれて飛び出すという仮説である。Niの他のシステイン・S配位子は、たとえ還元によりその配位結合が乱されても、ペプチド主鎖に支えられたアミノ酸配位子なのでこの活性中心に留まるであろう。もし、この第3のブリッジ配位子が酸素(O)ならば、水素還元の結果、活性中心から遊離しても溶媒の中での特定はできない。しかし、これがイオウ(S)ならば、硫化水素(H2S)として検出することが可能であろう(図1左上の円内)。立体構造から立てたこの仮説を証明するため、ある実験を計画した。密閉した反応バイアルに電子伝達体を加えた緩衝溶液を入れ、水素で充分に飽和させた。そのバイアルに精製ヒドロゲナーゼを嫌気的に加え、37℃で20分間反応させた。その結果、表2に示すように気相中に硫化水素が発生することを確認した。発生する硫化水素の量は加えたヒドロゲナーゼのモル数に比例して増加したこと、N2で飽和しても全く硫化水素は検出されないこと、電子伝達体を入れなければ硫化水素の発生量が極めて低いことなどから硫化水素はヒドロゲナーゼが水素還元されることによって初めて遊離されるものであることが結論できた[6]。ヒドロゲナーゼが水素還元により、硫化水素を発生するという事実は数十年におよぶヒドロゲナーゼの生化学的研究において初めて明らかにされた性質である。これは、単に活性中心の配位子の種類を想定するだけでなく、この酵素と環境中のイオウ(あるいは硫化物)の代謝サイクルとの関係を思わせる興味ある結果であった。
表2 水素還元によりヒドロゲナーゼ溶液から発生した硫化水素の量
3-2.硫化水素はどこから?
水素還元されたヒドロゲナーゼが放出した硫化水素は、どのように、そして分子内のどこで合成されたものなのか?酵素がもともと分子内のどこかに硫化水素を持っていなかったとは断言できない。酸化型ヒドロゲナーゼの立体構造中には多くの水分子を同定した[5]。精密化された温度因子からそれらのいくつかが硫化水素分子であるとは特定できなかった。もし、その中のひとつが硫化水素であったとしても、それが水素還元された時だけに遊離してくるとは考えにくい。これらのことから、この硫化水素は酸化型ではなんらかの形で酵素分子内に固定されているイオウ源から化学反応の結果合成されたと考えた。もちろんその第一の候補は上の仮説に基づくNi-Fe活性中心の第3のブリッジS配位子である。その他の有力な候補は、電子伝達サブユニットが保持している3個の鉄−イオウのクラスターのイオウ(計12個)である。この鉄−イオウのクラスターがつぶれてイオウが硫化水素として放出されてしまったなら酵素分子はもはや元の活性分子には戻れないし、電子伝達が阻害されて反応がストップしてしまう。しかし、これまでの経験から酵素が水素還元されると、30〜40%の分子が変性してしまうことが気にかかっていた。硫化水素のルーツは水素還元型ヒドロゲナーゼ結晶構造解析を行い、酸化型との差異を見出すのが最も説得力のある証明手段と思い、それを手がけた。
3-3.水素還元型ヒドロゲナーゼの高分解能X線回折実験
水素還元型結晶の調製は「結晶化してから水素還元」の方法を採用した。結晶還元の器具は北海道大学(現・大阪大学タンパク質研究所)の中川敦史氏の設計したキセノン封入用のキャピラリーマウントを改良して水素ガス導入用のものを試作した。結晶化母液には還元のための電子伝達体として1mMのメチルビオロゲンを最初から加えた。沈殿剤としては2-メチル-2,4-ペンタンジオール(通称MPD)を用いた。還元型の回折実験では、結晶は外気に触れさせることはできないのでキャピラリーに封管したままで回折実験をしなくてはならない。この45%のMPDはキャピラリーに封管したまま結晶にダメージを与えずに凍結させるのに非常に効果があることも後から分かった。上の条件で結晶化した酸化型ヒドロゲナーゼは、嫌気的(N2)条件下でキャピラリー内に詰め、N2を約3気圧の水素で置換することにより室温で直ちに還元することができた。
水素還元型ヒドロゲナーゼ結晶のX線回折データの収集は、SPring-8放射光施設のビームラインBL41XUで行った。測定の約30分前に水素還元した結晶を100KのN2気流中で凍結し、回折実験を行った。X線損傷が見込まれたので、全てのアッテネータを挿入し、コリメーターは0.1mmのものを用いた。回折実験の条件と強度データの統計値は表3上段に示す。得られたデータは1.4Åという予想外の高分解能データであり、しかもR-mergeも4.8%という良い値であった。水分子を除いた酸化型の結晶構造から計算した位相を使い、2Fo−Fcの電子密度図を計算したところ、予想通り活性中心の第3のブリッジ配位子の電子密度ピークが消失していた。従って、この配位子だけを除いた分子構造をもとに構造精密化を進めた結果、表3の下段のような精度で収束した。1.4Å分解能における還元型ヒドロゲナーゼの結晶構造は、R-因子=21.8%まで精密化された。
表3 水素還元型ヒドロゲナーゼのX線強度データと精密化された構造の統計値

3-4.還元型と酸化型のヒドロゲナーゼの構造比較
還元型と酸化型のヒドロゲナーゼの構造を最小二乗法で重ね合わせた時のRMS距離は、主鎖原子、側鎖原子および全原子でそれぞれ0.24Å、0.73Å、0.29Å、であった[7]。Ni-Fe、Fe4S4(活性中心から近位)、Fe3S4、Fe4S4(活性中心から遠位)、Mgの5つの金属中心の構造も大きな変化はなかった。特に、硫化水素のイオウ源となりうる鉄−イオウのクラスターのイオウ原子はしっかりとした電子密度を示し、それらの温度因子も特に異常なく精密化された。従って、還元型と酸化型のヒドロゲナーゼの構造の違いは、Ni-Feの活性中心のFeとNiをブリッジする第3の単原子配位子の「有無」だけであった(図2後述)。
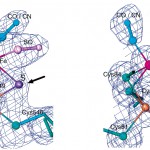
図2 D. vulgaris Miyazaki Fの酸化型(左)[5]および還元型(右)[7]ヒドロゲナーゼ結晶のNi-Fe活性中心の電子密度を分子モデルを重ね合わせて比較。水素還元により酸化型(左)で見られた単原子ブリッジ配位子の電子密度が還元型から消失した(矢印で示す)。
4.Ni-Fe活性中心の配位子構造とその反応機構の解明
酸化型と還元型ヒドロゲナーゼの活性中心の電子密度図を分子構造モデルと共に比較して図2に示す。酸化型の電子密度ではっきりと判別できるFeとNi原子をブリッジする第3の単原子配位子の電子密度(図2左)が、還元型(図2右)では完全に消えていた。前述の、水素還元したヒドロゲナーゼが硫化水素を放出したという実験事実[6]と合わせて、もともとFeとNi原子をブリッジする第3のブリッジ配位子は酸素(O)ではなく、私たちが、酸化型の立体構造[5]で示唆したようにイオウ(S)であったことが証明できた。本研究の結果、この酵素の触媒機構には2つの反応サイクルの存在が予想できる。ひとつは、Sブリッジ配位子を活性中心から取り除く活性化サイクルで、もうひとつはそれに続く触媒サイクルである[7]。Sブリッジ配位子が消失して、一旦分子が活性化されると、周りに水素があるかぎり、触媒サイクルが回るのであろう。すると、水素が無くなるとまた分子は不活性化された状態に戻るのだろうか?もしそうであるならブリッジS配位子は活性中心を他の配位子から守るためにあるのであろうか?また、実際水素の吸着場所、そしてその後の反応箇所はFeなのかそれともNiなのか?など多くの疑問点が新たに浮かび上がってくる。還元型結晶の1.4Å分解能の構造では、アミノ酸残基の水素分子の位置を思わせる電子密度が見えている。更に分解能が上げられれば、活性中心での水素の電子密度を「見る」ことも可能であろう。とりあえず水素の結合位置は基質との競争阻害剤である一酸化炭素(一酸化炭素は少なくとも1本は酵素の活性を保つのに必要であるにもかかわらず、外部から加えられると阻害剤になる)との複合体のX線結晶構造解析で決定づけようと狙っている。これらの多くの疑問は、いろんなアイデアをうまく使ってひとつひとつX線構造化学的研究で解明していけると信じている。
本研究は、静岡大学の八木達彦、姫路工業大学の安岡則武、京都大学の三木邦夫および緒方英明と著者らのグループによる共同研究の成果である。本研究の一部は文部省科学研究費・特定領域研究(生体金属分子科学)および日本原子力研究所(黎明研究)の助成を受けて行われた。
参考文献
[1]Higuchi,Y.et al. : J.Biol Chem.262,2823-2825(1987)
[2]Volbeda,A.et al. : Nature,373,580-587(1995)
[3]Volbeda,A.et al. : J.Am.Che.Soc.118,12989-12996(1996)
[4]Happe,R.P.et al. : Nature,385,126(1997)
[5]Higuchi,Y.et al. : Structure,5,1671-1680(1997)
[6]Higuchi,Y.et al. : Biochem Biophys.Res.Commun.,255,(1999)295-299.
[7]Higuchi,Y.et al. : Structure,7,549-556(1999)

樋口 芳樹 HIGUCHI Yoshiki
京都大学大学院 理学研究科
〒606-8502 京都市左京区北白川追分町
TEL:075-753-4030
FAX:075-753-4032
e-mail:higuchi@kuchem.kyoto-u.ac.jp
略歴:昭和59年大阪大学大学院理学研究科博士後期課程修了(理学博士)。姫路工業大学理学部を経て、平成7年10月より、京都大学大学院理学研究科助教授。








