Volume 28, No.3 Pages 251 - 258
1. 最近の研究から/FROM LATEST RESEARCH
長期利用課題報告
イオンポンプの結晶構造解析
Crystal Structure Analysis of Ion Pumps
東京大学 定量生命科学研究所 Institute for Quantitative Biosciences, The University of Tokyo
- Abstract
- 一連の長期利用課題は「イオンポンプ蛋白質(P型ATPase)の作動機構を原子構造に基づいて完全に理解すること」を目標とし、すべての可能な中間体の構造決定を進めている。その反応サイクルではATPによるポンプ蛋白質の自己燐酸化が起こるが、その構造変化は大規模且つ複雑すぎて因果関係は良く分からなかった。そこで最重要の中間体(ポンプ蛋白質+ATP+Ca2+の三者複合体)に到達する複数の経路を追及することでその解明を目指した。本課題ではCa2+非存在下(E2)でATPを結合した状態(E2·ATP)のCa2+ポンプの結晶構造解析を行い、「何故ATPによる燐酸化のためにはCa2+の結合が必須なのか」「何故E2状態では無機燐酸による燐酸化が可能であるのに、Ca2+結合状態では不可能なのか」という根本的問題にアプローチした。
1. はじめに
2020A期からBL41XUにおいて、長期利用課題「イオンポンプの結晶構造解析」を研究室のメンバー(金井隆太助教、椛島佳樹助教)とともに遂行した。この長期利用課題は「イオンポンプ蛋白質によるイオン能動輸送機構の原子構造に基づく理解」の完成を目指すものであり、具体的には(ⅰ)25年以上にわたって追求してきた筋小胞体Ca2+ポンプ(Ca2+-ATPase、sarco(endo)plasmic reticulum calcium ATPase(SERCA))(ATPaseはATP加水分解酵素)の反応サイクル中間体の結晶構造解析、(ⅱ)医学的生物学的にはより重要とも言えるナトリウムポンプ(Na+,K+-ATPase、NKA)の複数の状態の結晶解析、(iii)「結晶中の脂質二重膜を可視化」し膜蛋白質が働く「場」である脂質二重膜とポンプ蛋白質との相互作用を解明すること、の3テーマから成る。
究極の目標は「蛋白質がどうしてそういう構造でなければならないのか」を理解することである。そのために、可能なすべての中間体の構造決定を目指している。SERCAに関しては、既に10個の中間体の構造を発表したが、本長期利用課題により6つ(図1)、NKAに関しても4つの中間体の結晶構造を新たに決定できた。これまでは、一つだけ(図1では一番外側)の反応経路に沿った中間体の構造決定に集中してきたが、異なった経路の中間体構造に踏み込むことで、予想外に大きな構造情報が得られることが分かった。
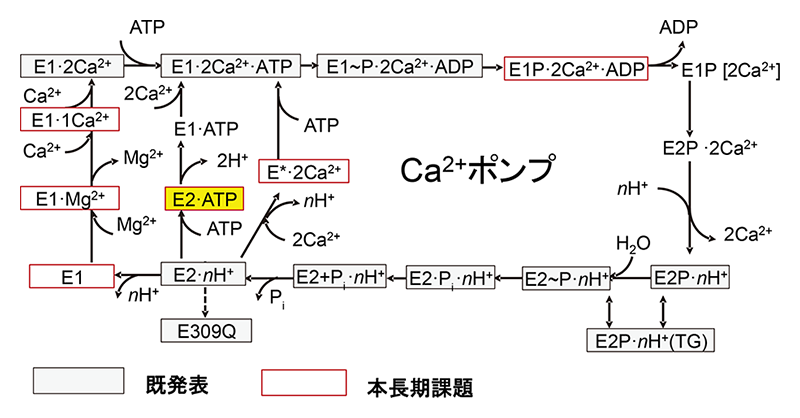
図1 Ca2+ポンプの反応ダイアグラム。□で囲った中間体の原子構造は決定済み。E1/E2:はCa2+に対し高親和性/低親和性を意味し、Pは燐酸化を、Piは無機燐酸を示す。
例えば、Ca2+を結合したSERCAのATPによる燐酸化に際しては一度に多くの構造変化が起こるために[1][1] Toyoshima C and Mizutani T: Nature 430 (2004) 529-535.、何が原因で何が結果なのかよく分からなかったが、Ca2+非結合時のATP結合状態(E2·ATP)の構造決定により、ATPの結合だけでどこまでの構造変化が起こるかが明らかになった[2][2] Kabashima Y, Ogawa H, Nakajima R and Toyoshima C: Proc Natl Acad Sci USA 117 (2020) 18448-18458.。また、NKAの作動原理はSERCAと同じだろうから、一方だけの構造決定で十分と考えていたが、対応する状態の構造が両者で明らかになるにつれ、作動原理は確かに同じだが、その実装(例えば、Aドメインは何度傾斜するのかとか)は大きく違っていることが分かってきた[3, 4][3] Kanai R, Cornelius F, Vilsen B and Toyoshima C: FEBS Lett. 596 (2022) 2513-2524.
[4] Kanai R, Vilsen B, Cornelius F and Toyoshima C: closes the cytoplasmic gate. FEBS Lett. (2023) In Press.。その実装の違いは、運搬するイオンの違いや要求される性能(回転速度とか)によるもののはずで、対応する構造の比較によって得られる知見は予想を遥かに超える本質的なものであった。本稿では既にPNAS誌に発表したSERCAのE2·ATP構造[2][2] Kabashima Y, Ogawa H, Nakajima R and Toyoshima C: Proc Natl Acad Sci USA 117 (2020) 18448-18458.に関してやや詳しく述べる。
2. Ca2+ポンプの反応サイクルとイオン輸送
筋小胞体Ca2+ポンプは約1,000個のアミノ酸残基よりなる膜内在型膜蛋白質である。速筋のSERCA1a、心筋のSERCA2a、ともに10本の膜貫通ヘリックス(M1-M10)と3つの明瞭に分離した細胞質ドメイン(Actuator, Nucleotide binding, Phosphorylation)から成る(図2)。Ca2+ポンプは濃度勾配に逆らってイオンを運搬するのでエネルギーを必要とし、ATPの加水分解を行うが、反応のメカニズムはミオシンを含む他のATPaseとは大きく違う。Ca2+ポンプの場合、Nドメインにアデニン環で結合したATPのγ燐酸は、まず、PドメインにあるAsp残基に転移されるが、ここでは水分子の直接的関与はない。標準状態では、カルボキシル基の燐酸化はエネルギー的には不利な(4.4 kcal/mol uphill)反応であり、逆反応によるADPからATPの合成は容易に起こる。すなわち、エネルギー的に高い(E1P)状態を作って、反応サイクル後半のエネルギーを消費する過程を可能にしている(そのため、E1P状態をADP感受性燐酸化状態とも言う)。Ca2+ポンプが属するP型ATPase独特のものである。但し、Aspの燐酸化自体はバクテリアの二成分制御蛋白質にも見られ、比較的一般的なものである。燐酸化AspはCa2+を小胞体内腔に放出後(E2P)加水分解され無機燐酸が放出される(図1)。
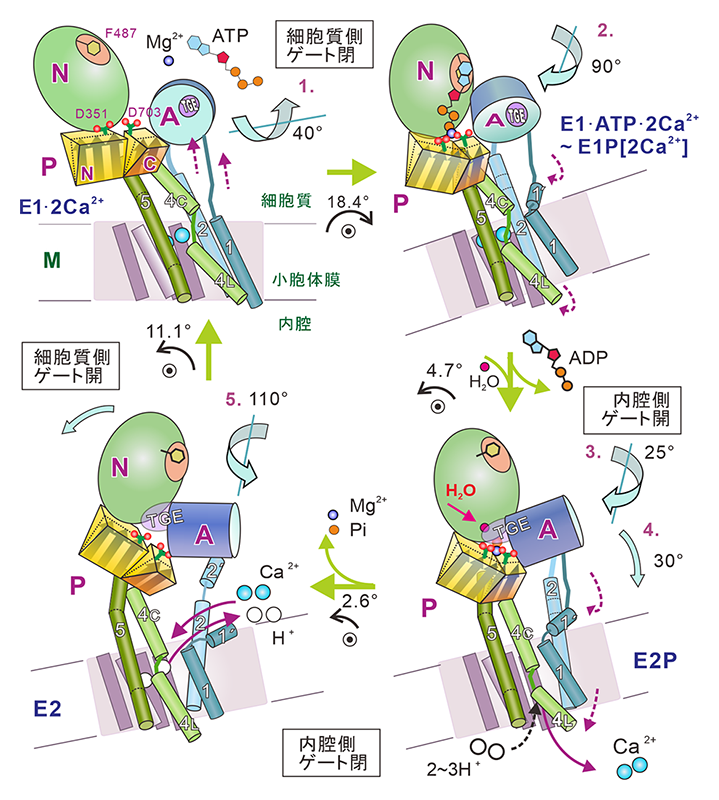
図2 Ca2+輸送サイクルの模式図。4つの状態で10本ある膜貫通ヘリックス(M1-M10)と3つの細胞質ドメインの大規模な再配置が起こる(図は構造変化の小さいM7-M10で揃えてある)。2個のCa2+を内腔側に放出するところ(ステップ2)では、Aドメインが90°回転し、その回転をM4の下向き運動に変換してCa2+を押し出す。反応過程でポンプ蛋白質全体が脂質二重膜に対して傾きを変える(rocking運動)[5][5] Norimatsu Y, Hasegawa K, Shimizu N and Toyoshima C: Nature 545 (2017) 193-198.。◉の上の数字はその角度。
2個のCa2+結合サイトはCa2+に対し高親和性で細胞質側に開くE1と低親和性で内腔側に開くE2状態を行き来する。濃度勾配に打ち勝つ基本戦略は、膜の両側(細胞質側と内腔側)にゲートを持ち、同時には開かないことである。E1状態で2個のCa2+が結合すると「燐酸転移を可能にせよ」という信号が発生する。この状態では、イオン通路は一応閉じているがゲートに鍵は掛かっていない。ATPが結合し、細胞質頭部が閉じることで鍵が掛かった状態が生じ(E1·ATP·2Ca2+;図2)、γ燐酸がAsp残基に転移することで安定化される。こうして、Ca2+は膜内に隔離される(E1P[2Ca2+];ここでPは燐酸化を、[ ]は隔離された(occluded)状態を示す)。
燐酸転移のためには、NドメインはPドメインに接近する必要があり大きく傾く。その結果、Aドメインとも接触する。E1·2Ca2+状態で開いていた細胞質頭部は閉じ、Aドメインは膜面に対し~40°傾く。AドメインにはM1-M3ヘリックスが直接的に連結しているが、Aドメインの端に接続されたM2ヘリックスは30°の傾斜の結果、αヘリックス1巻分細胞質側に持ちあがり、M1ヘリックスは実に2巻分持ちあがる(図2のステップ1)。M1-M2ヘリックスから成るV字型の狭い部分が持ち上がってイオン通路の出入り口を塞ぐとともに、Ca2+に配位するグルタミン酸残基の側鎖を動けなくする。つまり、M1ヘリックスという丸太棒でイオン通路の出入り口を塞いで鍵を掛けてしまうのである[1][1] Toyoshima C and Mizutani T: Nature 430 (2004) 529-535.。
ATPの結合によってPドメインにも大きな構造変化が生じる。PドメインはN末側(PN)、C末側(PC)二つの領域から成り、中央には7ストランドの並行βシートが走っている。それを挟むαヘリックスがあり、Rossmann foldと呼ばれる構造を採る(図3b)。
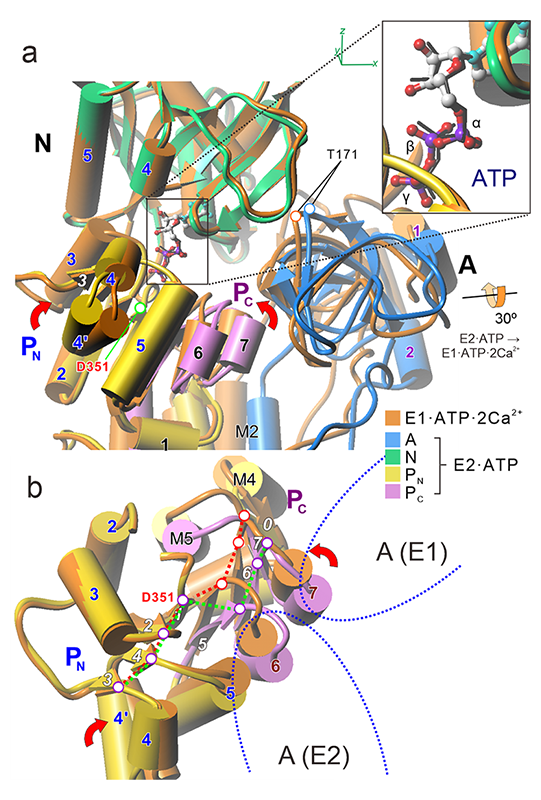
図3 Ca2+ポンプのE2·ATP状態とE1·ATP·2Ca2+状態の結晶構造の重ね合わせ。Nドメインが最もよく一致するように重ね合わせた。a膜に平行に見た細胞質頭部。結合したATPの構造は二つの結晶構造でほぼ完全に一致し、三燐酸部分は伸びている(挿入部)。b膜に垂直に見たPドメイン。A(E1)、A(E2)はE1状態、E2状態ににおけるAドメインの位置(青点線)を示す。ATPによる自己燐酸化に際し、Pドメインを形成するPN、PCは燐酸化Asp(D351)に接近するように折れ曲がり、中央のβシートの段差は解消する(赤点線)。
非燐酸化状態ではPN、PCはまっすぐだが(図3a;αヘリックス同士はほぼ平行)、βシートには1番目(Pβ1)と隣接するβストランド(Pβ5)の間で段差がある(図3b、4)。燐酸化時にはβシートを構成する7つのβストランドは整列し、PN PCはともに燐酸化残基Asp351(図3のD351)に接近するようにPドメインは折れ曲がる(図3a矢印)。
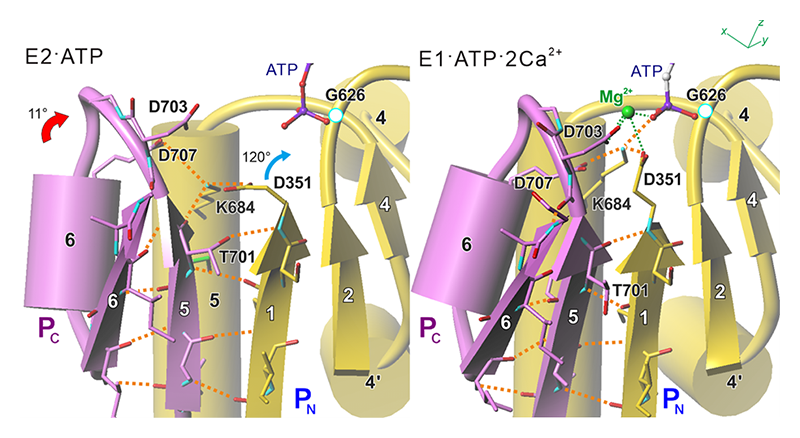
図4 Pドメインの燐酸化部位周辺で燐酸化時に生じる構造変化。中央のβシートにほぼ垂直に、図3bの左上から見たもの。ATPによる自己燐酸化に際し、PN、PCは燐酸化Asp(D351)に接近するように折れ曲がり、中央のβシートのβ1-β5間の段差は解消する。D351の側鎖は横を向いた状態からγ燐酸の方を向く状態に変わるが、それは段差の解消とリンクしていること、Mg2+が来ない限り、三つのAsp残基+ATPのγ燐酸による負電荷の集中による静電的反発によりPN、PC間は閉じられないことに注意。オレンジ色の破線は水素結合を、赤矢印は燐酸化に伴うPCの運動を示す。
Ca2+ポンプでもNKAでも、ATPによる燐酸化だけではなく、正方向にイオンを運搬した後のE2状態から、逆反応によって無機燐酸による燐酸化が可能である(図1)。得られた燐酸化状態はE2Pと呼ばれるが、Pドメイン自体の構造はE1·ATP·2Ca2+、或いはE1~P·ADP·2Ca2+状態と同一である。つまり、Pドメインの構造は燐酸化状態の折れ曲がった構造(中央βシートは整列)と非燐酸化状態の真っ直ぐな構造(βシートは段差あり)の2つのみであり、中間的な構造はこれまで見つかっていない。
このように、E1·2Ca2+→E1·ATP·2Ca2+では非常に大きな構造変化が起こる[1][1] Toyoshima C and Mizutani T: Nature 430 (2004) 529-535.。構造変化自体の記述は2004年の段階で既にできていたが、構造変化が複雑すぎて、どれが原因でどれが結果なのか、良く分からないまま時間が経過した。特に重要な問題は、「何故ATPによる燐酸化には2個のCa2+の結合が必須であり、E2では起こらないのか」或いは「何故無機燐酸による燐酸化はE2では起こるがE1では起こらないのか」である。このような本質的問いに答えるためには、先ず、ATP単独でどこまでの構造変化を起こせるかを知ることが重要である。Ca2+ポンプはCa2+非存在下でもATPに対し高い親和性(µM)を持つので、生理的条件下では、Ca2+放出後の状態はATPを結合したE2·ATP(或いは既にプロトンを放出したE1·ATP)状態にいる分子がほとんどと考えられる。この状態の構造を決定したいのである。
強力阻害剤thapsigargin(TG)でE2状態に固定したCa2+ポンプにATPを結合させたE2(TG)·ATPの結晶構造は2011年に得た[6][6] Toyoshima C, Yonekura SI, Tsueda J and Iwasawa S: Proc Natl Acad Sci USA 108 (2011) 1833-1838.。ATPによる燐酸化が起きない理由としては「ATPγ燐酸は燐酸化部位に正しく配達されない」か「Pドメインの折れ曲がりが起きない何らかの理由がある」が考えられる。E2(TG)·ATPではATPのγ燐酸は燐酸化Asp残基から大きく離れており、「ATPの配達はE2(TG)状態では正しく起こらない」。これは、E1·ATP·2Ca2+とE2のどちらの状態でも細胞質側頭部は閉じているが、3つのドメインの位置関係は大きく異なることに対応している(図2)。E1でのAドメインは、膜に垂直な軸の周りにE2位置から~110°回転している(図3b)。Pドメインは楔形をしており(図5右下、水色三角)、場所によって厚さが違う。AドメインはNとPの間に挟まる形になるが、E2ではPドメインの厚いところに位置し、且つ深くNP間に挿入される。従って、NドメインはPドメインに対し遠い位置に固定され、ATPの位置も燐酸化部位から遠くなる。
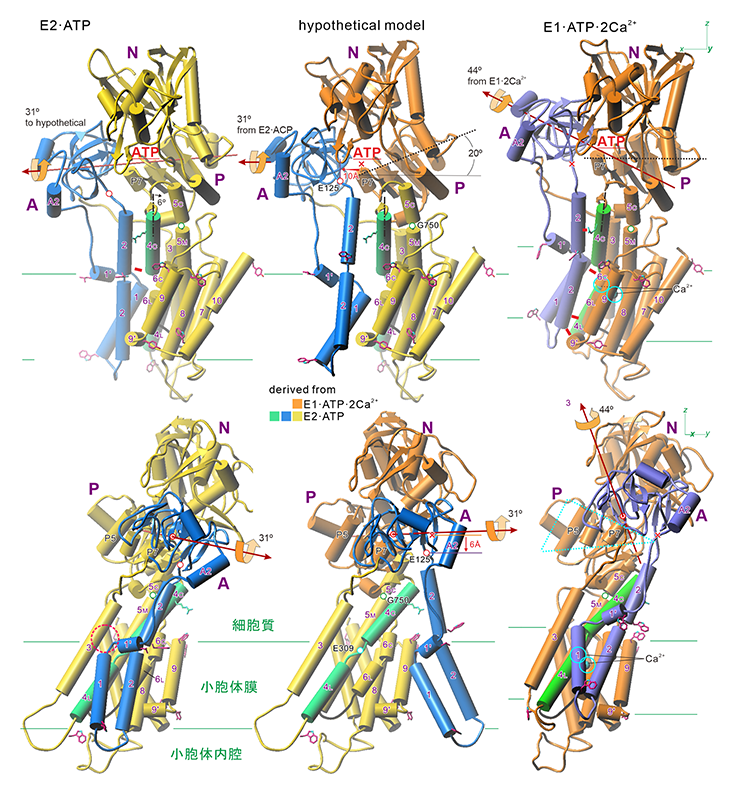
図5 Ca2+非存在下でATPを結合したE2·ATP状態で燐酸化が起こったときに形成されるであろう(仮想的)構造のモデル(中央)[2][2] Kabashima Y, Ogawa H, Nakajima R and Toyoshima C: Proc Natl Acad Sci USA 117 (2020) 18448-18458.。その左(E2·ATP[2][2] Kabashima Y, Ogawa H, Nakajima R and Toyoshima C: Proc Natl Acad Sci USA 117 (2020) 18448-18458.)と右(E1·ATP·2Ca2+ [1][1] Toyoshima C and Mizutani T: Nature 430 (2004) 529-535.)は結晶構造。E1·ATP·2Ca2+における水色の円は結合したCa2+を示す。E309はCa2+結合のゲートとなり、E125はAドメインとM2の接手、G750はM5CとM5Mを繋ぐヒンジとなる残基。赤色の長い矢印はAドメインの膜面にほぼ平行な軸の周りの回転の軸。二重の円盤はその支点の位置(P7ヘリックス上)を示す。赤の短い棒は水素結合を示す。左下の破線赤丸は細胞質側イオン通路の出入口を、右下の水色三角はPドメインの概形を示す。3つの構造はM7-M10ヘリックスが同じ位置に来るように表示しているが、状態によって膜面の位置(緑色の水平線で示す)は異なり、E1·ATP·2Ca2+では細胞質側に持ち上がったM1/M2ヘリックスが膜外に飛び出さないように、膜表面にあるTrpやTyr残基(赤い棒で表示)が「浮き」の役割をするため、分子全体の傾きが変わる(rocking運動)[5][5] Norimatsu Y, Hasegawa K, Shimizu N and Toyoshima C: Nature 545 (2017) 193-198.。
E2(TG)に対してはATPの結合がそのようなドメイン配置を変えることはなかった。しかし、それは強力阻害剤TGでE2状態を安定化したためかもしれないのである。実際、E2状態が優勢であるpH 7以下でATPを予め加えておくと、Ca2+の結合は加速される。このことは、ATP結合によって細胞質側頭部が(少なくともある時間)開くためと考えられ、E2(TG)·ATP状態の結晶構造とは相容れない。NKAの場合ATPの効果はもっと明瞭である。E2·2K+状態は非常に安定であるが、ATPの結合はK+の放出を5,000倍加速する。実際、我々はクライオ電顕を用い、NKAのE2·2K+状態へのATP結合は静電的反発によって細胞質頭部を開くことを証明した[3][3] Kanai R, Cornelius F, Vilsen B and Toyoshima C: FEBS Lett. 596 (2022) 2513-2524.。
3. E2·ATP状態の結晶構造
つまり、阻害剤なし且つCa2+なし、pHは7付近という条件でのATP結合構造が必要なのであり、その取得を目指した。結晶化は非常に困難であり、これまで用いてきたウサギ速筋由来のCa2+ポンプ(SERCA1a)では成功せず、高等動物細胞で発現させたヒト心筋Ca2+ポンプSERCA2aを用いる必要があった。また、燐脂質存在下の結晶化であるにも拘らず界面活性剤の選択は重要であり、通常のC12E8に加え、これまで使ったことのないC13E8との混合物を用いる必要があった。BL41XUでデータ収集を行い、2.6 Å分解能で原子モデルを精密化した[2][2] Kabashima Y, Ogawa H, Nakajima R and Toyoshima C: Proc Natl Acad Sci USA 117 (2020) 18448-18458.。
得られた構造は幾つもの点で驚くべきものであった。第一に、細胞質側頭部はほぼ開いていて、AドメインはE2位置から110°回転した(図2のステップ5)E1位置にあり、Pドメイン上のソケットに正しくはまり込んでいた。Aドメイン-Nドメイン間の接触は一か所でのみ起こっている(図3aのT171周辺)。その結果、E1P→E2Pで生じる90°の回転(図2のステップ2)の軸受け部分が不完全ながら形成されており、接触部位の位置も正しい(「E1·ATP·2Ca2+と同じ」という意味で「正しい」ということにする)。E2·ATPでは、E1·2Ca2+→E1·ATP·2Ca2+で生じるAドメインの40°の傾斜(図2のステップ1)が実現されていないためにA-N間接触は不完全になっている。E2状態では7つの水素結合によって安定化されていたが、E2·ATPではThr171を含む一か所しかない。
ATPによる燐酸化が起こるためには、3つある細胞質ドメイン(A, N, P)が正しく配置する必要があるから、ドメイン間接触面が正しくなければE2状態でATPによる燐酸化が起こらないことは簡単に説明できる。しかし、得られた構造ではATPはNドメインとPドメインを正しく架橋し(図3a)、ATPγ燐酸は燐酸化部位に正しく配置されていた(図4)。また、AドメインはE2位置からほぼ90°膜に対し垂直な軸の周りに回転し、E1·2Ca2+状態で期待されるE1位置(図3)にあること、NドメインはPドメインに対しては、E1·ATP·2Ca2+状態と完全に一致する位置まで傾斜しており、A/N interfaceもほぼ正しいことが分かった。
つまり、E2状態では閉じていた細胞質側頭部はATPの結合によって一旦開き、その結果、E2状態では大きくM1の方に湾曲していたM5ヘリックスはかなり真っ直ぐになる(「完全に」ではない点が肝心である)(図5)。M5ヘリックスはPドメインに組み込まれているから、M5ヘリックスが真っ直ぐになると、Pドメイン、従ってNドメインはAドメインから離れる方向に動く。その結果、AドメインはM5ヘリックスが真っ直ぐな(に近い)場合に安定なE1位置に移動したと考えられる。この位置では、AドメインはPドメインと正しく接触している(傾斜のための支点はE1·ATPと共通)が、Pドメインが傾いている結果、Aドメインは膜に対し非常に近い位置にあり、また、PドメインのAドメインとの接点はPドメインの端にあるから、AドメインはSERCA本体から殆ど離脱しているように見える。
このように、E2·ATP状態のSERCAの構造は一見したところE1·Mg2+状態[7][7] Toyoshima C, Iwasawa S, Ogawa H, Hirata A, Tsueda J and Inesi G: Nature 495 (2013) 260-264.とよく似ていた。実際、結晶化におけるpHは7.2であり、通常ではE1状態にあると期待される。しかし、膜貫通部位を見ると、Ca2+結合残基の配置は側鎖の向きまでE2(TG)結晶構造と同一であり、明らかにE2であった。このことは、閉じた細胞質頭部はE2(TG)の目立つ特徴であるが、E2状態(膜内イオン結合部位にプロトンを結合し、Ca2+に対し低親和性状態というのが定義)に必須ではないことを示している。これは、前の長期利用課題で明らかにしたことでもあった[8][8] Tsunekawa N, Ogawa H, Tsueda J, Akiba T and Toyoshima C: Proc Natl Acad Sci USA 115 (2018) 12722-12727.。
4. 燐酸化に伴うPドメインの構造変化とその役割
一方でE2·ATP状態ではPドメインの折れ曲がりは起こっておらず、中央のβシートもE1·ATP·2Ca2+状態とは違い、段差を残したままであった(図3b、4)。PドメインはN末側(PN)、C末側(PC)二つに明瞭に分離しており、非燐酸化時には、Pドメインを縦断する中央のβシートも1番目と5番目のβストランドの間で段差がある。燐酸化時にはβシートを構成する7つのβストランドは整列し(図3b)、PN PCともに燐酸化残基Asp351に接近するように折れ曲がる(図2、3a)。
E2·ATP状態でATPは燐酸化部位に正しく配達されていると書いた。確かに、ATPの3つの燐酸基はE1·ATP·2Ca2+状態と同様伸展しており(図3a挿入図)、Mg2+を取り囲むような立体配座にはなっていない。すなわち、γ燐酸はPドメインにある保存された625TGDモチーフ中のGlyのアミド基と水素結合を作っているが、肝心の燐酸化残基Asp351のカルボキシル基とは遠い。それは、これもP型ATPaseに絶対的に保存されているLys684によってAsp351の側鎖の向きが制御されており、非燐酸化状態、すなわちPドメインが折れ曲がっていないときにはγ燐酸の方ではなく、それと120°違う方向を向いているからである(図4)。このLys684はPN側にあるが、PC側にあるAsp707(これも保存されている)と塩橋を作っている。Pドメインの折れ曲がりは、Mg2+がγ燐酸からAsp351への燐酸転移を触媒できるようにAsp703を正しい位置に持ってくるだけではなく、Asp707がLys684を介してAsp351側鎖の配向を変えてカルボキシル基がγ燐酸の方を向くように、つまりは燐酸転移を可能にする働きを持っている。要するに、ATPからの燐酸転移はMg2+が正しく配位しない限り起きないよう、二重に保護されているわけだ。
非燐酸化状態(折れ曲がりの無い状態)でヘリックス同士(この場合はP5とP6)は側鎖で噛み合っているわけだから、その噛み合いをはずす、βシートに垂直な方向(「横方向」)の運動がない限り、Pドメインの折れ曲がりは起こり得ないはずである(図3)。さらに、Mg2+が来ない限り、Asp703とAsp351のカルボキシル基、γ燐酸、この三者間の静電的反発は大きすぎて接近できないであろう。その横方向の運動の実体が、中央βシートの整列であり、それはβシートの水素結合ネットワークに参加するのが5番目のβストランドのC末端(図4では上端)にあるThr701の主鎖カルボニル基なのか側鎖の水酸基なのかで制御されている(図4)。興味深いことに、このThrはNKAでは保存されているが、燐脂質のflippaseなど細胞質側gatingを必要としない他のP型ATPaseでは保存されていない。その場合、折れ曲がった状態が標準であり、直ちに燐酸化が起こる。
ここまではまあ理解できた。一方、Mg2+が結合しさえすれば、Pドメインの折れ曲がり(すなわち燐酸化)はCa2+結合によらず熱運動だけで起こりそうである。実際、無機燐酸による燐酸化はCa2+を必要としない。では「何故、ATPによる燐酸化のためには、2個のCa2+の結合が必須」なのか。
5. E2·ATPでAドメインがE1位置にあることの意味
この問題を考えるために、E2·ATP状態の構造から出発して燐酸化が起こった状態(Pドメインは折れ曲がり、Aドメインはそれによって膜面に対し31°傾斜し、M1/M2はAドメインとともに剛体として移動する)の仮想的構造を構築した(図5中央)。膜面に対するAドメイン、Pドメインの傾斜角はE1·ATP·2Ca2+状態とは大きく異なっており、M2, M4ヘリックスは膜面に対して低い位置に固定されたままであった。この状態では、M1/M2ヘリックスはCa2+ポンプ本体からほぼ完全に離れている。それに対し、E1·ATP·2Ca2+状態では、M1/M2ヘリックスはE1·2Ca2+状態よりもさらに密に本体と接触し、4つの水素結合が形成されている(図5右)。膜貫通ヘリックス間の密な接触による自由エネルギーはヘリックスペア一組当たり~10 kcal/molであるとされる。このエネルギーはATP加水分解で放出される標準自由エネルギーが7.3 kcal/molであることを考えると、なかなかに大きなエネルギーである。もし、10 kcal/molのエネルギー差があれば存在確率は1/107となり、ほぼ存在し得ないことを意味する。一方、最初に述べたように、ATPによるAspの燐酸化そのものはエネルギー的に不利な過程であり、蛋白質側のエネルギーをそれに見合うように下げることによってバランスされ、燐酸化が可能になっていると考えられる。
それでは、E1·ATP·2Ca2+状態で、つまり、E2·ATP状態にCa2+が結合することによって、M1/M2ヘリックスが密に本体と接触できるようになるのは何故か?顕著な違いはPドメインの傾きである。E1·ATP·2Ca2+状態のPドメインは仮想モデルよりも20°持ち上がっている(図5中央・右)。これは、Ca2+の結合によって、M4ヘリックスが持ち上がる(~5 Å)とともに、M4C(M4ヘリックスの細胞質側半分)の傾きが変わり(6°;図5左上)、それに伴って、M5ヘリックスが真っ直ぐになるためである(図5右)。M4C、M5Cは短いβストランドで連結されているとともにPドメインに組み込まれており(図3b)、細胞質頭部は閉じているからPドメインとともに、NドメインもAドメインも-x方向(図5では右)に移動する(Aドメイン-Pドメインの接点があるP7ヘリックスで10 Å;図5中央上)。傾きの変化の支点(この場合M5CとM5Mの境界に位置するGly750)から遠く離れたAドメインはz方向にも大きく移動する。それに従って、Aドメインに直接連結されているM1/M2ヘリックスは本体側に大きく引っ張り上げられ(AドメインとM2ヘリックスの接合点(Glu125)で6 Å;図5中央下)、本体と接触する。M1ヘリックスはイオン通路の出入口を塞いでoccluded状態を作り出す[1][1] Toyoshima C and Mizutani T: Nature 430 (2004) 529-535.。この位置で、M2の内腔側の端はストッパーの役割をするM9'と水素結合を作って安定化され、M2細胞質側はM4Cと相補的な接触面を持つことになる。
E2·ATP状態では、Ca2+に配位するGlu771のプロトン化のために、M5ヘリックスは湾曲した状態で固定されている(図5左)。その状態でAドメインがE1位置にあるために、NドメインはE2(TG)状態よりもさらに深く傾斜する必要があった。その結果、Aドメインを膜面に近づけ、M1/M2を本体から離すことになっていたのである。つまり、プロトンの放出によってM5ヘリックスが真っすぐになり、さらにCa2+結合によってM2, M4ヘリックスが解放されて高い位置に来ることが燐酸化に必須であることが理解された。つまり、ポンプ作動機構に関する最も根本的な問いの一つに対する答えが得られたことになる。
要するにE2·ATPのAドメインはE1位置にあることが肝心なのである。この位置では上述のように、Ca2+が結合しない限り、ATPからの燐酸転移は起こらない。一方、無機燐酸による燐酸化も起こらない。無機燐酸による燐酸化のためには、E2P状態で実現されているように、燐酸化部位は溶媒から隔離されている必要がある[9][9] Toyoshima C, Norimatsu Y, Iwasawa S, Tsuda T and Ogawa H: Proc Natl Acad Sci USA. 104 (2007) 19831-19836.。つまり、Aドメインにあるsignature motif 181TGESループが静電的に特別な環境をアスパラギン酸のカルボキシル基の周りに形成することが必須なのであるが、そのためには、AドメインはE2位置にある必要がある。E2·ATPにおけるAドメインの位置(E1位置)では燐酸化部位(Asp351)は溶媒に露出している。なるほど、この位置に固定されている限り、燐酸化はどちらの方向からも(ATPからも無機燐酸からも)起こらない。実にstrategicな位置ではないか。
6. Aドメインの回転の役割
PNAS誌に論文を発表した2020年の理解[2][2] Kabashima Y, Ogawa H, Nakajima R and Toyoshima C: Proc Natl Acad Sci USA 117 (2020) 18448-18458.はここまでであった。実は、このAドメインの位置にはもっと生理的な意味がある。「何故にAドメインをここまで回転させる必要があるのか」ということである。Pドメインは楔形をしている。そのためAドメインはE2位置では膜表面から離れた高い位置にあり、E1位置では膜に接近する。実際の高さはPドメインの位置、傾きに依存し、Ca2+結合状態ではM5ヘリックスが真っ直ぐになる結果Pドメインは持ち上がる。その結果、Aドメインも持ち上がるので膜から離れることになる。このようなPドメインによる補正効果はあるが、AドメインはE1位置で膜に接近し、M1, M2ヘリックスも小胞体内腔側に下がる。その結果、何が起こるかというと、細胞質側ゲートが大きく開くのである。このことは、今までよく認識されていなかった。
AドメインにはM1, M2ヘリックスが直結している。そのため、NKAのE1·Mg2+状態とE1·3Na+状態の構造研究[4][4] Kanai R, Vilsen B, Cornelius F and Toyoshima C: closes the cytoplasmic gate. FEBS Lett. (2023) In Press.を行って初めて理解できたことなのだが、細胞質側ゲートの開閉はM1ヘリックスの上下運動が行っている。SERCAのE1·2Ca2+状態ではM1ヘリックスはAsp59のところで折れ曲がることなく、真っ直ぐなヘリックスとなる。E1·2Ca2+ではGlu309が2番目のCa2+に配位することによってCa2+に蓋をしているが、そのCa2+は細胞質にあるCa2+と交換可能である。その通路は、M1ヘリックスが真っ直ぐになることによってM2ヘリックスとともに形成された大きなV字型の上部であると考えられた。このこと自体は正しいのだが、本来、細胞質側のイオン通路はCa2+が結合する前に開かれているはずである。一番大きく開いている必要があるのは、Ca2+を受け入れる直前の状態、即ち、E1·Mg2+状態のはずである。実際、SERCAでもE1·Mg2+状態ではM1はAsp59のところで折れ曲がっており、且つ、Aドメインの大きな回転のために、E2状態よりもさらに内腔側に下がっている[7][7] Toyoshima C, Iwasawa S, Ogawa H, Hirata A, Tsueda J and Inesi G: Nature 495 (2013) 260-264.。その結果、細胞質側イオン通路は最も大きく口を開けているのであった。
2013年にE1·Mg2+状態の構造[7][7] Toyoshima C, Iwasawa S, Ogawa H, Hirata A, Tsueda J and Inesi G: Nature 495 (2013) 260-264.を発表した時にはどうしてM1ヘリックスが折れているのか、その必要性が分からなかった。M5ヘリックスはE1·Mg2+状態で一番真っ直ぐであり、E1·2Ca2+になるとむしろM10側に傾く。これは、結合したCa2+がM5ヘリックスを引っ張るためであり、PドメインはAドメインに近い側が一番持ち上がる(図2)。従って、M1/M2ヘリックスはE1ではE1·Mg2+状態で最も下がっている。これによって、イオン通路の入り口は大きく開かれる。また、M2ヘリックスは、E2では部分的にほどけていたが、Aドメインの回転によって、AドメインのM2ヘリックスとのつなぎ目は膜に近づくため、M2ヘリックスに許される長さは短くなり連続的なヘリックスになる。こうして初めて、次の段階(図2のステップ1)でM2ヘリックスを引き上げ、細胞質側ゲートをロックすること[1][1] Toyoshima C and Mizutani T: Nature 430 (2004) 529-535.が可能になる。これだけの仕事をAドメインの回転はしていたのである。
E2·ATP状態はE2であるからプロトンはまだ放出されてはいないが、細胞質側イオン通路を開けて、ゲート残基であるGlu309(M4CとM4Lを繋ぐループに位置する;図5中央下)の側鎖が変化してプロトンが解放されるのを待っていなくてはなるまい。それが、E2·ATP状態なのである。また、Ca2+を受け入れるために別の通路を開けるのは不経済だから、その通路は開けたまま待っている。それが、E1·Mg2+状態なのだ。だからE2→E1でAドメインの大きい回転が起こるのだ。
それを理解するのに10年かかってしまった。NKAの対応する構造[4][4] Kanai R, Vilsen B, Cornelius F and Toyoshima C: closes the cytoplasmic gate. FEBS Lett. (2023) In Press.を研究しなかったらきっと一生(私以外にSERCAの構造を極めようという偏屈はいないかもしれないので、そのときは永久に)理解されなかったに違いない。結局のところ、得られる結論(教訓)はいつも同じである。①蛋白質はあまりにも良くできている。②構造の意味を理解するにはとんでもなく時間がかかる。③似て非なるものは役に立つ(こともある)。④だから、実験はやってみるものだ!
参考文献
[1] Toyoshima C and Mizutani T: Nature 430 (2004) 529-535.
[2] Kabashima Y, Ogawa H, Nakajima R and Toyoshima C: Proc Natl Acad Sci USA 117 (2020) 18448-18458.
[3] Kanai R, Cornelius F, Vilsen B and Toyoshima C: FEBS Lett. 596 (2022) 2513-2524.
[4] Kanai R, Vilsen B, Cornelius F and Toyoshima C: closes the cytoplasmic gate. FEBS Lett. (2023) In Press.
[5] Norimatsu Y, Hasegawa K, Shimizu N and Toyoshima C: Nature 545 (2017) 193-198.
[6] Toyoshima C, Yonekura SI, Tsueda J and Iwasawa S: Proc Natl Acad Sci USA 108 (2011) 1833-1838.
[7] Toyoshima C, Iwasawa S, Ogawa H, Hirata A, Tsueda J and Inesi G: Nature 495 (2013) 260-264.
[8] Tsunekawa N, Ogawa H, Tsueda J, Akiba T and Toyoshima C: Proc Natl Acad Sci USA 115 (2018) 12722-12727.
[9] Toyoshima C, Norimatsu Y, Iwasawa S, Tsuda T and Ogawa H: Proc Natl Acad Sci USA. 104 (2007) 19831-19836.
東京大学 定量生命科学研究所
〒113-0032 東京都文京区弥生1-1-1
TEL : 03-5841-8492
e-mail : ct@iqb.u-tokyo.ac.jp








