Volume 25, No.1 Pages 2 - 5
1. 最近の研究から/FROM LATEST RESEARCH
パーキンソン病患者の剖検脳を用いた脳内凝集体に対する微細構造解析にて新たな疾患概念を提唱
Fine Structural Analysis of Aggregates in Autopsy Brains of Parkinson’s Disease Patients
[1]大阪大学 大学院医学系研究科 神経内科学 Department of Neurology, Graduate School of Medicine, Osaka University、[2](公財)高輝度光科学研究センター 放射光利用研究基盤センター タンパク質結晶解析推進室 Protein Crystal Analysis Division, Center for Synchrotron Radiation Research, JASRI
- Abstract
- パーキンソン病はアルツハイマー病に次いで2番目に多い神経変性疾患であり、その発症機序はいまだ不明であり、進行を抑制する根本的治療も存在しない。古くからパーキンソン病患者の脳内にはレビー小体という特徴的な異常凝集体が見られることがわかっており、病態解明の重要な手がかりであると考えられてきた。近年、この凝集体がプリオンのように脳内を伝播するという報告が次々となされた。しかしながら、それらの報告は人工的に作成したアミロイド線維の断片を細胞や動物に接種した実験であり、患者の脳内でそのような現象が実際に起こっているという十分な証拠はない。そこで、我々は顕微赤外分光やX線マイクロビームを用いて、パーキンソン病患者剖検脳内のレビー小体に対する微細構造解析を行い、患者の脳内でも異常凝集体が伝播していることを支持する重要な証拠を得るとともにパーキンソン病の新たな疾患概念を提唱するに至った。
1. はじめに
医師は、患者から症状を聴取し、身体所見をとり、血液や画像の検査結果から診断を下し、それに対して治療を行う。この一連の医療行為は今も昔も不変ではあるが、近年、癌の治療はその表面マーカーの違いによって決定され、ある種の疾患は疾患特異的な抗体の有無で診断されるといった具合に蛋白質レベル、分子レベルでの診断や治療がなされるようになってきた。このような分子レベルでの医学的アプローチは、抗体を利用することで遂行されることがほとんどであるが、抗体によってもたらされる構造情報は限定的であり、蛋白質レベルでの構造変化が病態に深く関与している疾患では十分な情報を得ることはできない。生体試料に対する微細構造解析は容易ではないが、医学をさらに次のステージへと発展させていくためには克服せねばならない障壁であり、それを実現し得るツールの開発は不可欠と思われる。放射線の応用により、生体内の非侵襲的可視化が実現され、診断や治療技術は大きく進歩してきた。レントゲンの発見から120年余り経過した今日、あらためて放射光が次世代の医学的ツールとなり得るポテンシャルを備えているのではないかと思う。
2. アミロイドとは?
本研究の要点を理解しやすくするために「アミロイド」の定義を確認しておきたい(図1)。生物物理学的な定義では、アミロイド線維とはクロスβ構造という特徴的な構造をもった不溶性の蛋白質の線維である。クロスβ構造は繰り返し構造を持ち、蛋白質の種類によらずアミロイド線維に共通する特徴的な構造とされている。1935年にAstburyらにより初めて報告された蛋白質の基本構造の一つで、その基本単位は線維軸に対して垂直に積み重なったβストランドが形成するβシートの層から成っている。アミロイド線維にX線を照射すると、各βストランド間の距離に対応する4.7 Åの反射と隣り合ったβシート間の距離に対応する約10 Åの反射を示すため、それらを用いてその存在を確認できる。
一方、病理学的なアミロイドの定義は、古典的かつ曖昧であり、実用的にはコンゴレッドで染色される、または電子顕微鏡で特徴的な線維構造を呈する細胞外沈着物とされている。
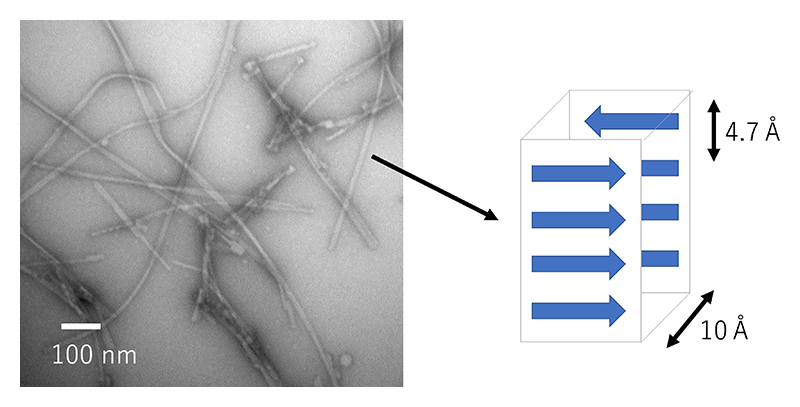
図1 アミロイド線維とは?
3. レビー小体
レビー小体はパーキンソン病患者の脳内に見られる直径10 µm前後の特徴的な異常凝集体である。レビー小体を構成する主たる成分はαシヌクレインという蛋白質であることがわかっており、その遺伝子変異がパーキンソン病を発症させることもわかっていることから、αシヌクレインが発症の重要な鍵を握っていると考えられている。近年、人工的に作成したαシヌクレインのアミロイド線維の断片を動物や細胞に接種すると伝播したとする報告が多くなされ、αシヌクレインがプリオンである可能性が示唆されている[1-3][1] K. C. Luk et al.: Science 338 (2012) 949-953.
[2] M. Masuda-Suzukake et al.: Brain 136 (2013) 1128-1138.
[3] S. B. Prusiner et al.: Proc. Natl. Acad. Sci. USA 112 (2015) E5308-5317.。同時にこのαシヌクレインの凝集や伝播を抑制することで進行を遅らせようとする根本治療の開発も進められており、欧米では治験も開始されている。しかしながら、同様の現象がパーキンソン病患者の体内で起こっているという証拠はなく、αシヌクレインがプリオンか否かという構造学的な検討も十分にはなされていないのが現状である。もし、患者の脳内でも実験と同様の伝播現象が起こっているのであれば、脳内にクロスβ構造をもったアミロイド線維が検出されるはずである。そこで、我々はパーキンソン病患者剖検脳内のレビー小体に対して、放射光を用いた微細構造解析を行うことで、伝播実験の正当性について検討することとした。
4. 顕微赤外分光
SPring-8のBL43IRにおいて、顕微赤外分光によるレビー小体の構造解析を行った[4][4] K. Araki et al.: Sci. Rep. 5 (2015) 17625.。10 µmにスライスした脳切片をフッ化カルシウム基板にのせ、レビー小体を同定するために抗αシヌクレイン抗体で免疫染色し、測定までに乾燥させた。レビー小体を含む30 µm × 30 µm程度の領域を3 µmステップで2次元スキャンして測定した。各点から得られた吸収スペクトルのアミドI結合に注目し、蛋白質の2次構造を反映するとされる代表的な4つのピークでカーブフィッティングを行い、βシート構造の割合を算出した(図2、詳細は文献[4]を参照)。その結果、レビー小体では正常脳組織よりもβシート構造の割合が高いことがわかった。
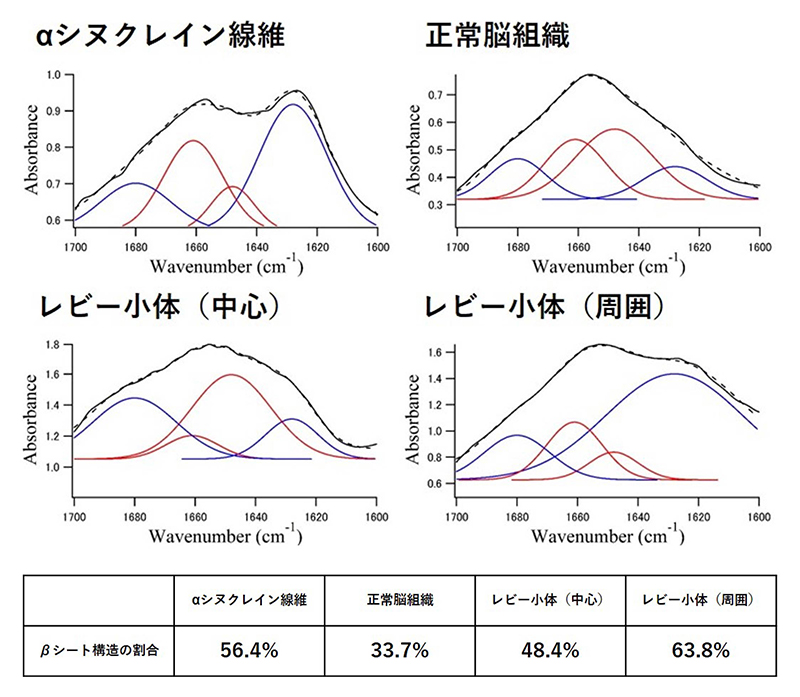
図2 βシート構造の割合
さらにβシート構造の割合は中心部分(コア)よりも周囲部分(ハロー)でその割合が高いことがわかり、これは電子顕微鏡による観察でハローに線維状構造物が多くみられるというこれまでの結果と合致するものであった(図3)。ここで、電子顕微鏡では線維状構造物が存在することがわかっても生物物理学的な定義を満たすアミロイド線維かどうかはわからないということに注意が必要である。今回の我々の研究によって、線維状構造物におけるβシート構造の割合が高いであろうことが初めて示されたのである。一方、脂質に着目した解析結果からは、コアに多くの脂質を含んでいることがわかったが、最近になって、パーキンソン病と脂質の関連に注目が集まっていることは興味深い。
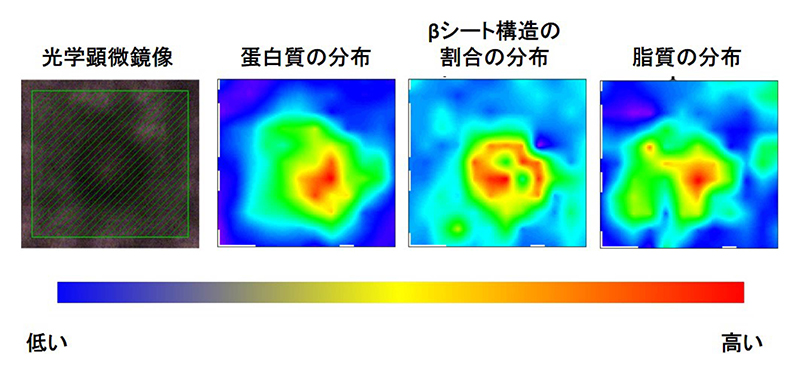
図3 レビー小体の2次元マッピング
5. マイクロビームX線回折
SPring-8のBL40XUにおいて、マイクロビームを用いたX線回折によるレビー小体の構造解析を行った[5][5] K. Araki et al.: Proc. Natl. Acad. Sci. USA 116 (2019) 17963-17969.。30 µmにスライスした脳切片をカプトン膜にのせ、抗αシヌクレイン抗体で免疫染色し、測定までに乾燥させた。レビー小体を含む50 µm × 50 µm程度の領域を5 µmステップで2次元スキャンして測定した。人工的に作成したαシヌクレインのアミロイド線維やアルツハイマー病モデルマウスの脳内凝集体(老人斑)ではクロスβ構造に特徴的な回折パターンが容易に得られたが、パーキンソン病患者剖検脳のレビー小体においてはその特徴的なパターンがなかなか得られなかった。試行錯誤の末、いくつかのレビー小体がクロスβ構造を有していることが確認され、動物や細胞を用いた伝播実験と同じような現象が患者の体内でも起こっている可能性があることを示す重要な証拠が得られた(図4)。
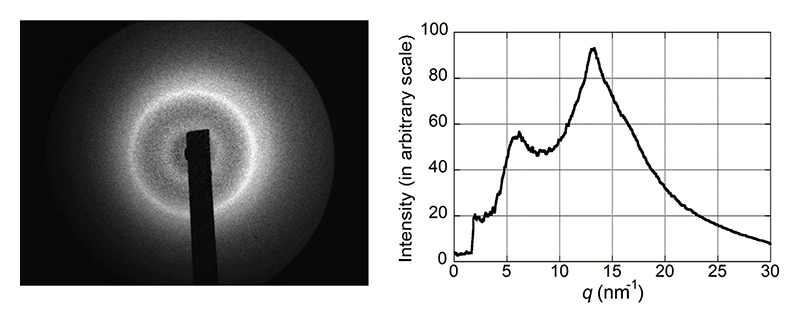
図4 レビー小体におけるX線回折像
6. パーキンソン病はアミロイドーシスか?
「アミロイドーシス」という疾患をご存知だろうか?日本アミロイドーシス学会の定義によると、アミロイドーシスは、「線維状蛋白であるアミロイド細線維が細胞外へ沈着する疾患の総称」とのことである。どの臓器にアミロイド線維が沈着するかにより、さまざまな症状を呈する難病の一つである。意外と知られていないが、アルツハイマー病はアミロイドβ蛋白のアミロイド線維が脳内の神経細胞外に蓄積することがわかっているので、アミロイドーシスの定義を満たし、限局性アミロイドーシスの一種とされる。トランスサイレチンの異常が原因の家族性アミロイドーシスではアミロイド線維の凝集を阻害することで進行を抑制できることが示され、2019年11月現在、日本においても保険適応で治療が可能である。同様の発想で、アルツハイマー病に対しても凝集抑制治療の開発が盛んに行われているが実用化には至っていない。
ところで、パーキンソン病は安静時振戦、筋強剛、動作緩慢、姿勢反射障害などの運動症状を特徴とする神経変性疾患であるが、近年、便秘や嗅覚障害、発汗異常などの非運動症状も呈することがわかってきており、それらの症状に対応する各臓器においてレビー小体も見出されることが報告されている。このような病像は、全身にアミロイド線維が沈着して、さまざまな症状を呈する全身性アミロイドーシスと類似している。
では、レビー小体を有するパーキンソン病はアミロイドーシスの定義を満たすのだろうか?本研究成果が得られるまでは、以下の2つの点で定義を満たさないと考えられた。
①レビー小体はもちろんとして、パーキンソン病患者の体内にアミロイド線維の存在が証明されていなかった点
②レビー小体は神経細胞内(外ではなく)の沈着物である点
しかしながら、今回の我々の研究によって、パーキンソン病患者の体内にはアミロイド線維の沈着があることが示されたことから、①は修正されることとなった。一方、②については、細胞“外”と定義することに本質的な意義はないように思われる。臨床の現場においては、コンゴレッド染色でアミロイドを同定するのだが、単に細胞外沈着物が染色されやすかったことに由来しているのではないかと推察される。今回の我々の研究によって、細胞内にアミロイド線維が蓄積する疾患が存在することが証明された以上、アミロイドーシスの定義から、“細胞外”という文言を削除すべきではないかと私は考える。診断基準というものは治療や予防を意識して人為的に作られたものなので、必ずしも病態の本質をうまくとらえているとは限らない。全身の臓器にアミロイド線維が蓄積するという共通の病態を重視すれば、「パーキンソン病はアミロイドーシスの一種である」と考える方が自然ではないだろうか。
7. 最後に
今回の研究成果は非常に単純ではあるが、in vitro実験はもちろんとして実験動物や培養細胞でもなく、パーキンソン病患者の剖検脳内に実在する直径10 µm程度の微小構造物を本来の姿にほぼ近い形で構造解析できたという意味で革新的である。また、すべての結果を得るまでには5年以上の時間を要しており、試行錯誤しながら、何とか測定システムを生体試料に対する微細構造解析ツールとして確立できたという意義も大きいと考えている。我々は取り扱いの難しい脳組織に対する測定に成功していることから、他臓器への流用は容易であると思われ、本研究手法が次世代の病理学的観察ツールとして発展していくことが期待される。
謝辞
本研究を開始するにあたり、私がSPring-8で研究を行うきっかけを与えてくださった大阪大学大学院生命機能研究科の難波啓一先生、アミロイド科学についてご指導くださった大阪大学蛋白質研究所の後藤祐児先生、患者試料をご提供くださった国立病院機構大阪刀根山医療センターの藤村晴俊先生に深く感謝申し上げる。
放射光実験はすべてSPring-8で行われ、顕微赤外分光はBL43IR、マイクロビームX線回折はBL40XUで行われた(課題番号2013A1671、2013B1737、2014A1711、2014A1712、2014B1747、2014B1811、2015A1765、2015A1858、2015B1688、2016B1234、2016B1235、2017B1074、2017B1281、2018A1115、2018A1117)。ビームライン担当者の青山光輝氏、池本夕佳氏、森脇太郎氏にはこの場を借りて深くお礼申し上げる。
なお、本研究の大部分は科学研究費補助金等の助成を受けて行われた。
参考文献
[1] K. C. Luk et al.: Science 338 (2012) 949-953.
[2] M. Masuda-Suzukake et al.: Brain 136 (2013) 1128-1138.
[3] S. B. Prusiner et al.: Proc. Natl. Acad. Sci. USA 112 (2015) E5308-5317.
[4] K. Araki et al.: Sci. Rep. 5 (2015) 17625.
[5] K. Araki et al.: Proc. Natl. Acad. Sci. USA 116 (2019) 17963-17969.
大阪大学 大学院医学系研究科 神経内科学
〒565-0871 大阪府吹田市山田丘2-2
TEL : 06-6879-3571
e-mail : araki@neurol.med.osaka-u.ac.jp
大阪大学 大学院医学系研究科 神経内科学
〒565-0871 大阪府吹田市山田丘2-2
TEL : 06-6879-3571
e-mail : hmochizuki@neurol.med.osaka-u.ac.jp
(公財)高輝度光科学研究センター
放射光利用研究基盤センター タンパク質結晶解析推進室
〒679-5198 兵庫県佐用郡佐用町光都1-1-1
TEL : 0791-58-0908
e-mail : yagi@spring8.or.jp








