Volume 22, No.3 Pages 233 - 237
1. 最近の研究から/FROM LATEST RESEARCH
専用ビームラインの研究から ~BL44XU(大阪大学蛋白質研究所)~
植物光化学系I-集光性アンテナI超複合体におけるエネルギー伝達の構造基盤
Crystal Structure of the Plant Photosystem I and Light Harvesting Complex I Supercomplex at 2.8 Å Resolution
岡山大学 異分野基礎科学研究所 Research Institute for Interdisciplinary Science, Okayama University
- Abstract
- 光化学系I複合体は光駆動による一連の電子伝達を行い、糖の合成に必要な還元力を供給している。植物の光化学系I複合体は反応中心コアと光捕集アンテナI複合体が光化学系I−光捕集アンテナI超複合体を形成し、光エネルギーをほぼ100%の効率で伝達および変換している。光合成における光エネルギーの高効率利用の基本原理を理解することを目的とし、筆者らは高等植物エンドウマメ由来の光化学系I−光捕集アンテナI超複合体の結晶構造を分解能2.8 Åで決定した。これにより、分子量が60万に及ぶ超複合体の詳細な構造、とりわけ、光捕集アンテナIを構成する4つのLhcaサブユニットにおいて秩序正しく配置されたクロロフィル、カロテノイド、脂質分子、水分子などの分子基盤を明らかにし、光エネルギーの捕集と伝達の経路、および、光阻害に対する防御機構を提唱した。
1. はじめに
植物や各種の藻類が行う酸素発生型光合成は、太陽光を利用して水を分解して酸素分子を放出するとともに、二酸化炭素から有機物をつくりだす反応である。約30億年前に酸素発生型の光合成能を持つシアノバクテリアが出現し、大気中の酸素濃度を徐々に上昇させ、好気生物の進化・繁栄を牽引した。そして今日に至るまで地球上に絶え間なく降り注いでいる太陽の光エネルギーは糖の形として化学エネルギーへと変換され、ほぼ全ての生物の生存維持に必要なエネルギー供給源となっている。光化学系I複合体(Photosystem I, PSI)は光エネルギーを利用してプラストシアニンからフェレドキシンへの電子伝達を仲介し、糖合成に必要となる還元力であるニコチンアミドアデニンジヌクレオチドリン酸(Nicotinamide Adenine Dinucleotide Phosphate, NADPH)の供給を担っている(図1)。
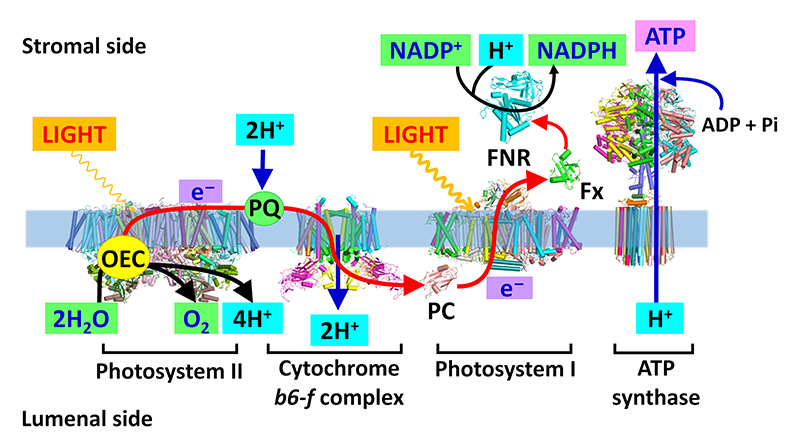
図1 酸素発生型光合成における膜タンパク質と電子伝達鎖
シアノバクテリアの出現から高等植物の繁栄に至るまで、生物は酸素発生型の光合成の効率と性能を巧みに進化させた。天候の変化により太陽光の照射量は大きく変動するが、植物には雨の日でも光合成ができる光エネルギー利用の効率の良さだけでなく、真夏の太陽光でもタンパク質を損傷させないために光エネルギーを積極的に捨てることも必要になる。
PSIは電荷分離反応を行う反応中心コア部分を厳密に保存しつつも、前述したような高度に制御された光エネルギーの利用を実現するためにアンテナ系タンパク質複合体を獲得した。シアノバクテリアのPSIは三量体として存在するのに対し[1][1] P. Jordan, P. Fromme, H. T. Witt, O. Klukas, W. Saenger and N. Kraus: Nature 411 (2001) 909-917.、植物のPSIは単量体として存在して光捕集アンテナI複合体(Light Harvesting Complex I, LHCI)と分子量60万に及ぶPSI-LHCI超複合体を形成する[2][2] A. Ben-Shem, F. Frolow and N. Nelson: Nature 426 (2003) 630-635.。
これまでの分光学的および生化学的な研究から、植物のLHCIは4つの膜タンパク質サブユニットLhca1~Lhca4から構成される複合体であり、クロロフィルa(Chlorophyll, Chl a)、Chl bおよび複数種のカロテノイドを適切に配置してエネルギーを高い効率で伝達するだけでなく、蓄積されたエネルギーを熱として散逸させる仕組みも備え持つことが明らかにされている。我々はこのエネルギー伝達の構造基盤を明らかにすることを目的とし、エンドウマメの葉から単離したPSI-LHCI超複合体を結晶化し、SPring-8のBL44XUとBL41XUの高輝度X線により2.8 Å分解能で構造解析を行った[3,4][3] X. Qin, M. Suga, T. Kuang and J. R. Shen: Science 348 (2015) 989-995.
[4] M. Suga, X. Qin, T. Kuang and J. R. Shen: Curr. Opin. Struc. Biol. 39 (2016) 46-53.。
2. 植物PSI-LHCI超複合体の全体構造
PSI-LHCI超複合体はLhca1~Lhca4の4つのLHCIサブユニットに加え、反応中心コア部分を構成する9つの膜貫通サブユニット(PsaA, PsaB, PsaF~PsaL)および3つの表在性サブユニット(PsaC~PsaE)からなる計16のサブユニットから構成され、長さ140 Åの親骨を持つ扇子のような構造をしている(図2)。この構造解析により、PSI-LHCI超複合体に含まれる、143個のChl a、12個のChl b、35個のカロテノイド(26個のβカロテン、5個のルテイン、4個のビオラキサンチン)、10個の脂質分子(6個のホスファチジルグリセロール、3個のモノガラクトシルジアシルグリセロール、1個のジガラクトシルジアシルグリセロール)、3個のFe4S4クラスター、2個のフィロキノンの正確な位置と配向が明らかになった。これまでの構造解析とは異なり、筆者らの構造では、Chl aとChl bの区別ができたことにより、LHCIから反応中心コア部分へのエネルギー伝達の経路を特定し、カロテノイドの種類を特定したことで、キサントフィル回路に関与するビオラキサンチンの結合箇所を明らかにして機能の理解に大きく貢献した。
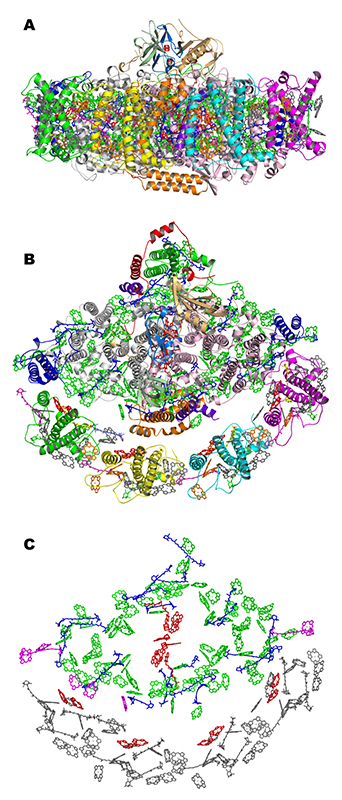
図2 植物PSI-LHCI超複合体の結晶構造
(A) 膜面に平行な方向および、(B) 垂直な方向からみたもの。(C) タンパク質複合体中の補因子のみを(B)と同じ方向であらわしたもの。反応中心およびエネルギー伝達に関わる各LhcaサブユニットにおけるChl二量体(a603とa609)を赤色であらわす。文献[4][4] M. Suga, X. Qin, T. Kuang and J. R. Shen: Curr. Opin. Struc. Biol. 39 (2016) 46-53.より引用した。
3. LHCIから反応中心コア部分への励起エネルギーの伝達経路
PSI-LHCI超複合体におけるエネルギーの伝達の効率はほぼ100%である。すなわち、弱光条件でLHCIが吸収した全ての光エネルギーは励起エネルギーとして反応中心コア部分に導かれ電荷分離反応が起こる。この励起エネルギーを伝達する経路についてはさまざまな議論がなされているが、今回決定したPSI-LHCI超複合体の結晶構造は反応中心コア部分とLHCIとの間に存在している集光性色素の正確な位置を明らかにしたことで、これまで蓄積されてきた分光学による実験結果を説明しうる分子基盤を提供した。さらに集光性色素の配置に基づき、これまでは不確定であったエネルギー伝達の経路を特定した。エネルギー伝達の経路を議論するにあたり、最も低いエネルギー準位を持つ、すなわち、エネルギーを効率的に捕捉することのできるRed Chlに注目する。真核生物のPSI-LHCI超複合体では、Red Chlのほとんどが各Lhcaサブユニットに存在しているChl a603とa609のChl二量体であるとされている。Lhca1~4におけるいずれのChl a603-609もChlのテトラピロール環のC環とE環(テトラピロール環と五員環が連結している部分)が平行に並び重なり、周囲に集光性色素を配置して効率良くLHCI内の光エネルギーを集めることができる。さらにこれら二量体ChlはLHCIの内側部分に結合し、Chlのフィトール鎖を反応中心コア部分に向けて大きく突き出すようにして固定され、励起エネルギーを伝達するのに合理的な構造をとっていると考えられる。なお、各Lhcaサブユニットは共通性のあるフォールディングと集光性色素の配置を持つが、反応中心コア部分との相互作用の強さには差異があり、それゆえ、それぞれのLhcaサブユニットから反応中心コア部分へのエネルギー伝達の効率は異なることが明らかにされた。筆者らはこれらの相互作用の強さに基づき、励起エネルギーは主にLhca1とLhca3サブユニットから、それぞれPsaAとPsaBサブユニットへと膜の両面において伝達されていることを提唱した(図3)。

図3 励起エネルギーの伝達経路
膜面に垂直な方向でルーメン側から見たもの。またLhca1を緑、Lhca4を黄、Lhca2を青、Lhca3を桃、PsaAをカーキ、PsaBを灰で表す。ストロマ側の経路を水色、ルーメン側の経路を赤色の矢印で示す。矢印の太さは伝達の効率を表す。文献[4][4] M. Suga, X. Qin, T. Kuang and J. R. Shen: Curr. Opin. Struc. Biol. 39 (2016) 46-53.のものを改変して引用した。
これらのうち、前述の二量体Chlはストロマ側の1Bsパスおよび3Asパスにおいて機能しており、ルーメン側は二量体Chlを必要としない1Blパスおよび3Alパスが存在している。これらパスの命名方法はLhcaサブユニット名−Psaサブユニット名−ストロマ側かルーメン側かに従っている。これらパスにおけるLHCIと反応中心コア部分との距離は、1Bsパスが7.5 Å、3Asパスが10.2 Å、1Blパスが5.5 Å、3Alパスが5.8 Åである。
4. LHCIにおけるカロテノイドの配置とその機能
Lhca1~Lhca4サブユニットはそれぞれが3~4個のカロテノイドを結合しており、LHCIには全部で13個のカロテノイドが結合している(図4)。高分解能で構造解析されている同じLHCファミリーのLHCIIでは4つのカロテノイドの結合部位が同定され、膜貫通ヘリックスAおよび膜貫通ヘリックスBが形成する溝にルテインを結合するL1部位およびL2部位、膜貫通ヘリックスCの近傍にネオキサンチンを結合するN1部位、隣接するLHCIIとの境界にビオラキサンチンを結合するV1部位が存在する(LHCIIは三量体、LHCIは二量体−二量体と会合様式が異なっているためV1部位は示していない。)。LHCIにおいては、いずれのLhcaサブユニットにおいてもL1部位にルテイン、L2部位にビオラキサンチン、N1部位にBCRが結合していたが、V1部位にはカロテノイドは何も見つからず、Lhca1のみ新規のL4部位にルテインが結合していた(図4)。
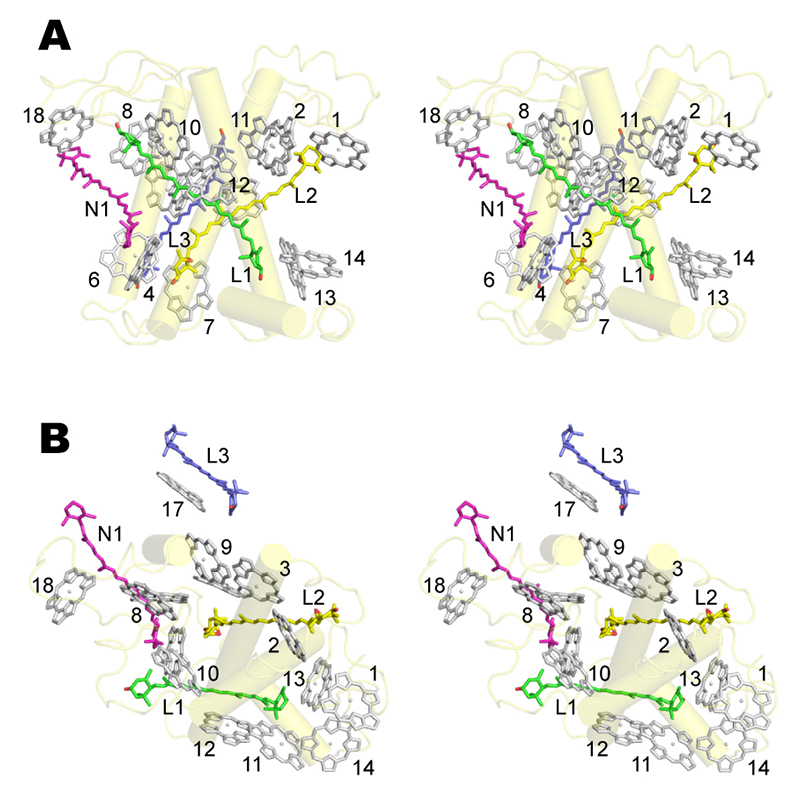
図4 Chlおよびカロテノイドの結合サイト
膜に平行(A)および垂直(B)な方向からLhca4サブユニットについてステレオ表示であらわした。数字はChlの結合サイトをあらわしている。文献[3][3] X. Qin, M. Suga, T. Kuang and J. R. Shen: Science 348 (2015) 989-995.より引用した。
本研究により特定されたカロテノイドのうち、本稿ではキサントフィル回路に関与するビオラキサンチンについて紹介する。ビオラキサンチンは強光条件下においてビオラキサンチンデエポキシダーゼにより脱エポキシ化されてゼアキサンチンとなり、Chlの励起エネルギーを奪い熱として捨てる。これは過剰な光エネルギーの吸収によってタンパク質が損傷されるのを防ぐため、過度に光化学反応が進行して蓄積したルーメン側のプロトンをビオラキサンチンデエポキシダーゼが感知して負のフィードバックをかける仕組みであり、キサントフィル回路とよばれる。このような防御機構はLHCIIについては古くから知られていたが、つい最近まで、多くの研究者はLHCIではキサントフィル回路は機能しないと考えていた。しかし、筆者らのPSI-LHCI超複合体の結晶構造ではL2部位にビオラキサンチンが結合しており、これはLHCIにおいてもキサントフィル回路が機能していることを示唆している。さらに解析された立体構造に基づきLhca1~Lhca4サブユニット間で差異があり、Lhca2およびLhca4ではLhca1およびLhca3よりもキサントフィル回路が活発であることを提案した。
5. おわりに
本研究により、高等植物のPSI-LHCI超複合体の詳細な構造が明らかになった。立体構造に基づき、どのようにして巨大な超複合体が形成されるか、そして励起されたエネルギーはどの経路を通って反応中心コア部分へと導かれるか、など超複合体に関する長年の疑問に答えただけでなく、L2部位に結合するビオラキサンチンがキサントフィル回路により非光化学的消光の役割を担っているという新たな提案も行った。これらの構造基盤は、光エネルギーをより効率良く利用することのできる新規のエネルギー変換材料のモデルテンプレートともなることが期待される。
謝辞
本研究は中国科学院植物研究所のXiaochun Qin、Tingyun Kuang諸氏との共同研究である。X線結晶構造解析データは、SPring-8のBL44XUおよびBL41XUにて測定した。課題番号は、2014A1243、2014A6927、2014B1281、2014B6927、2015A1108、2015A6522、2015B2108、2015B6522である。ビームラインの山下栄樹、東浦彰史、中川敦史、長谷川和也、奥村英夫、熊坂崇諸氏にはこの場を借りてお礼申し上げる。また原稿執筆の機会を下さった大阪大学蛋白質研究所中川敦史教授、山下栄樹准教授にお礼申し上げる。また本研究は科学研究費補助金等の助成を受けて行った。
参考文献
[1] P. Jordan, P. Fromme, H. T. Witt, O. Klukas, W. Saenger and N. Kraus: Nature 411 (2001) 909-917.
[2] A. Ben-Shem, F. Frolow and N. Nelson: Nature 426 (2003) 630-635.
[3] X. Qin, M. Suga, T. Kuang and J. R. Shen: Science 348 (2015) 989-995.
[4] M. Suga, X. Qin, T. Kuang and J. R. Shen: Curr. Opin. Struc. Biol. 39 (2016) 46-53.
※用語解説
・光化学系I複合体(Photosystem I, PSI)
酸素発生型光合成において働く二つの光化学系(光化学系Iと光化学系II)のうち、光化学系Iではアンテナ内のクロロフィル(後述)が吸収した太陽光のエネルギーを反応中心のクロロフィルへと伝達して高い還元力を作り出している。この光エネルギーは光化学系Iがプラストシアニンもしくはシトクロムc6より得た電子をフェレドキシンへと受け渡し還元力であるNADPH(後述)を作り出すために利用される。
・ニコチンアミドアデニンジヌクレオチドリン酸(Nicotinamide Adenine Dinucleotide Phosphate, NADPH)
生体内の光合成経路や解糖系において補酵素として存在し、還元力を供給している。
・クロロフィルa(Chlorophyll a, Chl a)
吸収帯を700 nm付近に持つ色素体で、4つのテトラピロール環が連結して、さらにフィトール鎖の部分と共有結合した構造をとる。植物のLHCIではChl aだけでなくChl bも色素体として含まれる。Chl aとChl bは非常によく似た構造をしているが、テトラピロールのC7位がChl aではメチル基であるのに対し、Chl bでは該当部分がアルデヒド基となっているため光エネルギーの吸収スペクトルが僅かに異なる。
岡山大学 異分野基礎科学研究所
〒700-8530 岡山県岡山市北区津島中3-1-1
TEL : 086-251-8630
e-mail : suga@okayama-u.ac.jp
岡山大学 異分野基礎科学研究所
〒700-8530 岡山県岡山市北区津島中3-1-1
TEL : 086-251-8502
e-mail : shen@okayama-u.ac.jp
大阪大学蛋白質研究所では、BL44XUの利用に関する共同利用研究課題の募集を行っています。
ビームラインの詳細を知りたい方、利用を希望される方は、http://www.protein.osaka-u.ac.jp/rcsfp/supracryst/research/beamline/をご覧いただくか、bladmin@protein.osaka-u.ac.jpまでご連絡ください。








