Volume 13, No.2 Pages 110 - 121
2. 最近の研究から/FROM LATEST RESEARCH
X線1分子追跡法考案ビフォーアフター
Proposing and Afterwards at Diffracted X-ray Tracking (DXT) Method
1. 計測法研究の意義とその困難さ
新しい学問領域は、新しい計測手段の発明から生み出されることは科学史が示している。1930年代、M. Delbrückらは当時分類学の一種であった生物学を物理学として取り扱おうとした。その成功が決定的になったのは、M. Delbrück傘下のA.Hersheyが32Pと35Sを高感度に分離できる放射性同位体実験に成功した時だった[1][1] A. D. Hershey and M. Chase: J. Gen. Physiol. 36 (1952) 39.。これにより明確に核酸のみの挙動を定量的に解析でき、分子生物学や細胞生物学がスタートした。また1950年代には、J. Watson、F. CrickがDNAの構造モデルを提案しようとした。その際も、R. FranklinやM. WilkinsのX線データがなければ、遺伝学の根本的難題を解決するあの美しい相補的な分子構造モデルを思いつくことはなかった[2][2] J. D. Watson and F. H. Crick: Nature 171 (1953) 737.。偶然的な要因が多々重なるが、ブレイクスルー的な科学的進展には、当時の先端的計測法が重要な役割を果たしてきた。
では現代において上記のような計測法とはどのような手段になるのか?「可視光を用いた原子顕微鏡」は現在議論されている。「1分子構造決定法」はもう始まっている。ミクロの決死圏的な「ナノロボットによる人体内計測」はかなり現実的だし、「脳機能(記憶)のビジュアル化」も十分可能性がある。測定規模を大きくするならば、「重力波検出」はすでに実践的で、「地球規模の地盤ひずみ断層計測」では有効な情報が得られそうである。「体内において、1分子内部の運動を高速かつ原子オーダー以下の精度で追跡」は今となってはそれほど驚かない。現状でも数通りの計測可能性を提案できる。
計測法の長い歴史を振り返ると、今まで多くの計測法がNobel Prizeに輝いた。X線回折(1914年、1915年、1946年、1962年、1964年、1985年、1988年、2003年)、X線分光(1917年、1924年)、電子分光(1937年、1981年、1982年)、中性子回折(1938年、1994年)、光電子分光(1981年、2007年)、原子分光(1919年、1943年、1944年、1955年、1961年、2005年)、レーザー分光(1981年、1989年)、可視域干渉計(1907年、1908年)、ホログラフィー(1971年)、レーザートラッピング(1989年、1997年、2001年)、NMR(1952年、1955年、2002年、2003年)、電子顕微鏡(1986年、2003年)、質量分析法(1922年、2002年)、光学顕微鏡(1953年)、走査型トンネル顕微鏡(1986年)、心電図法(1924年)、電気泳動法(1948年、1980年)、放射性トレーサー法(1943年、1969年、1977年)、断層撮影CT技術(1979年)、フーリエ変換FT技術(1991年)、パッチクランプ法(1991年)。受賞は10年周期とか、5年周期とか囁かれるほどに多い。現代科学の根幹を支えている間違いのない証拠である。しかし、意外と新規の計測法を専門として研究を進展させている研究者人口はそれほど多くない。測定法自身を研究テーマにはしているが、その方法はすでに基本概念が確立されている系であり、その高速化、高精度化、測定系の拡張、そしてコンパクト化といったことに主眼を置いた研究や、他の計測手段との複合化を進めている研究は「計測法研究」とは私はいわない。無論、それらの研究はその方法論を進展させる上で間違いなく必要な研究段階ではあるが、計測方法論自身の検討、つまり、新しい基本概念の検討を主目的にした研究者人口がもう少し増えてもよい。方法論研究の難しさがそこに表れている。
新規計測法を有名にするのは、新規の科学的進展を目の当たりにさせる巧妙なサンプル系との組み合わせが必要になる場合が多い。計測法の考案は相当先を見て研究を進めなければ時代遅れになってしまう。時には新規な計測結果自身のみに目が奪われ、計測法の価値が軽んずられる場合も少なくない。計測屋の歯軋りする音が聞こえる。それでも新規計測法提案の重要性は変わらない。その学際的影響力の広さといい、顕微鏡的計測手段でなくとも、「百聞は一見に如かず」という研究戦略は爽快感さえあり、研究展開を如実に加速させる。ただ、ここで計測屋の独り善がりの戯言と思われないために、F. Burnetのクローン選択仮説を一例として引用するべきだろう。当時主流だった抗体産生の鋳型説に対抗して、彼はあらゆる抗原に抗体は先天的にB細胞クローンとして体内にすでに存在しているという抗体産生機構を提案した。当時は相手にされなかったが、現在はその説を疑う者はいない。つまり、「見えていたもの」ではなく、当時の「見えざるもの」を推論する事こそが科学の最も偉大な行為であることを私達は知っている。その仮説の証明法の1つが「計測」であり、この仮説の証明には、敬意を持って計測屋は当たらなければならない。それが「計測屋の品格」であり義務である。
計測研究領域において、計測屋として新規の計測方法を提案し続けることが使命と思っている研究者にとって、科学的に「無謀」と思われていることを手助けする先端的計測法の提案をするためには、その「無謀」な科学的行為が行われる以前にすでに存在もしくは、同時に存在していなければならない。新規計測法を登場させるタイミングの難しさである。早すぎると利用されることもなく忘れ去られるし、遅すぎると代用計測手段がすでにあり相手にされない。現状の「1分子計測学」において、新規な計測手段の基本的な発案は1980〜2000年に提案され尽くされた。また、主要な生体分子に関する静止画としての構造生物学が出揃い始め、その運動の様子が議論され始めた時期と上記時期は重なる。その時期にX線1分子追跡法を提案できたのは運が良かったとしかいいようがない。
2. 可視領域1分子計測法の登場
1分子計測を最初に成功させたのは、企業研究者T. Hirschfeld[3][3] T. Hirschfeld: Appl. Opt. 15 (1976) 2965.である。1976年の成果で、有名な走査型トンネル顕微鏡が考案された1982年[4][4] G. Binning, H. Rohrer, Ch. Gerber and E. Weibel: Phys. Rev. Lett. 4 (1982) 57.の数年前に発表された。実験的には極めて単純で、基板上に吸着した蛍光1分子を検出した。しかし、この方法が生命科学に非常に有効という記述もあり、1分子計測の第1号論文として価値がうかがえる。その頃の私は勿論研究生活に入る前であるが、走査型トンネル顕微鏡が登場した時は、学生の私でも理解できた気がしたので良く覚えている。それほど単純な計測手段であった。その単純さ故、後の爆発的な他分野への利用がなされた。可視領域における1分子計測も同様の事がいえるであろう。
私が計測法の分野に研究の足を踏み入れたのは、1987年の大学院修士課程の時である。幸運にも、屈折蛍光X線法(Refracted X-ray Fluorescence: RXF)を考案し、無機薄膜材料の正確な密度測定や化学特性を測定できる方法として提案した[5][5] Y. C. Sasaki and K. Hirokawa: Appl. Phys. Lett. 58 (13) (1991) 1384.。その後、企業の基礎研究所に職を見つけ、1991年ごろから筑波のPhoton Factory(PF)に通い始めた。当時の指導教官であった鈴木芳生氏の指導下で放射光の素人だった私が、やっと実験に慣れてきた頃に、共同で蛍光X線干渉法(Fluorescent X-ray Interference: FXI)として新計測法を提案し、その関連する仕事はScienceにも受理された[6][6] Y. C. Sasaki, Y. Suzuki and T. Ishibashi: Science 263 (1994) 62.。FXIはナノ領域の層状構造を正確に評価できるもので、秒レベルの分子運動計測も可能であった。ただ、2次元的に平均化した情報のみしか得ることができず、1分子や1原子レベルに進展させるのは不可能に思えた。
当時高速測定をするために、蛍光X線からの回折縞をイメージングプレート(IP)で計測していた(図1)。蛍光X線の光源に使用していた直径数nmの金コロイドからのいつもの美しい干渉縞の中に、なにか明るい斑点が時々見えることに気がついた。IPのゴーストだと思って、初期化して再度数秒露光すると斑点は出なかった。これが偶然結晶性の良かった大きな金コロイドがサンプル内に入っていて、その回折スポットであることに気がつくまでに数カ月かかった。これが1つの金ナノコロイドからの回折だと分かった時は、かなり興奮したのを今でも覚えている。当時、蛍光X線の干渉検出は、色々工夫しても単分子層の感度がやっとであった。以前から目指していたナノレベル1粒子(分子)計測にはほど遠い検出感度で、どうしたら高感度化できるかいつも悩んでいた時期であった。

図1 金ナノコロイドの単層膜から得られた蛍光X線の干渉縞。各1秒間の積算で連続的に3つの干渉縞(T1、T2、T3)をIP上でずらして検出した。θtは蛍光X線の取り出し角。
1つのコロイドからの信号が取れると確認した後、その運動を見れば1つのコロイドからの局部的な構造情報が得られるかもしれないという発想は意外とすんなり思いついた。その後、金ナノ結晶を標識体として使用し、間接的に生体1分子の運動を計測するとういうX線1分子追跡法の新規性と重要性を力説し、当時の科学技術振興事業団(JST)さきがけ研究21に1浪の末に採択され、1998年本格的にこの研究が始まった。X線1分子追跡法のアイデアが固まってから3年後のことである。その後10年程度、優秀な共同研究者の方々や大型予算採択に恵まれ、幾度となく停滞しながら、今日までなんとかX線で1分子レベルの運動計測を可能にする研究を展開してきた。
3. ナノ結晶という新しいトレーサー
X線1分子追跡法の測定名にもした追跡(Tracking、Tracer)という発想はかなり古く、最初の提案は放射性トレーサー法である。人工ラジオアイソトープをトレーサーに利用したG. HevesyとO. Chiewitzの論文は有名である[7][7] O. Chiewitz and G. D. Hevesy: Nature 136 (1935) 754.。通常、非放射性元素であったリンを放射性32Pとして自作製造し、生物系への利用法を示した研究は核医学研究の方向を決定的にした。その後すぐに放射性ヨウ素128I等の利用も始まった。それよりも10年も前にトレーサーの実験をした研究者がいた。核医学の父と呼ばれるH. Blumgartである。彼はラジウムを使って心不全の患者の病状を計測しようとした。トレーサーの持つべき特徴に関する彼の当時の議論は、現在の研究においても正論である。
(1)身体内に存在しない物質
(2)検査対象になる現象に影響を及ぼさない物質
(3)極微量でも検出可能な物質
(4)身体内から適当な速さで無くなっていく物質
昨今放射性トレーサーは、その放射性という特性から利用数は年々激減している。それに代わって現在標識トレーサーと言えば、高感度な蛍光分子や量子ドットが主流となっている。特に、高輝度の蛍光分子(Green Fluorescent Protein: GFP)の発見が当時プリンストン大学に在籍していた日本人O. Shimomuraであったことは私達に勇気を与えてくれた[8][8] O. Shimomura, F. H. Johnson and Y. Saiga: J. Cell. Comp. Physiol. 59 (1962) 223.。1962年発光生物学の研究過程で、発光クラゲであるオワンクラゲからイクオリンとGFPなる発光分子を発見した。最近のインタビューでも、「双子の兄弟をこの世に生み出したが、弟の方が驚くほどに有名になってしまって、親としては驚いている」と、現在、生命科学の分野において欠くことのできないまでに普及したGFP分子(息子)を懐かしんでおられた。このGFPに代表される蛍光分子も、先に述べた放射性トレーサーの4つの特徴を見事に兼ね備えている。現在、数限りない蛍光分子が考案され使用され販売されている。丁度それは1920〜1940年代に多くの人工ラジオトレーサーが登場した時代と類似する。歴史は繰り返すとはこのことかもしれない。
私が提案した第3のトレーサーはナノ結晶という大きさ20 nm程度の結晶体である。上記トレーサーの特徴を検討してみると、(1)に関してはほぼ合格といえる。勿論、2次元最密膜としては紫膜(バクテリオロドプシン2次元膜)のような結晶膜は存在するが例外的である。最近、たんぱく質分子やDNAの通常の立体構造から外れた時の凝集過程が色々な疾病に関係しているという研究がなされている。しかし、それほど良質な結晶状態ではない。凝集という過程を良質でない結晶状態として評価、もしくは計測することは今後面白い展開になるかもしれない。(2)に関しては微妙である。ナノ結晶は動きを見たい生体分子に化学的に標識するのだが、標識する部位や標識方法によってその分子の持つ活性を損なう場合がある。標識後に活性が失われていないかどうかの検証をしなければならないという予備実験が必要となる。今後、影響が全くでない標識法(極端には無標識)の検討は重要な課題である。また、ナノ結晶の大きさをできるだけ小さくする研究は今後期待できる。それはナノサイズの完全結晶研究やX線検出系研究が必要ということである。(3)においては、ナノ結晶はそもそも、その存在やその結晶方位を検出することを目的として標識するのであるが、その検出感度は第三世代放射光施設を利用するのであれば十分にミリ秒の測定で1粒子検出が可能である。理想的にはラボレベルのX線光源や小型放射光施設を利用した高速1粒子検出の実現が期待される。また、他のプローブとして有効な電子線においても20 nm以下の大きさのナノ結晶で検出が十分可能であることは最近私達が確認した。(4)は本計測法を生体内計測(in vivo計測)へと発展させるまでの宿題となっている。多くの生命現象には未知な因子が多く存在する。ある1つの生命現象を研究対象にした場合でも、関連する分子の同定がすべて終了している系はほとんどない。in vitro計測とin vivo計測の違いはまだ本質的な違いを秘めている。
4. X線1分子追跡法の原理
1分子内の特定部位の運動が原子オーダー以下の精度で実時間計測できれば、機能性生体分子の機能発現に伴う極めて微小な構造変化情報が得られる。この精度を達成するためにX線を利用する。しかし、多くの研究者は、“X線を用いて1分子を検出できるのか?”という疑問を持つ。それは、物質と電磁波との散乱断面積の大きさは、波長に比例するという常識からだ。可視領域において行われているように、発光、吸収、散乱現象を用いて1分子を直接的に検出することはX線領域では、第三世代大型放射光施設を用いて、かつ数時間の積算をしたとしても難しいことは計算すると明らかである。私はX線の物理現象で一番高感度な現象、X線回折を利用する時分割回折X線追跡法(Diffracted X-ray Tracking: DXT)が1分子検出の可能性があると考えた。
X線1分子計測法のアイデアは単純である(図2)[9-12][9] Y. C. Sasaki, M. Ishibashi, M. Yanagihara, K. Toyota, A. Adachi, Y. Suzuki and N. Yagi: Phys. Rev. E. 62 (2000) 3843.
[10] Y. C. Sasaki, Y. Okumura, S. Adachi, Y. Suzuki and N. Yagi: Nucl. Instrum. Methods A. 1049 (2001) 467-468.
[11] Y. C. Sasaki, Y. Okumura, S. Adachi and N. Yagi: Phys. Rev. Lett. 87 (2001) 248102.
[12] Y. C. Sasaki: Biochemical Society Transactions Volume32, part5 (2004) 76.。直径20 nm程度の極微ナノ結晶をタンパク質分子にその機能を損なわないように標識する。そして、極微ナノ結晶からのラウエ斑点を指標に、着目したタンパク質分子の動きを時分割(µs〜ms程度)追跡する。図2には、目的1分子ユニットの一部に構造変化があると、その部位に標識されているナノ結晶がその構造変化と同期して変位し、ナノ結晶からのラウエ回折斑点の方向を変化させるという例を示している。ここで注意しなければならないのは、検出しているのは標識されたナノ結晶の回転方位であり、分子自身の方位や並進運動ではない。従って、ここでは、ナノ結晶の運動とナノ結晶が標識された目的分子内の部位(被標識部位)が同様の運動をしているということが大前提となる。これは、ナノ結晶と被標識部位の距離、結合状態に依存すると予想された。現在まで、比較的広い条件下でこの前提は成立していることが分かってきた。
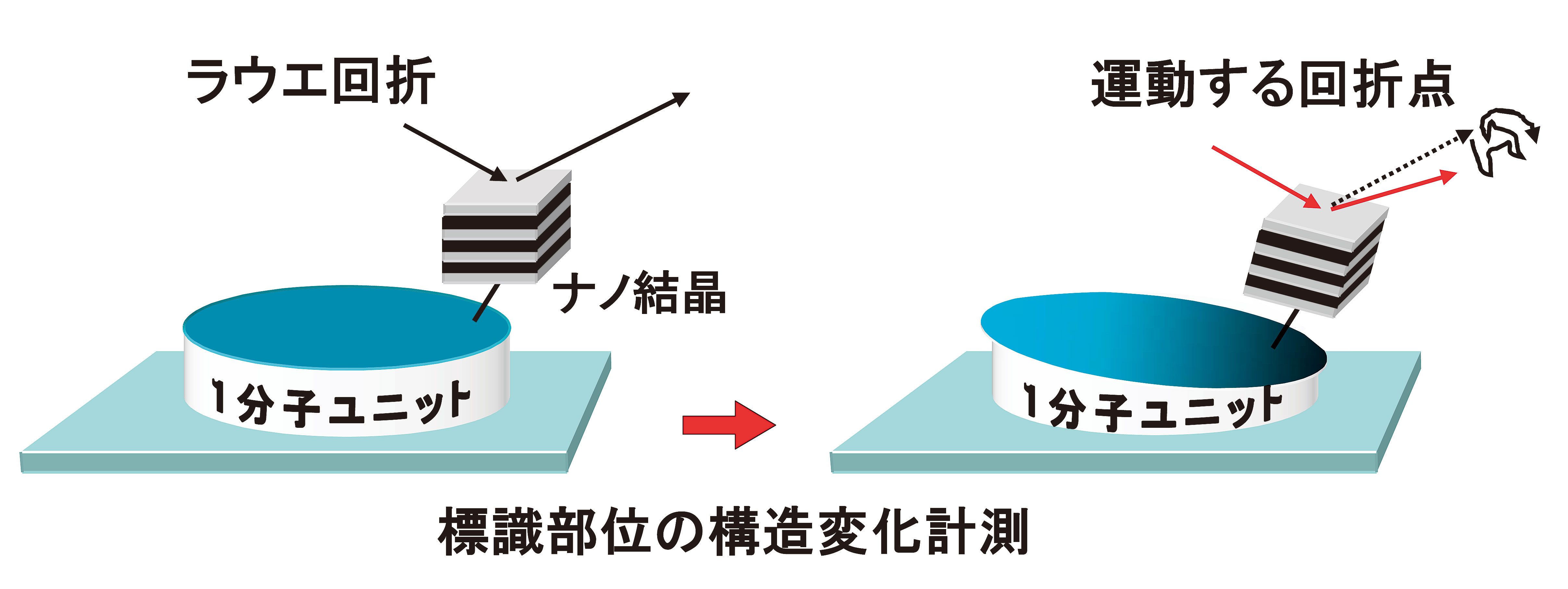
図2 X線1分子追跡法の原理図。1分子ユニットは通常10〜20 nmと大きい。標識するナノ結晶の大きさは20〜30 nm。
以上のように、ここで議論するX線1分子計測法は、直接的に1分子の動きをX線検出する方法ではない。最近議論されている自由電子レーザー等の次世代大型放射光施設を用いた1分子構造解析とは異質のものである。しかし、このような研究方向は、X線だけではなく電子線の単粒子解析法[13][13] T. Nakagawa, Y. Cheng, E. Ramm, M. Sheng and T. Walz: Nature 433 (2005) 545.やNMRの1分子バージョンともいえる磁気共鳴力顕微鏡(Magnetic Resonance Force Microscopy: MRFM)の目指す1分子構造決定法[14][14] H. J. Mamin, R. Budakian, B. W. Chui and D. Rugar: Phys. Rev. Lett. 91 (2003) 207604/1.、それに計算科学が推し進める1分子構造予想の流れを見ても必然的であり、ある意味ではX線分野はまだ遅れていたといってよい。
X線1分子追跡法がpmの精度を達成することができる理由を図3で単純化して説明する。この機能性生体分子は、筋肉系の主要タンパク質分子の一部分であるミオシン頭部は、長さ10 nmのレバーアームと呼ばれる部位が反応分子(ここではATP(アデノシン三リン酸))と反応した瞬間に、どのような運動をするかが何十年にも渡って議論されてきた。このレバーアームは構造生物学的にいうと、αヘリックス構造をしているので剛体的な挙動を示すことが予想されていた。DXTにおいて現状並進運動は全く検出することはできないが、回転運動に関しては検出カメラとサンプル間の距離(カメラ長)に依存するが、0.1 mradレベルを検出することは十分可能である。レバーアームの運動を根元の部位付近を中心とした単純な回転運動と仮定すると、幾何学的に末端部分の回転が10 mrad動いたとするならば、並進的に0.1 nm移動したことに対応する。つまり、0.1 mradレベルの検出は、pm(nm/1000)に対応する検出が可能となる。
DXTの特長にまだ先があったことは、実験を進める上で初めて認識できた。通常図3のような変換された運動解釈が成立したとしても、計測システムとして大きなノイズに隠されてしまうことが多いが、DXTは回転運動を高精度計測できる点にその驚異的精度実現の理由がある。高精度走査顕微鏡の代表例として走査型トンネル顕微鏡(STM)があるが、あの0.1 nmレベルの精度を実現するためには、除振台の設置が発明当時から非常に重要であった。STMの測定は振動に非常に敏感なため、バネなどによって地面から直接震動が伝わらないように設計された。当初、開発者のG. Binningらは測定部を超伝導磁気浮上させていたが、冷却のため1時間に20リットルもの液体ヘリウムを必要とする事からこれを改め、2段釣りのバネ機構と渦電流方式の永久磁石の振動減衰装置を用いるようになった。現在はよりコンパクトな除振システムとなっているが、除振システムの世界最高精度でもpmレベルの除振は現在でも不可能である。それが直接的な並進運動検出の障害の1つとなっている。DXTは回転運動なので並進的な除振は必要ない。この特性は装置構成を考える上で、極めて特長的で装置的な応用範囲も極めて広くなると考えている。

図3 ミオシン分子を基板に固定して、レバーアームと呼ばれる10 nmの長さで比較的剛体的な部位の挙動を見る場合に、X線1分子追跡法がどこまでの計測精度があるかを示す。
しかしDXTを成功させるためにも必要な技術はあった。生体1分子ユニットのソフトな基板固定法や1分子に対して1ナノ結晶を1対1に標識する方法、または良質のナノ結晶作製技術である。水溶液中を拡散、ブラウン運動している分子にナノ結晶を標識しても、現在の放射光の強度ではナノ結晶からのX線回折斑点を実時間(最低ビデオレイト速度で)測定することは不可能である。従って、X線を非常に良く透過する石英基板(通常利用するのは厚さ70 µm)の上に生体分子をソフトに化学固定する必要があった。固定法はいくつかの方法を考案した[15,16][15] Y. C. Sasaki, K. Yasuda, Y. Suzuki, T. Ishibashi, I. Satoh, Y. Fujiki and S. Ishiwata: Biophys. J. 72 (1997) 1842.
[16] Y. Harada, K. Yasuda, S. Nomura, N. Kajimura and Y. C. Sasaki: Langmuir 14 (7) (1998) 1829.。典型的な例を先のミオシン分子の基板固定で説明する(図4)。この場合、末端部分(N末端やC末端)に活性なSH基やHis-tag基などを遺伝子導入する方法を利用した。His-tag基の導入は、変異体を精製する過程で最近頻繁に利用されているので、特別な変異体の作製を必要としない。問題はSH基の導入である。変異体導入されたSH基は一般に活性が高く、他の同一分子とSS結合を作ってしまうので、DTT等の酸化防止剤を共存させて試料保存しなければならない。ただし、基板と変異体を反応する際は、これらの酸化防止剤自身が優先的に基板表面と反応する場合が多いので、サンプル溶液から分子除去などを反応直前に行わなければならない。
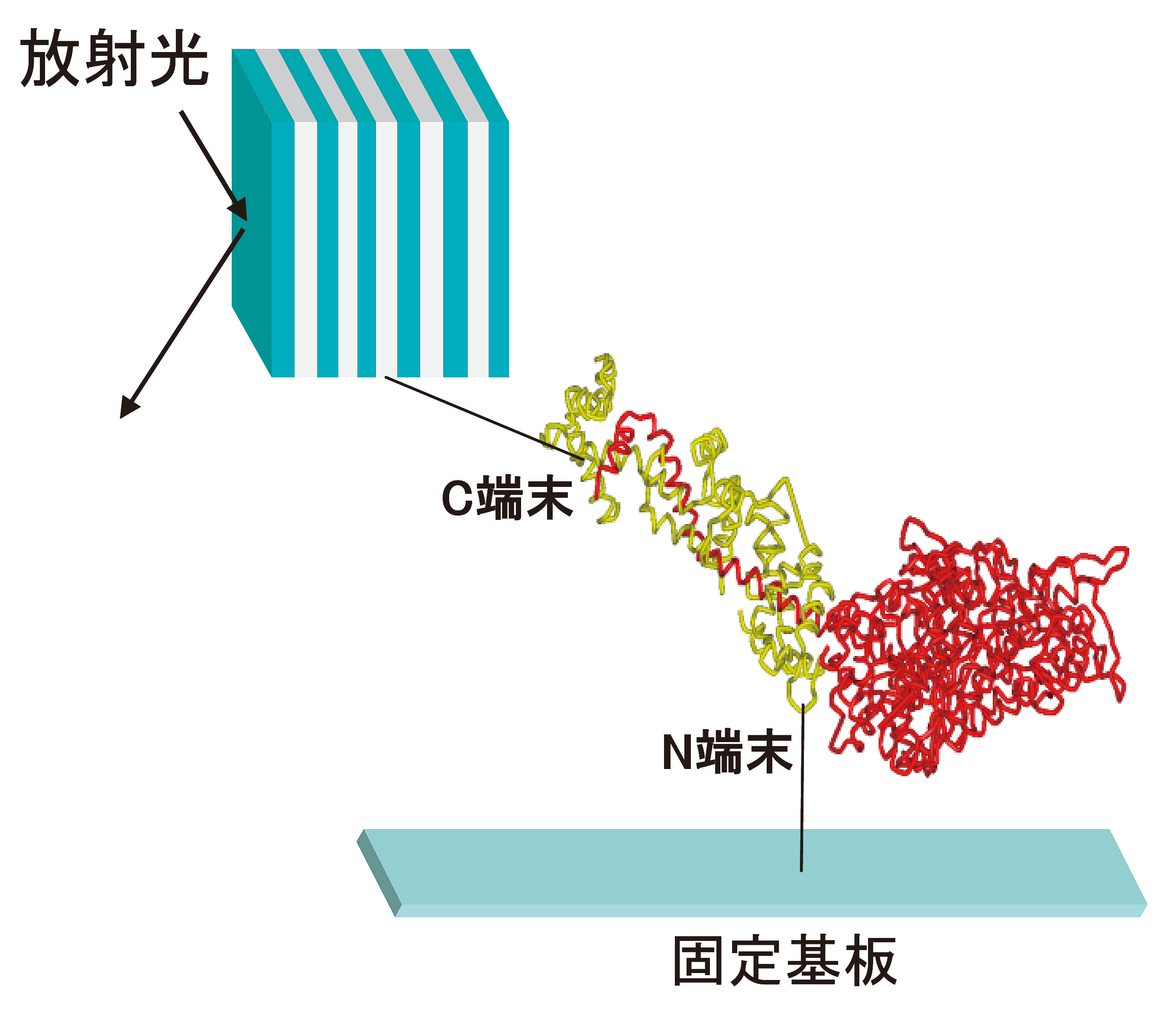
図4 ミオシン分子を基板固定して測定した例。N端末を基板に固定し、C端末をナノ結晶と反応させた。この状態においても分子の機能は保持されていることを別実験で確認することは重要である。
正確な生体分子の基板への配向性を必要としない系の場合は、二価性試薬を用いて生体分子内の活性なアミノ基など(非特異的固定)を介して基板固定する場合もある[17][17] T. Sagawa, T. Azuma and Y. C. Sasaki: Biochem. Biophy. Res. Commun. 335 (2007) 770.。基板固定で注意する点は、目的分子と基板表面の間を直接接触させない程度に基板修飾分子で空間を空けることである。直接結合させることでタンパク質分子自身の構造に歪みが入り、保持する機能が劣化することが多く報告されている。しかし、空けすぎると極端ないい方をすれば、水溶液中に存在している時の自由運動と同様の運動となり計測不可能となってしまう。上記空間は目的分子や固定する残基位置に依存して異なる。またここで注意する点は、この固定法がX線1分子計測法の必須条件ではないという点である。検出されるX線回折斑点の感度が向上すれば、より高速の計測が可能となり、水溶液中を浮遊している分子の分子内運動も計測できる。
図4にあるように理想的には目的1分子に標識されるのはナノ結晶1つでなければならない。それも目的分子中の1つのサイトを介してである。本研究で用いているナノ結晶は金結晶であり、金はX線回折の検出感度が高いばかりではなく、金表面とSH基との共有結合が有効に利用できる。金表面は無数の活性サイトを持っているので、複数のシステインとの反応が進むことが容易に予想される。現状は、金表面の汚れのためにそれほど多くの活性サイトを金ナノ結晶表面に考えなくてもよいらしく、将来的には活性表面をこちらが指定した表面電荷になるように金表面化学修飾を施して、完全に1つの反応分子のみを金ナノ結晶表面に修飾することを目指している。
最近多く利用され始めた極めて高効率に蛍光発光する量子ドット[18][18] J. K. Jaiswal, H. Mattoussi, J. M. Mauro and S. M. Simon: Nature Biotech. 21 (2003) 47.の表面修飾法は非常に参考になる。元々ナノサイズの粒子は、表面イオンによる反発で水溶液中になんとか分散状態で保持できていた。しかし、イオン強度の高い生体環境下では、容易に凝集し沈殿してしまう現象が以前より知られていた。そこで多くの研究者が行ったのは、非特異的吸着が少なく生体環境下においても分散状態を長時間保持できる表面処理法を探すことであった。結果的にヘテロ2官能性ポリエチレングリコールをナノ粒子の表面処理剤に用いることで、反応性を持った安定なナノドットを得ることができた(図5)。ここで取り扱っている量子ドットは直径5〜10 nm程度の粒子で、その外側の表面処理に用いたポリマーの長さは、4〜8 nm程度である。従って処理後のナノドットの大きさは、処理前の大きさに比べて倍近くに大きくなる。
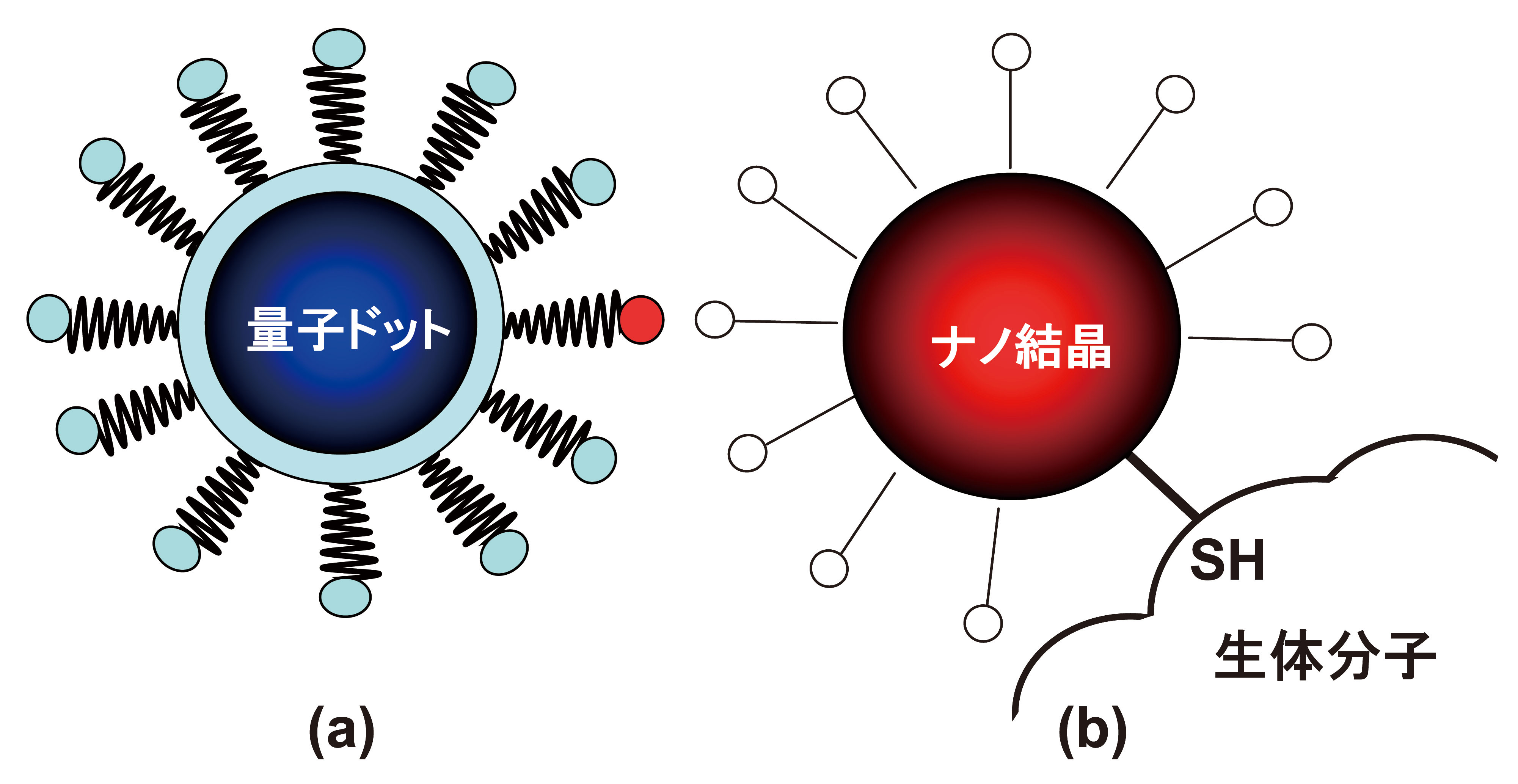
図5 (a) 一般的量子ドットの構造。反応サイトを右側の1つのサイトに設定することも可能となっている、(b) ナノ結晶は生体分子に標識される模式。金表面と生体分子の持つSH基は直接的に共有結合する。ただ、ナノ結晶の本体には疎水特性が残っているので問題になる場合がある。
この処理をX線1分子計測法で利用すると問題が起こるかもしれない。現在検討中であるが、X線1分子計測法で以前ポリマーの動的挙動を実験した際には[9][9] Y. C. Sasaki, M. Ishibashi, M. Yanagihara, K. Toyota, A. Adachi, Y. Suzuki and N. Yagi: Phys. Rev. E. 62 (2000) 3843.、その動的な挙動が確認される。つまり、ポリマー層を目的生体分子とナノ結晶の間に挿入することになり、ポリマーの動的挙動を付加した情報がX線1分子計測で得られる。現在、より短いポリマーで分散特性が維持できないかを検討しているが、極めて短くして(例えば数nm)分散性が残るのであれば、この有効な表面処理工程を利用できるかもしれない。この処理が可能になれば、ナノ結晶に目的生体分子を1つの結合サイトで反応させる処理法の確立も可能性が出てくる。
目的生体分子へのラベル反応は極めて単純である。現段階では、安定的に水溶液中に存在するナノ結晶と基板上に固定された生体分子を2〜10時間程度5〜10°C程度でインキュベーションし、その後、バッファーでソフトにかつ何度もよく洗い流すという単純なプロトコルにしている。この際注意する点は、洗い流すのであって洗い溶液を基板にたたきつけるように洗浄してはならない。比較的ソフトに基板固定しているためか、簡単に剥離することが確認されている。
5. 結晶の方位情報のみ着目したブラッグ反射利用
DXTはブラッグ反射の応用である。従って、2dsinθ = nλが基本となる。通常の認識と異なる点は、通常変数と考えられていなかったθをθ(t)と考え、d値の決定を目的として上式を利用しなかった点である。dを既知なる値とし、λをdの決定のためではなく、回折現象を確認するための領域設定のみに利用した。1分子計測は1分子の存在はもとより、特定時間内の運動追跡が主な目的となる。ブラッグ反射を利用物理現象としているのでλの値に領域が必要となる。本研究立ち上げ当初は、SPring-8/BL44B2を利用していたので、7〜30 keVという波長領域を確保できた。放射光を光源とする場合、白色光特性を持っている放射光を利用することは、極めて有効であるが現実はそうではない。X線回折現象を利用する場合は通常、最終目標がd値の決定であるから、正確なλの値と複数の正確なθの値が必要になり、それは単色化という技術を進展させた。この研究方向は放射光(X線)技術に限ったことではなく、レーザーや電子顕微鏡関連技術においても、集光技術やコヒーレント光利用と絡んで単色化技術は大きく進展した。
この研究方向に逆らう本法は、新規であるという表現もできるが、この単色化技術も取り込む進展をすべきかもしれない。例えば、ナノ空間内にd値に幅のある粒子を作製する。それは均一的なdスペースを持つ結晶とは異なった「傾斜結晶」のような概念となるのかもしれない。「複合結晶」ともいえる。類似の技術はすでにあり、傾斜結晶の技術を確立した方が、多くの単色化した放射光ビームラインを利用できる利点がある。また、今後台頭してくるX線自由電子レーザー(XFEL)の利用も含めて、「ナノ傾斜結晶」の体系的実現を早期に果たしたい。
現在、多くの高輝度な蛍光分子が開発利用されている。また、先述したが1920〜40年代に多くの人工放射性トレーサーが開発されたように、ナノ結晶が新しい高エネルギープローブ(X線、電子線、中性子線等)トレーサーとして、微小方位の検出のために、色々なdスペースや、複数のdスペースの混合したナノ結晶体が利用可能となれば、多くの研究領域においてDXTが応用される可能性がある。また、現時点ではサンプル系に影響するかもしれないというナノ結晶自身の大きさに関しても、そのナノ結晶自身の形状を制御することにより、意外な利用法の可能性もあるのではないかと現在形状制御の観点から作製法を再検討しているところである[19-21][19] Y. Okumura, Y. Taniguchi and Y. C. Sasaki: J. Appl. Phys. 92 (2002) 7469.
[20] Y. Okumura, T. Miyazaki, Y. Taniguchi and Y. C. Sasaki: Thin Solid Film 471 (2005) 91.
[21] Y. C. Sasaki, T. Higurashi, T. Miyazaki, Y. Okumura and N. Oishi: Appl. Phys. Lett. 89 (2006) 053121.。
6. 機能性生体分子運動計測
実験装置配置を示す(図6)。DXTは特定の領域内のブラッグ反射すべてにおいて回折斑点を検出できなければ、生体分子に標識された金ナノ結晶の運動を連続検出できないので、連続波長帯を持った白色X線が必要となる。従って、白色でかつ集光能力を持った大型放射光施設SPring-8/BL44B2にて実験を行った。本来白色特性というのは放射光光源の特徴であるから、白色を利用する実験方法は正に放射光でなければ実験できない方法論である。データーは、数msレベルのパルスX線光源を使用して、ビデオレイト程度で1〜2秒間計測する。検出系は、X線を可視蛍光に変換するX線イメージングインテンシファイヤーV5445Pを使用した。可視蛍光はCCDカメラにて検出。この検出システムがビデオレイトのリアルタイム計測を可能にした。

図6 X線1分子追跡法の装置配置図(SPring-8/BL44B2の場合)。
サンプルの断面構造を図7に示す。厚さ約7〜10 µmの水溶液層を挟んで片側をX線透過フィルムで封をしている。フィルムは、耐放射性の高いポリイミドフィルムを使用した。このポリイミドフィルムは比較的薄膜が均一でフィルム表面を清浄化しやすい。基板側は両面研磨した石英基板(厚さ40〜70 µm)を用いた。石英基板自身に化学修飾をして生体分子を吸着させることもあるが、金を蒸着して基板として使用することが多い。この場合の金は、アモルファス状態なのでX線の回折スポットを発生しない。サンプルの温度制御は可能で通常0〜5°C設定下で行われた。1秒間の照射実験を何度も繰り返し、各運動を統計処理して既知のブラウン運動と比較検討を行うのが基本的なデーター収集法である。
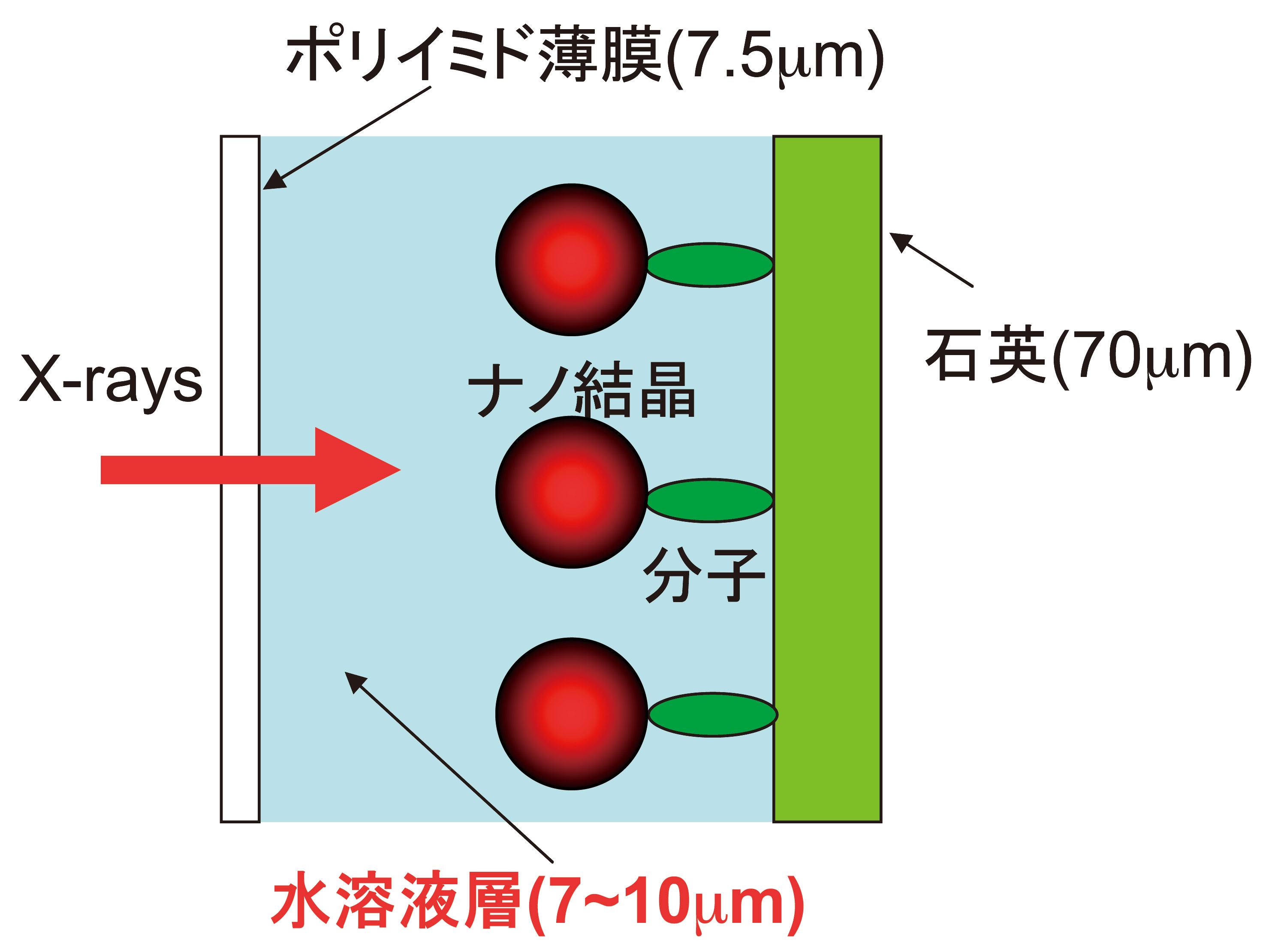
図7 X線1分子追跡法で用いられる典型的なサンプル断面図。ポリイミド薄膜や薄膜石英基板を使用するのは、できるだけX線の散乱強度を軽減させるためである。
DXTの最終目標は、生理条件化で機能発現している状態での計測である。つまりin vivo1分子計測を実現するために、よりin vivoに近い状態で機能性タンパク質分子の機能発現に伴う1分子動的挙動計測を主に試みている。機能性タンパク質分子の中で、極めて魅力的なのは細胞の内側と外側の調製機能として極めて重要な役目を担っている膜タンパク質分子である。現在市販されている多くの臨床的薬剤の30%以上は、この機能性膜たんぱく質分子に対応するための分子であり、最近解明された生物系全ゲノムの50%程度はこの膜系に関連した情報を保持していることが明らかになった。
最近までの主なサンプル系を図8に示す。先の例にも述べたDNA分子にミオシン分子、そしてアクチン繊維に、タンパク質のフォールデングに関係するGroEL/ES分子系、実際に生体分子の構造を変性させた(アンフォールド状態)ミクログロブリン、蛍光分子であるGFPも計測対象になった。先の膜たんぱく質系においては、バクテリオロドプシン(Bacteriorhodpsin:bR)[22][22] Y. Okumura, T. Oka, M. Kataoka, Y. Taniguchi and Y. C. Sasaki: Phys. Rev. E. 70 (2004) 021917.やチャネル分子の代表的な例であるカリウムチャネル分子(KcsA)[23,24][23] M. Iwamoto, H. Shimizu, F. Inoue, T. Konno, Y. C. Sasaki and S. Oiki: J. Biol. Chem. 281 (38) (2006) 28379.
[24] H. Shimizu, M. Iwamoto, F. Inoue, T. Konno, Y. C. Sasaki and S. Oiki: Cell 132 (2008) 67.も測定を行った。詳細な結果はここでは触れないが、極めて興味ある実験結果がいずれの計測においても得られている。
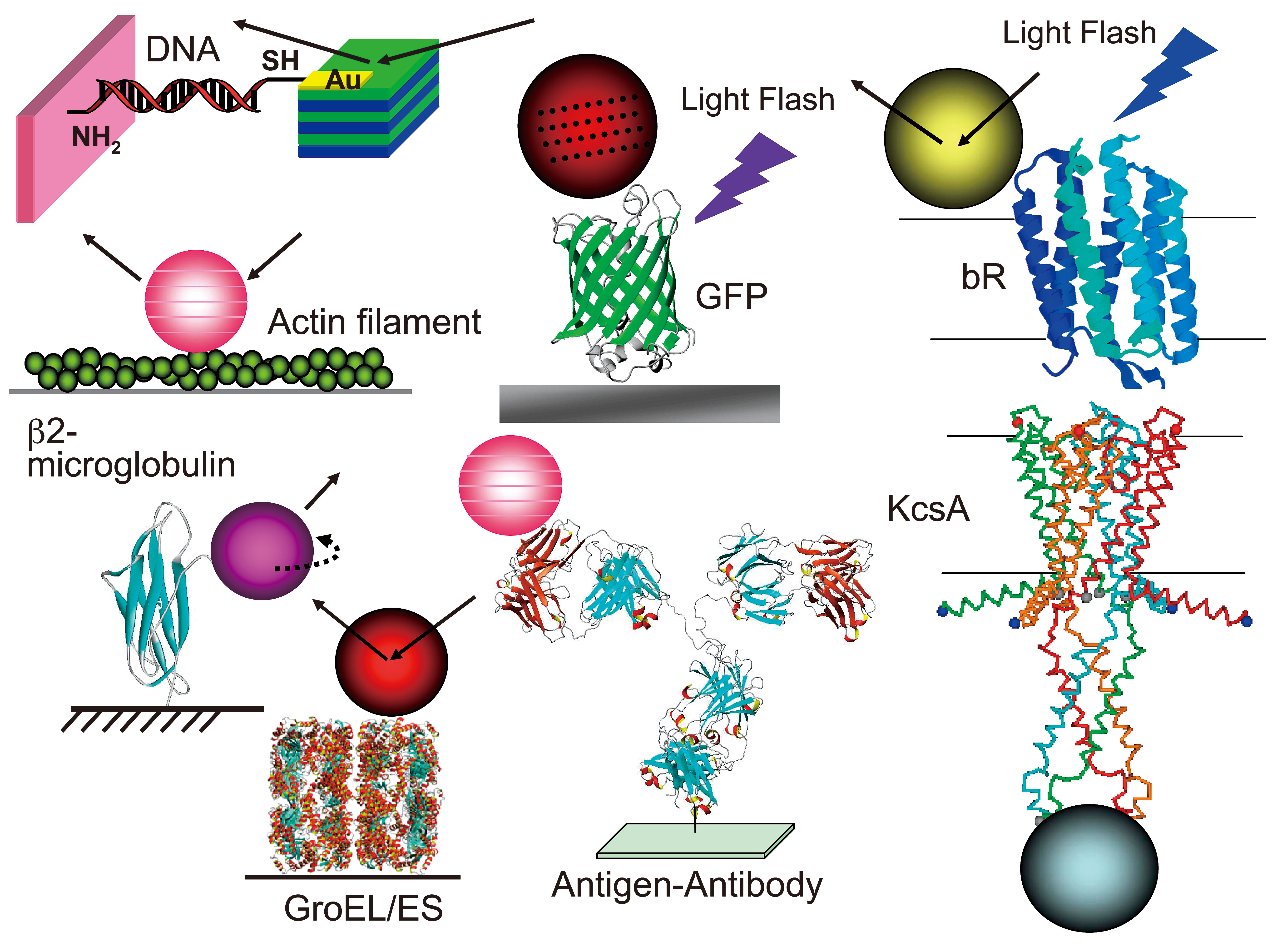
図8 DXTの今までのサンプル系。DNA、可溶性タンパク質分子、膜タンパク質分子、光励起型タンパク質分子など、分子内構造変化が注目されている分子はほとんど測定可能である。
特にカリウムチャネル分子に関しては、現状の研究展開の中で1分子計測がどのような意味を持つかを説明する。チャネル分子の一種であるカリウムチャネル分子は、カリウムイオン(K+)だけを選択的に通す分子で、これはバクテリアからヒトの細胞に至るまで広く存在する。すなわち、進化の初期から数十億年にもわたって生物が使い続けてきたカリウムチャネルは、生物にとって最も基本的なたんぱく質分子の一つと考えてよい。「カリウムチャネル分子がどのような形を持った分子で、イオンを通す穴はどのような構造か、またその穴を開閉するのはどのような機構か?」これがカリウムチャネルという優れたナノマシーンを解明するための最も本質的な課題であった。この課題に向かって長年多くの研究が積み重ねられてきたが、この中で2つの大きなブレイクスルーが現在まであった。第一のブレイクスルーはチャネル分子の電気特性を1分子ごとに観察することができるようになった技術の登場であった[25][25] B. Sakmann and E. Neher: Ann. Rev. Physiol. 46 (1984) 455.。そして、第2のブレイクスルーはカリウムチャネル分子の立体構造の決定[26][26] D. A. Doyle, J. C. Morais, R. A. Pfuetzner, A. Kuo, J. M. Gulbis, S. L. Cohen, B. T. Chait and R. Mackinnon: Science 280 (1998) 69.。この構造決定以来、チャネル研究は分子機能改変の戦略が立てやすくなり、世界中で研究が加速した。このような状況下において、1分子が動く様子を高精度に実時間で測定できる本法を用いて、「チャネル分子が静止している状態で得られた立体構造、つまりスナップ写真」ではなく、「分子が働いている正にその状態、すなわちチャネル分子が働くために構造を変化させつつあるその現場を捉えたビデオ映像」を得ることにより、沢山のチャネル分子からの平均的な情報では得ることができなかった、1分子のチャネルの構造が変わりつつある現場を捉えるという戦略を設定した。これは究極的な計測であり、これを実現する安定な計測手段が現状で本法しかなかった点は非常に幸運であった。
結果的に予想よりもかなり大きな運動が1分子計測された。本計測の次の研究ステップを考えるならば、この大きな開閉運動の制御の可能性がでてきたことである。すでに予備実験を検討しているが分子内部の詳細な運動計測の後に、運動制御へと研究が進んでいくことは極めて自然な流れである。「1分子機能制御技術」が出そろうのも時間の問題かもしれない。
7. 得られた新しい情報の信頼性と問題点
X線1分子追跡法によって新たに加えられた情報とは、実時間分子内運動である。可視領域の波長プローブを用いた1分子計測法の例外的な成功例を別にすれば、タンパク質分子系において、分子内部の運動をリアルタイムで計測に成功した例はほとんどない。今までは、各状態において結晶化により得られた構造情報を継ぎ接ぎして、連続的な運動部分を抽出してきた。非常に巧妙に各状態を揃え、その状態においておのおの結晶化を数十種類行って、それらの構造情報から変化分のみを取り出してきた。勿論、各状態を揃えることのできるタンパク質分子系はごく僅かである。光励起により分子内構造変化に関する系は、励起光をトリガーとして各状態を一斉に揃えることができるが、通常の分子はそのトリガー自身存在しない。また、前述の継ぎ接ぎ実験が仮に上手に行えたとしても、各結晶化から得られた構造変化情報があまりに大きな運動を示唆した場合、その変化前後の結晶情報を結ぶ運動(補間される運動情報)は無限大に存在する。つまり、多くのタンパク質分子において、分子内運動を精確に計測するためには、1分子ごとに独立に測定し、その測定精度はÅ以下の精度でなければ、非常に小さい運動によって機能発現していると考えられている機能性生体高分子の構造変化を有益に計測することは難しい。上記必要性を満たしているのは、X線1分子追跡法と可視域の特殊な1分子計測法のみである[27][27] S. Weiss: Science 283 (1999) 1676.。
X線1分子追跡法の現状における物足りなさはその情報量であろう。今のところ、分子内部の数点の構造変化を追跡する例しか行っていない。それは測定する分子の運動に関して、すでに注目されている部位が明確で、安定な構造情報がすでに存在している系のみを計測対象にしているからである。動的構造情報と考えると俄然情報量が足りなく感じることは明確で、またナノ結晶の大きさが邪魔をして、分子内部のある部位の構造変化を追うことは難しい。それを可能にする2、3のアイデアはあるので、今後の研究展開を見ていただきたい[28][28] 佐々木裕次:日本結晶学会誌 47 (2005) 354.。
ナノ結晶の大きさに関しては、その分子運動への影響は無視できない。現在使用しているナノ結晶がもし完全結晶であるならば、直径15〜20 nm以下のナノ結晶をミリ秒検出することは現状の放射光強度では難しい。今後、検出系の高感度化や信号検出環境の改善等は進めなければならない。
大きさの影響を考慮する上で、ナノ結晶の大きさを若干大きくして分子の運動を計測してみることはできる。通常、直径20〜30 nmで使用しているナノ結晶を40〜50 nmもしくは60〜80 nm等と大きくして、各分子内運動を独立に計測した。結果的にはほとんど計測された運動の大きさに影響は認められなかった。これらのナノ結晶の大きさ以上に大きくすると、ナノ結晶とタンパク質分子を固定している基板との相互作用や、目的タンパク質分子1つに対して1つの結晶という比率が狂ってしまう可能性があり[21][21] Y. C. Sasaki, T. Higurashi, T. Miyazaki, Y. Okumura and N. Oishi: Appl. Phys. Lett. 89 (2006) 053121.、これ以上の大きさの実験は不可能となる。
例えば他の1分子計測において、標識プローブの大きさが4 µmから40 nmまで変化させた時に、分子の大きな回転運動がどの程度変化するかを計測した例がある[29,30][29] H. Noji, R. Yasuda, K. Kinosita Jr. and M. Yoshida: Nature 386 (1997) 299.
[30] R. Yasuda, H. Noji, K. Kinosita Jr. and M. Yoshida: Cell 93 (1998) 1117.。この実験結果では、確かにµオーダーの標識の際は、小さくすればするほどその検出された回転運動の速度は大きくなったが、60〜70 nmや40〜50 nmサイズの標識になった場合は、ほとんど変わらないという結果が得られている。X線1分子追跡法の標識はそれ以下の大きさであるから、その影響を今後詳細に評価する予定であるが、深刻な影響は少ないと予想している。
標識した場合としない場合との分子運動の差を定量的に予測することは可能である[31][31] Y. Kawashima, Y. C. Sasaki, Y. Sugita, T. Yoda and Y. Okamoto: Molecular Simulation Volume33 Issue1 & 2 (2007) 97.。図9はその比較をした計算モデルである。この比較シミュレーションによって、観察対象分子が基板に固定された影響とナノ結晶の標識に関する影響を定量解析できる。その結果、本計算のモデルとなった分子の運動は、室温においてはほとんど影響がなかったが、高温(60〜80度以上程度)になると、標識及び固定された分子の運動は極めて抑制されることが分かった。

図9 基板固定とナノ結晶標識の影響評価のためのモデル図
8. 今後の高エネルギープローブを用いた1分子計測の行方
考えてみると私の研究歴は、ダイナミックな表面分析に興味を持って研究室に配属になった大学4年生から、赤外分光法、電子線励起、X線表面解析、ラジオアイソトープ、中性子、そして放射光と、多くの波長をひたすら短い波長方向へと進展させてきた。その前後の時だったと思うが先輩からM. Born & E. WolfのPrinciples of Opticsを読めと助言された。図書館で立ち読みしてみるとX線の“X”の字はなく、可視領域の話ばかりであった。だまされたと思い読まないでいると「読んだか?」と聞かれ随分怒られた記憶がある。その助言の意味が最近になってようやく理解できた。「波長は財産である」という賢者の教えと重なって、現在まで可視域という波長領域の研究が飛び抜けて進展はしているが、元をただせばすべて同じ電磁波なのである。可視で起こったことは、工夫なく検出できるかどうかは別にして間違いなくX線でも起こっている。現在まで可視領域の1分子計測がこの1分子研究領域を活性化し加速してきた。「波長は財産である」という言葉の意味を改めて噛みしめると、今後高エネルギープローブを用いた1分子計測研究は、可視域の研究成果の物まねでも当分の間は仕事ができそうともいえる。ただそこで重要な事は、短波長ゆえの特性をどのように計測手段の特徴として発揮できるかであり、そこが放射光研究者の知恵の見せ所となる。
謝辞
本研究は、その初期段階(平成10年)を科学技術振興事業団(JST)個人研究推進事業さきがけ研究21(研究総括:大嶋泰治氏)の研究助成により推進された。また、平成13年度から、同事業団JST/CREST研究領域“たんぱく質の構造・機能と発現メカニズム”(研究総括:大島泰郎氏)における研究課題「X線1分子計測からのin vivo蛋白質動的構造/機能解析」(研究代表者:佐々木裕次)において5年間の研究助成をいただいた。またその後も、平成18年度から新たにJST/CREST(研究領域“生命現象の解明と応用に資する新しい計測分析基盤技術”(研究総括 柳田敏雄氏)における研究課題「高精度1分子内動画計測から見える生体分子構造認識プロセス」(研究代表 佐々木裕次)の研究が現在行われている(平成24年終了)。X線1分子追跡法に関しては幸い平成18年から5年間、SPring-8戦略的重点研究課題の指定を受けることもできた。
JST予算の総括である大嶋泰治氏、大島泰郎氏、柳田敏雄氏を初め、JST/CREST研究事務所の方々には日頃より大変お世話になった。厚く御礼申し上げる。また本研究推進にあたり、高田昌樹氏、植木龍夫氏、八木直人氏、鈴木芳生氏、足立伸一氏、谷口彬雄氏、奥村泰章氏、岡俊彦氏、井上勝晶氏、宮崎拓也氏、日暮高志氏、岡本祐幸氏、川島雪生氏、大石昇氏、須田斎氏、片岡幹雄氏、老木成稔氏、清水啓史氏、岩本真幸氏、石川晃氏にこの場をお借りして感謝したい。
参考文献
[1] A. D. Hershey and M. Chase: J. Gen. Physiol. 36 (1952) 39.
[2] J. D. Watson and F. H. Crick: Nature 171 (1953) 737.
[3] T. Hirschfeld: Appl. Opt. 15 (1976) 2965.
[4] G. Binning, H. Rohrer, Ch. Gerber and E. Weibel: Phys. Rev. Lett. 4 (1982) 57.
[5] Y. C. Sasaki and K. Hirokawa: Appl. Phys. Lett. 58 (13) (1991) 1384.
[6] Y. C. Sasaki, Y. Suzuki and T. Ishibashi: Science 263 (1994) 62.
[7] O. Chiewitz and G. D. Hevesy: Nature 136 (1935) 754.
[8] O. Shimomura, F. H. Johnson and Y. Saiga: J. Cell. Comp. Physiol. 59 (1962) 223.
[9] Y. C. Sasaki, M. Ishibashi, M. Yanagihara, K. Toyota, A. Adachi, Y. Suzuki and N. Yagi: Phys. Rev. E. 62 (2000) 3843.
[10] Y. C. Sasaki, Y. Okumura, S. Adachi, Y. Suzuki and N. Yagi: Nucl. Instrum. Methods A. 1049 (2001) 467-468.
[11] Y. C. Sasaki, Y. Okumura, S. Adachi and N. Yagi: Phys. Rev. Lett. 87 (2001) 248102.
[12] Y. C. Sasaki: Biochemical Society Transactions Volume32, part5 (2004) 76.
[13] T. Nakagawa, Y. Cheng, E. Ramm, M. Sheng and T. Walz: Nature 433 (2005) 545.
[14] H. J. Mamin, R. Budakian, B. W. Chui and D. Rugar: Phys. Rev. Lett. 91 (2003) 207604/1.
[15] Y. C. Sasaki, K. Yasuda, Y. Suzuki, T. Ishibashi, I. Satoh, Y. Fujiki and S. Ishiwata: Biophys. J. 72 (1997) 1842.
[16] Y. Harada, K. Yasuda, S. Nomura, N. Kajimura and Y. C. Sasaki: Langmuir 14 (7) (1998) 1829.
[17] T. Sagawa, T. Azuma and Y. C. Sasaki: Biochem. Biophy. Res. Commun. 335 (2007) 770.
[18] J. K. Jaiswal, H. Mattoussi, J. M. Mauro and S. M. Simon: Nature Biotech. 21 (2003) 47.
[19] Y. Okumura, Y. Taniguchi and Y. C. Sasaki: J. Appl. Phys. 92 (2002) 7469.
[20] Y. Okumura, T. Miyazaki, Y. Taniguchi and Y. C. Sasaki: Thin Solid Film 471 (2005) 91.
[21] Y. C. Sasaki, T. Higurashi, T. Miyazaki, Y. Okumura and N. Oishi: Appl. Phys. Lett. 89 (2006) 053121.
[22] Y. Okumura, T. Oka, M. Kataoka, Y. Taniguchi and Y. C. Sasaki: Phys. Rev. E. 70 (2004) 021917.
[23] M. Iwamoto, H. Shimizu, F. Inoue, T. Konno, Y. C. Sasaki and S. Oiki: J. Biol. Chem. 281 (38) (2006) 28379.
[24] H. Shimizu, M. Iwamoto, F. Inoue, T. Konno, Y. C. Sasaki and S. Oiki: Cell 132 (2008) 67.
[25] B. Sakmann and E. Neher: Ann. Rev. Physiol. 46 (1984) 455.
[26] D. A. Doyle, J. C. Morais, R. A. Pfuetzner, A. Kuo, J. M. Gulbis, S. L. Cohen, B. T. Chait and R. Mackinnon: Science 280 (1998) 69.
[27] S. Weiss: Science 283 (1999) 1676.
[28] 佐々木裕次:日本結晶学会誌 47 (2005) 354.
[29] H. Noji, R. Yasuda, K. Kinosita Jr. and M. Yoshida: Nature 386 (1997) 299.
[30] R. Yasuda, H. Noji, K. Kinosita Jr. and M. Yoshida: Cell 93 (1998) 1117.
[31] Y. Kawashima, Y. C. Sasaki, Y. Sugita, T. Yoda and Y. Okamoto: Molecular Simulation Volume33 Issue1 & 2 (2007) 97.
佐々木 裕次 SASAKI C. Yuji
(財)高輝度光科学研究センター 利用研究促進部門
〒679-5198 兵庫県佐用郡佐用町光都1-1-1
TEL:0791-58-0833(内線3931) FAX:0791-58-2512
e-mail : ycsasaki@spring8.or.jp








