Volume 09, No.4 Pages 257 - 264
3. 最近の研究から/FROM LATEST RESEARCH
ウシ心筋チトクロム酸化酵素のプロトンポンプ機構
−X線結晶学的、分子生物学的、赤外分光学的解析−
Proton Pumping Mechanism of Bovine Heart Cytochrome c Oxidase
– X-ray Crystallographical, Molecular Biological and Infrared Spectroscopical Analyses
兵庫県立大学大学院 生命理学研究科 Graduate School of Life Science, University of Hyogo
- Abstract
- Improved X-ray structures of bovine heart cytochrome c oxidase (at 1.8/1.9 Å resolution in the fully oxidized/reduced states) show that the net positive charge created upon oxidation of the low-spin heme of the enzyme (heme a) drives the active proton transport from the interior of the mitochondria to Asp51 across the enzyme via a water channel and a hydrogen-bond network, located in tandem, and that the enzyme reduction induces proton ejection from the aspartate to the mitochondrial exterior. A peptide bond in the hydrogen-bond network critically inhibits reverse proton transfer through the network. A redox-coupled change in the capacity of the water channel, induced by the hydroxyfarnesylethyl group of heme a, suggests that the channel functions as an effective proton collecting region. The Asp51Asn mutation of the bovine enzyme abolishes its proton-pumping function without impairment of the dioxygen reduction activity. Infrared results indicate that the conformation of Asp51 is controlled only by the oxidation state of heme a. These results indicate that heme a drives the proton pumping process.
Download PDF (214.25 KB)
1.はじめに
チトクロム酸化酵素は細胞呼吸の末端酸化酵素で分子状酵素を水にまで還元する。そのときプロトンはミトコンドリア内膜の内側(マトリクス側)から、電子は外側(膜間腔側)に存在するチトクロムcからとり込まれるため、膜電位が内膜に生ずる。さらに、この酵素還元過程に共役して水素イオンがマトリクス側から膜間腔側へ能動輸送される(プロトンポンプ)。このようにして生じたプロトン濃度勾配と膜電位はプロトンのマトリクス側への駆動力となる。この駆動力によってATP合成酵素がATPを合成する[1][1]S.Ferguson-Miller and G.T.Babcock : Chem.Rev.96(1996)2889-2907.。このように、本酵素は細胞のエネルギー変換過程で最も重要な酵素の一つである。実際、細胞がこのようにして分子状酵素を利用することができなかったら、ヒトを頂点とする多細胞生物への進化は不可能であったと考えられている。このような生物学的重要性に加えて、本酵素はヘム鉄と銅イオンを含む膜タンパク質複合体であるので、種々の分光学的研究方法が適用できるため、組織的な研究が1920年代に発見されて以来息長く続けられている[2][2]S.Yoshikawa : Curr.Opin.Struct.Biol.7(1997)574-579.。
生命現象はタンパク質の駆動する化学反応であると言える。酵素に代表されるタンパク質の機能中心には種々のアミノ酸側鎖が空間的に固定され、溶液中では実現することが極めて困難な異方性を作り出している。生命現象という化学反応を理解するためには(反応機構を解明するためには)この異方性を解明することが不可欠である。この目的のために最も有効な方法はX線結晶構造解析法である。これにより、他の方法では解明することがほとんど不可能な三次元的情報が得られる、例えば、チトクロム酸化酵素のヘムの側鎖のタンパク質内部での方向をX線構造解析以外の方法で決定することはまず不可能であろう。しかし、タンパク質のX線構造解析の精度を化学反応性を議論できる程度に高めることは容易ではない。例えばタンパク質中に固定されている脂肪酸の炭化水素鎖の不飽和結合の位置をX線構造解析法だけ(その脂肪酸の化学分析を行わずに)から決定された例はほとんどない。また活性中心の酵素反応に伴う構造変化を追跡することもX線構造解析法だけでは容易ではない。また結晶格子中に組み込まれている個々のタンパク質分子間の熱振動等による不均一性もX線構造の精度の向上を阻げる。この精度の限界が化学反応性を論ずることのできる構造決定精度に到達することは多分本質的に不可能であろう。言いかえると、X線構造解析の結果は他の種々の方法(特に振動分光学的方法)によるそのタンパク質の反応過程の解析結果と組み合わせて、活性中心での構造変化としてとらえられてはじめて、反応機構の理解を深めることに貢献することができる。
2.チトクロム酸化酵素の反応機構の研究の経過
チトクロム酸化酵素は1920年代に発見され[3][3]O.Warburg : Biochem.Z.152(1924)479-494.、1941年に恐らく膜タンパク質として最初に単離され[4][4]E.Yakushiji and K.Okunuki : Proc.Imp.Acad.Japan 17(1941)38-40.、1961年には微結晶化が報告された[5][5]T.Yonetani : J.Biol.Chem.236(1961)1680-1688.。しかし、当時のX線回折実験には大きさが不十分であった。筆者らは1977年からこの結晶化条件の改善に本格的にとり組みはじめ、1995年に2.8Å分解能のX線構造を決定することができた[6][6]T.Tsukihara, H.Aoyama, E.Yamashita, T.Tomizaki, H.Yamaguchi et al. : Science 269(1995)1069-1074.。その後さらに結晶化条件およびX線回折実験条件の改良を進め、現在酸化型で1.8Å分解能のX線構造が決定されている[7][7]T.Tsukihara, K.Shimokata, Y.Katayama, H.Shimada, K.Muramoto et al. : Proc.Natl.Acad.Sci.USA 100(2003)15304-15309.。なお1995年にほとんど同時に細菌のチトクロム酸化酵素の2.8Å分解能のX線構造が報告された[8][8]S.Iwata, C.Ostermeier, B.Ludwig and H.Michel : Nature 376(1995)660-669.。しかし、細菌酵素はウシ心筋酵素の約半分の分子量で、含まれているサブユニットも4種しかなく、ウシ酵素の13種にくらべてはるかに単純な構造であるが、2.7Å分解能を超えるX線構造は報告されていない[9][9]C.Ostermeier, A.Harrenga, U.Ermler and H.Michel : Proc.Natl.Acad.Sci.USA 94(1997)10547-10553.。恐らく、ウシ酵素の多数の小さなサブユニットは酵素タンパク質の安定化に寄与しているのであろう。また、哺乳動物の高度なホメオスタシスのため実験材料(ウシ心筋)の品位の均一性が極めて高い。これも結晶化条件の改善に大きく寄与している。
1998年に酸化型2.3Å分解能、還元型2.35Å分解能のX線構造を決定し、酸化還元に共役した立体構造変化を検出した[10][10]S.Yoshikawa, K.Shinzawa-Itoh, R.Nakashima, R.Yaono, E.Yamashita et al. : Science 280(1998)1723-1729.。膜間腔側分子表面近くにあるアスパラギン酸残基(Asp51)は酸化型のとき分子内部に向いて、水相と接触していないが、還元されると分子表面に移動する。しかし、酸化型の立体構造ではカルボキシル基が水素結合のネットワークによりマトリクス側表面につながっているが還元型になると、その水素結合のネットワークから脱離する。カルボキシル基のpKaはタンパク質分子内部の誘電率の高い環境では水相に露出しているときよりはるかに高くなることが知られている。したがって酸化型のときマトリクス側からプロトンをとり込み還元されたとき膜間腔側に放出すると考えられる。このようにAsp51はプロトンポンプ部位の機能を完全に備えている。
このX線構造解析にもとづく、我々の主張は以下のような問題点があるため、広くは受け入れられていない。まず第一にAsp51は動物酵素には保存されているが植物酵素にも細菌酵素にも保存されていない。次にAsp51とマトリクス側分子表面をつなぐ水素結合のネットワークにペプチド結合が含まれている。ペプチド結合を経由するプロトン移動は有機化学反応系では次のような中間体(imidic acid intermediate、-C(OH)=N+H-)を介する反応としてよく知られている[11][11]C.L.Perrin : Acc.Chem.Res.22(1989)268-275.。
H++-CO-NH-
しかし、タンパク質中ではこのような例は知られていないためこれがプロトン輸送経路であるとの我々の主張は十分には理解されていない。さらに、このような立体構造変化とこの水素結合ネットワークを経由したプロトン輸送を何が駆動するのかが明示されていない。そのうえに、Asp51を含む水素結合のネットワークがプロトンポンプ機構をもっていることが実験的には示されていない。
一方この分野のほとんどの研究者は、やはりプロトンポンプ部位は生物種によらず保存されていると信じている。実際O2還元部位は全ての生物種で保存されている。しかし、全ての生物種で保存されているアミノ酸残基はO2還元中心とその電子供与体と考えられている低スピンヘムの配位子だけである。また、2つのヘム側鎖のプロピオン酸基も全ての生物に保存されている[12][12]M.M.Pereira, M.Santana and M.Teixiera : Biochim.Biophys.Acta 1505(2001)185-208.。これらにもとづいて種々の仮説が主張されている。しかし、もしO2還元中心がプロトンポンプ部位であるならば、ポンプされるプロトンと水を作るために利用されるプロトンとが完全に区別されなければならない[13][13]R.J.P.Williams : Nature 376(1995)643.。ヘム側鎖のプロピオン酸基をプロトンポンプ部位と考えて、そのpKa値といくつかのO2還元反応中間体のpKa値が反応の進行に伴って厳密に制御されつつ変化することによってO2還元中心へ運ばれてきたプロトンを分別することが可能であるとの理論的解析結果が報告されている[14][14]P.E.M.Siegbahn, M.R.A.Blomberg and M.L.Blomberg : J.Phys.Chem.107(2003)10946-10955.。(なおこの理論的予測によれば、酸化還元反応に共役する立体構造変化の必要はない。)勿論その理論的予測の当否は実験的に証明されなければならない。さらに以下の実験結果はO2還元中心でのプロトンポンプを支持するように見える。水を作るためのプロトンはチトクロムcからのO2還元のための電子伝達と共役してマトリクス側から水素結合のネットワークを経由して輸送される。そのような水素結合のネットワーク(Asp51につながるものとは別に)が2つ見出されている。その一つのネットワーク(D-pathway)のアミノ酸残基をプロトン輸送不可能なものに部位特異的変異によって変換するとプロトンポンプ活性がO2還元活性とともに消失した。したがってD-pathwayはポンプするためのプロトンと水を作るためのプロトンとの両方を輸送すると主張されている[15][15]R.B.Gennis : Biochim.Biophys.Acta 1365(1995)241-248.。しかし、O2還元が止められたのであればプロトンポンプの原動力が生み出されないのであるから、プロトンポンプが起こらないのは当然であろう。部位特異的変異による特定のアミノ酸残基の改変は野生型タンパク質の当該アミノ酸残基の生理機能を検討するのに簡便で極めて有効であることが多い。しかし経験的な(empirical)方法であるため、結果の解釈に充分な注意が必要である。
我々の1998年の主張[10][10]S.Yoshikawa, K.Shinzawa-Itoh, R.Nakashima, R.Yaono, E.Yamashita et al. : Science 280(1998)1723-1729.の当否はともかく、プロトンポンプ機構の解明には2.3Å分解能程度の分解能では不充分であるのでさらに分解能を高めるための努力とともに、(特にAsp51の機能を明らかにするために)分子生物学的および赤外分光学的方法により、本酵素の機能を詳細に解析した。最近報告された結果を以下に要約する[7][7]T.Tsukihara, K.Shimokata, Y.Katayama, H.Shimada, K.Muramoto et al. : Proc.Natl.Acad.Sci.USA 100(2003)15304-15309.。
3.X線結晶構造解析
ウシ心筋チトクロム酸化酵素のより高分解能のX線回折実験のために精製法と結晶の凍結法を組織的に検討した。精製法の再現性を決定するのは、他の多くの膜タンパク質の精製の際と同様、可溶化の段階であり、可溶化に用いるコール酸の純度を高めることにより、飛躍的に改善された。さらにX線回折のための結晶の凍結条件の最適化に努力した結果、酸化型1.8Å分解能、還元型1.9Å分解能での構造解析が可能な回折強度データの収集に成功した[7][7]T.Tsukihara, K.Shimokata, Y.Katayama, H.Shimada, K.Muramoto et al. : Proc.Natl.Acad.Sci.USA 100(2003)15304-15309.。これは、大阪大学蛋白質研ビームラインでかなり長時間のビームタイムが確保できたことがあってはじめて可能であったと考えられる。
図1AはAsp51の酸化還元に伴う立体構造変化を示す。図1BはAsp51のカルボキシル基の水素結合構造を示す。酸化型のとき2残基のセリンの水酸基と2つのペプチドのアミノ基との間に水素結合が形成されている。一方、還元型のとき、3分子の水と1残基のセリンとの間に水素結合が形成されている。この変化は還元によってカルボキシル基をメタノール中から水中に移したことに対応する。これによってpKaは9.5から4.8まで低下したと推定できる[16][16]N.S.Isaacs : Physical Organic Chemistry (Longman,Essex,U.K.) 2nd Ed., pp.235-286.。またX線構造の分解能が高められた結果、Asp51の水素結合構造が明確になり、還元型のときもマトリクス側からの水素結合ネットワークの末端(Tyr440とSer441間のペプチド結合のアミノ基)に水素結合が形成されていることが明らかになった。一方、酸化型のときカルボキシル基は全く分子表面に露出していないがSer441の水酸基と水素結合を形成し、前者は分子表面に固定されている水分子とも水素結合を形成している。したがってこの水素結合ネットワークは膜間腔側とマトリクス側とを連結している。しかし、このネットワークに組み込まれているペプチド結合を経由したプロトン移動はペプチド結合のケト型がエノール型よりはるかに安定であるため逆流が非常に起こりにくい。それによってマトリクス側と膜間腔側との自然発生的なプロトン移動が止められている。
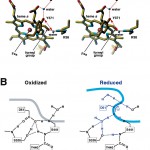
図1 Asp51の酸化還元に伴う立体構造変化。
A)Asp51につながる水素結合ネットワークの膜間腔側からの立体図(酸化型1.8Å分解能、還元型1.9Å分解能)。青色の構造は還元型、その他の還元型の構造は酸化型とほぼ一致した。ヘムaの配位子は簡単のため削除した。
B)Asp51の酸化型(Oxidized)と還元型(Reduced)との水素結合構造。太線は膜間腔側分子表面を示す。
許可を得て、参考文献[7]より転載。
このペプチド結合のCOは水分子を介してヘムa(本酵素はヘムAを2分子と銅中心を2個とを酸化還元中心として含み、1分子のヘムA(ヘムa3)と1個の銅中心(CuB)とによってO2還元中心(そこでO2が2H2Oに還元される。)を形成し、チトクロムcからの直接の電子受容体として機能するもう1個の銅中心(CuA)が膜間腔側の分子表面近くに配置されている。CuAからO2還元中心へはもう1つのヘムA(ヘムa)を経由して電子が伝達される。)の側鎖のプロピオン酸と水素結合を形成している。このネットワークはTyr371と、もう1分子の水およびArg38によってヘムa側鎖のホルミル基までつながっている(図1B)。ホルミル基からマトリクス側分子表面までの間は水分子が通過できる経路でつながっている。この経路のところどころに水を1分子以上保持することのできる空間が認められた[7][7]T.Tsukihara, K.Shimokata, Y.Katayama, H.Shimada, K.Muramoto et al. : Proc.Natl.Acad.Sci.USA 100(2003)15304-15309.(図2)。図に示されているようにヘムa側鎖の長鎖アルキル基の基部にある水酸基とSer382とは酸化型では水素結合を形成しているが、還元によってそれが切断されかなり大きな立体構造変化を誘起する。その結果、新しく水空間が形成される(図2)。水経路のほとんどの部分は、水空間を除いて、水分子がタンパク質の熱運動に伴って通過することはできるが、水分子を配置できるほどの空間ではない。したがってこの立体構造変化は酸化還元に伴うかなり大きな水の移動を推定させる。また分解能の向上によってヘムa側鎖のホルミル基がヘム面内にあって、Arg38と強く水素結合を形成していることも認められた[7][7]T.Tsukihara, K.Shimokata, Y.Katayama, H.Shimada, K.Muramoto et al. : Proc.Natl.Acad.Sci.USA 100(2003)15304-15309.。
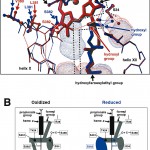
図2 酸化還元に伴うヘムa周辺の立体構造。
A)赤:酸化型(1.8Å分解能)、青:還元型(1.9Å分解能)。鎖線は水が通過することのできる通路の大体の位置。水が閉じこめられる可能性のある空間を赤点(酸化型)と青点で示した。点線は水素結合を示す。
B)酸化型還元に伴う水経路の容積変化の模式図。四角によってA)に示された領域を示す。青は還元型のときだけあらわれる構造。その他の構造は酸化還元に伴う変化を示さなかった。
許可を得て、参考文献[7][7]T.Tsukihara, K.Shimokata, Y.Katayama, H.Shimada, K.Muramoto et al. : Proc.Natl.Acad.Sci.USA 100(2003)15304-15309.より転載。
4.Asp51の機能の分子生物学的解析
前述の通りAsp51は動物チトクロム酸化酵素にしか保存されていない。したがって通常の部位特異的変異体調製法を適用することは不可能である。しかし、ウシ心筋チトクロム酸化酵素のAsp51を含むサブユニットの遺伝子を、例えばヒトの細胞で発現させ、他の12個のヒトチトクロム酸化酵素との雑種酵素を作る系を確立すればそのサブユニットの任意のアミノ酸残基の改変が可能となる。しかし、Asp51を含むサブユニット(サブユニットⅠ)は分子量6万に近く、12本の膜貫通ヘリックスを持ち、ヘム2分子、CuBおよび数分子のリン脂質を含む巨大な膜タンパク質複合体である。これはミトコンドリア遺伝子にコードされているので、ミトコンドリアマトリクス内で発現され、ミトコンドリア内膜に運ばれて、その他のサブユニット(多くは核遺伝子にコードされており、細胞質で発現され、それぞれのシグナルペプチドによってミトコンドリア内膜に輸送される。)と会合しチトクロム酸化酵素を形成する。したがって細胞質でこのように巨大なサブユニットⅠ遺伝子を発現させミトコンドリア内膜に移行させることができても、正常に会合することができるとは余程楽天的でないと信じることは困難である。さらに、この方法がこのサブユニットⅠより小さな膜タンパク質であるチトクロムb5について試行され不成功に終わったとの報告がある[17][17]M.G.Claros, J.Pevea, Y.Shu, F.A.Samatery, J.-L.Popot and C.Jacq : Eur.J.Biochem 228(1995)762-771.。一方、細菌チトクロム酸化酵素の中心となる3個のサブユニットの立体構造にはウシ酵素の中心となるミトコンドリア遺伝子にコードされた3個のサブユニットの立体構造と、少なくとも2.8Å分解能では、目立った差異は認められなかった[8,9,18][8]S.Iwata, C.Ostermeier, B.Ludwig and H.Michel : Nature 376(1995)660-669.
[9]C.Ostermeier, A.Harrenga, U.Ermler and H.Michel : Proc.Natl.Acad.Sci.USA 94(1997)10547-10553.
[18]T.Tsukihara, H.Aoyama, E.Yamashita, T.Tomizaki, H.Yamaguchi et al. : Science 272(1996)1136-1144.。この結果も、細菌酵素の機能は完全に哺乳動物のそれと共通であると多くのこの分野の研究者に強く信じさせることになった。このような視点からからは、細菌に保存されていないアミノ酸残基の改変を上述のような手間をかけて行う意義はほとんどないと言える。このAsp51改変に適用された方法は決して新規なものではないが、このような背景を考えると、慶應大学医化学教室島田グループのこのプロジェクトへの挑戦は誠に果敢であったと言える。1930年代に「月の石をとってくるほど困難である」と考えられていたチトクロム酸化酵素の単離に、1941年に薬師寺と奥貫が成功したが、これに匹敵する成果であると言える。最近、生命科学分野での種々の技術の進歩が著しいため、膨大なソツのない研究成果が溢れている。したがって、特にこのグループの果敢さが目立つ。
ともかく、驚くべきことに、この巨大で複雑な構造のサブユニットⅠが細胞質で合成され、ミトコンドリア内膜で、吸収スペクトルにも酵素活性にも野生型との相違点の全く認められないヒト−ウシ雑種酵素を作ることができた。そこで、Asp51を立体構造がほとんど同一でプロトン輸送能のないアスパラギンに変換したところプロトンポンプ活性は消失したが、O2還元活性は50%近く上昇した。(この上昇はプロトンポンプの脱共役によるものと考えられる。)この結果はAsp51がプロトンポンプ部位であることを強く示唆している[7][7]T.Tsukihara, K.Shimokata, Y.Katayama, H.Shimada, K.Muramoto et al. : Proc.Natl.Acad.Sci.USA 100(2003)15304-15309.。しかし、この結果はこの分野の多くの人々の予想(信念)に反するものであったので、例えば、Asp51Asn変換による二次的効果が真のプロトンポンプ部位(Asp51ではない)に影響してプロトンポンプを阻害したのではないかと推定する研究者もある。しかし、そう考えるのなら、その他の膨大なアミノ酸改変にもとづく議論も再検討しなければならない。
なお、図1の酸化・還元に共役した立体構造変化はAsp51のカルボキシル基のpKa変化をはっきりと示してはいるが、実際にプロトンのマトリクス側からのとり込みと膜間腔側への排出が可能であることをこの結果だけからは結論することはできない。例えば、酸化型のときカルボキシル基はSer441を介して外部の水相と水素結合によってつながっているので、酸化されてCOO−が分子内に移動したとき、ペプチド結合からプロトンをとり込むのではなく、Ser441を介して膜間腔側からプロトンをとり込むことも可能である。上述の分子生物学的手法による成果はこのような可能性を強く否定している。
5.赤外分光学的解析
X線構造は完全酸化型と完全還元型についてのみ、それぞれ1.8Åと1.9Å分解能で決定された。したがってどの酸化還元中心とこのAsp51の立体構造変化とが共役しているのかは明確ではない。またAsp51の立体構造変化はpKaの大きな変化を示唆しているが、このX線構造の分解能では水素原子の位置を決定することは不可能であるし、COO−とCOOHとの差を非経験的に決定することも不可能である。このような目的のためには赤外分光学的方法が最も有効である。
しかし、チトクロム酸化酵素のように巨大な膜タンパク質の赤外分光測定は極めて困難である。−COOH領域には多数のAspとGluが重なっているし、水の吸収のバックグラウンドがタンパク質領域(1900〜1000cm-1)には非常に強い。さらに水蒸気による、強くかつ半値幅の短い吸収帯は、標準スペクトルを用いて差し引くこともある程度は可能であるが、標準スペクトルそのものにも誤差が含まれているため、完全に消去することは不可能である。また、吸収が大きく透過光が微弱な場合、セルホルダーとセルとの間の遊びによってもスペクトルが影響されることが知られている。そこで、測定セルを動かさずに電極電位によって酵素を還元して、酸化還元差スペクトルを測定することが試みられている[19][19]P.Hellwig, T.Soulimane, G.Buse and W.Maentele : FEBS Lett.,458(1999)83-86.。しかし、この方法では外部配位子の影響を調べることは不可能である。またセルホルダーとセルとの遊びが問題になるような実験条件で定量的な解析が可能な測定は本質的に不可能であると推定される。そこで、我々はセルを動かし、試料をとりかえても十分高精度でタンパク質領域の酸化還元差スペクトルが測定できる条件を検討した。第一に、赤外分光光度計用の低湿度室(相対湿度7%以下)を設置し、分光器全体をその中に設置した。これにより相対湿度を低下させることができただけではなく、時間変化を激減させることに成功した。また、セル内の、肉眼では検出できないほど小さなホコリでも試料を注入したときにアワを生じさせ、その中の水蒸気がスペクトルを大きく乱すので、セルそのものだけではなく実験担当者の静電気の除去にも細心の注意をはらう必要があった。またセルの光路長が洗浄の際の不注意で可塑的に変化するので、洗浄にも注意が必要であった。この赤外分光装置と方法によってこれまで測定が最も困難であったアミドⅠ、Ⅱ領域も含めて、格段に信頼性の高い結果が得られるようになった。
この測定条件によってウシ心筋チトクロム酸化酵素の完全酸化型の完全還元型に対する差スペクトルを測定したところ、1738cm-1と1585cm-1に細菌酵素には見られない山と谷を検出した。波数領域から、それぞれCOOHとCOO−に帰属できる。また吸収強度はそれぞれ1個の官能基によるものであることを示している。したがってこの変化はAsp51に帰属できる。恐らくこの結果は、Asp51が還元に伴って脱プロトン化することを最も明確に示すものと言える[7][7]T.Tsukihara, K.Shimokata, Y.Katayama, H.Shimada, K.Muramoto et al. : Proc.Natl.Acad.Sci.USA 100(2003)15304-15309.。(これら2つの吸収帯はセルを動かさない方法によって検出されているが、なぜかこれらはAsp51には帰属されていない[19][19]P.Hellwig, T.Soulimane, G.Buse and W.Maentele : FEBS Lett.,458(1999)83-86.。)
次に同様の測定をCO存在下で行った。COはO2還元中心に結合し、ヘムa3とCuBを還元型に固定する。したがってヘムaとCuAの酸化還元差スペクトルを測定することができる。しかし、1738cm-1 と1584cm-1の吸収帯の位置も強度もCOの存在によって全く影響されなかった。同様にヘムa3だけを酸化型に固定するシアン化物によっても影響されなかった[7][7]T.Tsukihara, K.Shimokata, Y.Katayama, H.Shimada, K.Muramoto et al. : Proc.Natl.Acad.Sci.USA 100(2003)15304-15309.。したがってAsp51のプロトン化状態はヘムaかCuAに(あるいはその両方に)制御されていると考えられる。次にシアン化物存在下で本酵素の還元滴定を行ったところ、1584cm-1と1738cm-1のどちらの吸収帯の強度減少も、添加した電子当量に完全に比例し、3電子当量を添加することによって完全に吸収帯は消失した[7][7]T.Tsukihara, K.Shimokata, Y.Katayama, H.Shimada, K.Muramoto et al. : Proc.Natl.Acad.Sci.USA 100(2003)15304-15309.。この条件では添加した電子当量は3個所の酸化還元中心のそれぞれに完全に均等に分布することが知られている。したがってこの結果はAsp51のプロトン化状態はCuAかヘムaのどちらか一方のみによって制御されていることを示している。これがヘムaによるものかCuAによるものかを直接証明する結果は得られていないが、完全還元型チトクロム酸化酵素がO2によって完全酸化されるとき1当量のプロトンが膜間腔側に放出されることが報告されている[20][20]M.Oliveberg, S.Hallen and T.Nilson : Biochmistry 30(1991)436-440.。完全還元型酵素がO2によって酸化されるとき、CuAは酸化されるだけで還元されることはないが、ヘムaは1度だけCuAによって還元される。したがってヘムaがAsp51のプロトン化状態を制御していると考えられる。
6.プロトンポンプ機構
本研究によって得られた上述の結果は以下のようなプロトンポンプ機構を示唆している(図3)。Asp51につながっている水素結合のネットワークのマトリクス側末端ではヘムaのホルミル基がArg38と水素結合を形成している。ヘムaは第5、第6配位座にHistidineが配位した低スピン型であり酸化還元に伴う立体構造変化は認められない。したがって還元型(Fe2+)のとき、ヘムa全体として荷電を持たないが、酸化型(Fe3+)では1当量の正荷電を持つ。この正荷電はポルフィリン─π電子系に共役しているホルミル基にも非局在化している。それはこのホルミル基のC−O振縮振動スペクトルは酸化還元により40cm-1もシフトすることによって明らかにされている[21][21]M.Sassaroli, Y.-C.Ching, S.Dasgupta, D.L.Rousseau : Biochemistry 28(1989)3128-3132.。プロトン能動輸送の原動力はこのヘムaの酸化に伴うホルミル基の電子密度の低下にある。これによりArg38のプロトンが水素結合のネットワークを経由して、Asp51まで輸送される。このときヘムaのプロピオン酸のpKaも低下すると考えられるが、それもプロトンのAsp51への輸送を促進する。ヘムaが還元されると水経路の容積が増加し、新しく水分子がマトリクス側からとり込まれる。一方ヘムaの還元に共役してAsp51のカルボキシル基が分子表面に移動しプロトンを膜間腔へ放出する。脱プロトン化したArg38に水素結合しているホルミル基の電子密度が上がるためpKaは大きく上昇し、とりこまれた水分子からプロトンを引き抜く。生じたOH−はヘムaの酸化によって水経路の容積が低下するため、マトリクス側に排出される(図3)。このプロトンポンプ経路には、O2還元中心が含まれていない。したがってポンプするプロトンと水を作るプロトンが完全に区別されているため、混同される可能性が全くない。O2還元によって作られた自由エネルギーはプロトンポンプに共役しているヘムaを酸化することに利用される[7][7]T.Tsukihara, K.Shimokata, Y.Katayama, H.Shimada, K.Muramoto et al. : Proc.Natl.Acad.Sci.USA 100(2003)15304-15309.。
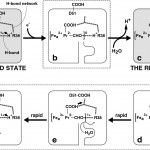
図3 チトクロム酸化酵素のプロトンポンプ機構。灰色は安定に存在する分子種。点線で囲った構造は短時間だけ生ずる中間体。[ ]と[ ]1+はヘムaの正味の正荷電を示す。aとdの太い矢印は静電的反撥を示す。許可を得て、参考文献[7][7]T.Tsukihara, K.Shimokata, Y.Katayama, H.Shimada, K.Muramoto et al. : Proc.Natl.Acad.Sci.USA 100(2003)15304-15309.より転載。
最後にAsp51がなぜ、全ての生物種に保存されていないかについて考察する。プロトンポンプ機能はチトクロム酸化酵素に不可欠な機能である。しかし、プロトン輸送に関与することができるアミノ酸残基あるいは補欠分子族はいろいろある。したがって、Asp51あるいはそれに連なっている水素結合ネットワークを構成するアミノ酸残基をネットワーク全体の機能を損なわずに一個所あるいは複数個所変換することは可能である。実際水を作るためのプロトンの2つの水素結合ネットワークを形成しているアミノ酸はどれも完全には保存されていないことが知られている[12][12]M.M.Pereira, M.Santana and M.Teixiera : Biochim.Biophys.Acta 1505(2001)185-208.。Asp51に対応する位置にはグリシンと分子内部に固定された水分子が存在することを細菌酵素のX線構造は示している[9][9]C.Ostermeier, A.Harrenga, U.Ermler and H.Michel : Proc.Natl.Acad.Sci.USA 94(1997)10547-10553.。またウシ酵素のAsp51とホルミル基とをつなぐ水素結合のネットワーク(ペプチド結合を含む)は、アミノ酸残基は完全には保存されてはいないが、細菌酵素にも認められる。ホルミル基からマトリクス表面の間の水経路を構成するアミノ酸残基は水を輸送する機能を保持しておれば良いので多様な変換が可能である。細菌酵素の、ウシ酵素のプロトンポンプ経路に対応する経路のアミノ酸残基の変換の効果が検討されているが、この点についての考慮が不足している[22, 23][22]U.Pfitzner, A.Odenwald, T.Ostermann, L.Weingard, B.Ludwig et al. : J.Bioenerg.Biomembr.30(1998)89-97.
[23]H.-M.Lee, T.K.Das, D.L.Rousseau, D.Mills, S.Ferguson-Miller et al. : Biochemistry 39(2000)2989-2996.。特に多くの水経路のアミノ酸をそれより小型のアミノ酸に変換してもプロトンポンプは損なわれないことをこの経路がプロトンポンプに関与していないことの証拠としている。しかし、水経路が広がるだけであるから影響があるはずがない。あるアミノ酸残基がプロトンポンプ機構に関与していないことをアミノ酸置換のみによって証明することは本質的に不可能である。一方、O2還元中心のヘムとCuBおよび低スピンヘムの配位子は完全に保存されている。O2を水にまで活性酸素種を遊離させずに還元するための効率の良い方法はいくつもあるとは考えられない。恐らく、本酵素のもつこの系より効率の良いものは見出されていないため、このように完全に保存されているのであろう。
本研究は主に科学技術振興事業団戦略的基礎研究推進事業生命活動のプログラム「水素イオン能動輸送機構の構造生物学的解析」および文部科学省21世紀COE拠点形成プログラム「構造生物学を軸とした分子生命科学の展開」による多数の方々との共同研究の成果である。またこの成果は筆者の過去39年にわたるチトクロム酸化酵素研究の間の数々の幸運な学問的出会いの賜物でもある。特に筆者に30年にわたって化学の重要性を教授しようと気長に努力して下さっているコロラド州立大学名誉教授Winslow S. Caughey氏には深く感謝する。
参考文献
[1]S.Ferguson-Miller and G.T.Babcock : Chem.Rev.96(1996)2889-2907.
[2]S.Yoshikawa : Curr.Opin.Struct.Biol.7(1997)574-579.
[3]O.Warburg : Biochem.Z.152(1924)479-494.
[4]E.Yakushiji and K.Okunuki : Proc.Imp.Acad.Japan 17(1941)38-40.
[5]T.Yonetani : J.Biol.Chem.236(1961)1680-1688.
[6]T.Tsukihara, H.Aoyama, E.Yamashita, T.Tomizaki, H.Yamaguchi et al. : Science 269(1995)1069-1074.
[7]T.Tsukihara, K.Shimokata, Y.Katayama, H.Shimada, K.Muramoto et al. : Proc.Natl.Acad.Sci.USA 100(2003)15304-15309.
[8]S.Iwata, C.Ostermeier, B.Ludwig and H.Michel : Nature 376(1995)660-669.
[9]C.Ostermeier, A.Harrenga, U.Ermler and H.Michel : Proc.Natl.Acad.Sci.USA 94(1997)10547-10553.
[10]S.Yoshikawa, K.Shinzawa-Itoh, R.Nakashima, R.Yaono, E.Yamashita et al. : Science 280(1998)1723-1729.
[11]C.L.Perrin : Acc.Chem.Res.22(1989)268-275.
[12]M.M.Pereira, M.Santana and M.Teixiera : Biochim.Biophys.Acta 1505(2001)185-208.
[13]R.J.P.Williams : Nature 376(1995)643.
[14]P.E.M.Siegbahn, M.R.A.Blomberg and M.L.Blomberg : J.Phys.Chem.107(2003)10946-10955.
[15]R.B.Gennis : Biochim.Biophys.Acta 1365(1995)241-248.
[16]N.S.Isaacs : Physical Organic Chemistry (Longman, Essex, U.K.) 2nd Ed., pp.235-286.
[17]M.G.Claros, J.Pevea, Y.Shu, F.A.Samatery, J.-L.Popot and C.Jacq : Eur.J.Biochem 228(1995)762-771.
[18]T.Tsukihara, H.Aoyama, E.Yamashita, T.Tomizaki, H.Yamaguchi et al. : Science 272(1996)1136-1144.
[19]P.Hellwig, T.Soulimane, G.Buse and W.Maentele : FEBS Lett., 458(1999)83-86.
[20]M.Oliveberg, S.Hallen and T.Nilson : Biochmistry 30(1991)436-440.
[21]M.Sassaroli, Y.-C.Ching, S.Dasgupta, D.L.Rousseau : Biochemistry 28(1989)3128-3132.
[22]U.Pfitzner, A.Odenwald, T.Ostermann, L.Weingard, B.Ludwig et al. : J.Bioenerg.Biomembr.30(1998)89-97.
[23]H.-M.Lee, T.K.Das, D.L.Rousseau, D.Mills, S.Ferguson-Miller et al. : Biochemistry 39(2000)2989-2996.
吉川 信也 YOSHIKAWA Shinya
兵庫県立大学大学院 生命理学研究科 生命科学専攻
(独)理化学研究所 播磨研究所 城生体金属科学研究室 客員主管研究員
〒678-1297 兵庫県赤穂郡上郡町光都3-2-1
略歴
1965年 大阪大学 理学部 生物学科卒業
1970年 大阪大学大学院 理学研究科 生物化学専攻 博士課程修了
1972年 甲南大学 理学部 生物学科講師
1978年 甲南大学 理学部 生物学科助教授
1983年 甲南大学 理学部 生物学科教授
1988年 姫路工業大学 工学基礎研究所教授
1990年 姫路工業大学 理学部教授
2004年 兵庫県立大大学院 生命理学研究科 生命科学専攻 教授 (県立大学統合に伴う名称変更)








