Volume 17, No.2 Pages 105 - 110
1. 最近の研究から/FROM LATEST RESEARCH
[4Fe-3S]クラスターによる[NiFe]ヒドロゲナーゼの酸素耐性機構の構造基盤
X-ray Structural Study of the Oxygen-tolerant Membrane-bound [NiFe]-hydrogenase -A novel Bifunctional [4Fe-3S] Cluster
兵庫県立大学大学院 生命理学研究科 Graduate School of Life Science, University of Hyogo
- Abstract
- 酸素耐性をもつ膜結合型[NiFe]ヒドロゲナーゼのX線結晶構造解析に成功した。構造解析の結果、ヒドロゲナーゼが3個もつ鉄-硫黄クラスターのうち、Ni-Fe活性部位の一番近くに位置するクラスターが、従来までに知られていた[4Fe-4S]-4Cys型ではなく、新規の構造の[4Fe-3S]-6Cys型であることを見出した。これまでに研究されていた標準型[NiFe]ヒドロゲナーゼは酸素条件下では酸素が活性部位に結合し、その酵素活性が失われることが知られていた。本酸素耐性の膜結合型[NiFe]ヒドロゲナーゼは、酸素にさらされた時に[4Fe-3S]-6Cysクラスターが構造変化を起こし、さらにNi-Fe活性部位に電子を余分に与え、酸素を分解することによって不活性化を免れることを見出した。
1.はじめに
化石燃料に替わる次世代のエネルギー源の探索は人類にとって重要な課題である。水素はエネルギーとして利用しても、最終的には水を生成するだけで温室効果ガスといわれる二酸化炭素やその他の有害物質を発生することはない。従って水素は究極のクリーンなエネルギー源といえる。水素を燃料とし、それを分解して電力を得るいわゆる燃料電池は、20世紀以前に既にその原型が考案され、多くの研究者によってその実用化が模索されてきた。一方、地球の酸素濃度が今よりもっと低かった太古の昔、水素をエネルギー源として生活する微生物が繁栄していた。これらの微生物は、ヒドロゲナーゼとよばれる酵素を使って水素を分解し、生命活動に必要なエネルギーを得ていた。また、水素以外の栄養源が得られた時には、過剰なエネルギーを水素として大気中に放出していた。つまり、微生物は10億年以上前から燃料電池システムを利用していたわけである。このヒドロゲナーゼ分子は下記の単純な化学反応を触媒する[1][1]P. M. Vignais and B. Billoud: Chem. Rev. 107 (2007) 4206-4072.。
H2 ↔ 2H++2e-
ヒドロゲナーゼは、1930年代に発見されて以来、燃料電池の陰電極側の水素分解触媒や、あるいは太陽エネルギーを利用した光合成システムと組み合わせた水素合成触媒としての応用が試されてきた。しかし、発見当初は嫌気性細菌のもつヒドロゲナーゼしか見出されておらず、これらの微生物のもつヒドロゲナーゼは、一般的に嫌気的条件下のみで機能するものであった。これらは、これまでにも結晶学的、分光学的、生化学的、電気化学的に最もよく研究されてきたもので「標準型」と呼ばれており、微量の酸素によって簡単に不活性化されるという大きな欠点があった[2][2]H. Ogata, W. Lubitz and Y. Higuchi: Dalton Trans (2009) 7577-7587.。これは、ヒドロゲナーゼを燃料電池や光合成システムと組み合わせるためには決定的な障害であった。しかし、最近、好気性微生物から大気中程度の酸素濃度でも失活しない酸素耐性をもつ「膜結合型」ヒドロゲナーゼが見出されるようになった[3, 4, 5][3]M. Brugna-Guiral et al.: Extremophiles 7 (2003) 145-157.
[4]E. Van der Linden et al.: J. Biol. Inorg. Chem. 9 (2004) 616-626.
[5]K. S. Yoon, K. Fukuda, K. Fujisawa and H. Nishihara: Int. J. Hydrogen Energy 36 (2011) 7081-7088.。そこで、この酸素耐性機構を構造化学的に解明してそれをモデルにした化学触媒の開発に大きな期待が寄せられるようになった。
2.本論
「標準型」と本研究で示す「膜結合型」ヒドロゲナーゼは、系統学的には近縁種で45%程度のアミノ酸配列の同一性をもち、いわゆるヒドロゲナーゼの活性ユニットはともにヘテロ2量体(大サブユニットと小サブユニット)型の構造である。主に標準型は嫌気性細菌に、膜結合型は好気性細菌に見出される。膜結合型は、小サブユニットのカルボキシ末端の疎水性ヘリックスが膜に埋もれた、もうひとつのシトクロムb(Cytb)サブユニットと相互作用し、生体内では3量体酵素として存在する。従ってこのヒドロゲナーゼは、「Cytb結合型」とよばれることもあるが、本稿ではこれを単に「膜結合型」と略す。しかし、自然界には「膜結合型」や「膜内在型」でもCytbを結合せず、また酸素耐性ももたないヒドロゲナーゼが存在することをあえて喚起しておく。この3量体酵素は水素を分解して得た電子を使い、Cytbを介して膜中でキノンをキノールに還元するのにともなって細胞質側からプロトンを取り入れ、膜内外のプロトン勾配を生成する。
我々は、静岡県の海岸の潮だまりで採取された細菌(Hydrogenovibrio marinus)から膜結合型ヒドロゲナーゼを抽出し[5][5]K. S. Yoon, K. Fukuda, K. Fujisawa and H. Nishihara: Int. J. Hydrogen Energy 36 (2011) 7081-7088.、精製条件を確立し、高分解能での構造決定を可能とする良質な結晶を再現性良く得ることに成功した[6][6]Y. Shomura, K. Hagiya, K. S. Yoon, H. Nishihara and Y. Higuchi: Acta Crystallogr. F67 (2011) 827-829.。得られた結晶を用いてSPring-8(BL44XUおよびBL41XU)においてX線回折実験を行い、大気中で酸化された状態(空気酸化型)、酸化剤で酸化した状態([K3Fe(CN)6]酸化型)および水素で還元した状態(水素還元型)の3種類の状態の結晶構造を決定した[7][7]Y. Shomura, K. S. Yoon, H. Nishihara and Y. Higuchi: Nature 479 (2011) 253-257.。3種類の結晶構造の分解能は、それぞれ1.18 Å(空気酸化型)、1.32 Å([K3Fe(CN)6]酸化型)および1.22 Å(水素還元型)で、十分に精度の高いものであった(表1)。結晶中ではヒドロゲナーゼ分子は2量体構造(ヘテロ2量体が2つ)で、しかも小サブユニットのカルボキシ末端の疎水性ヘリックスは精製中に切断され、Cytbサブユニットも失われたものであった(図1)。しかし、ヘテロ2量体のみの分子全体構造や、反応を触媒するNi-Fe活性部位の構造、電子伝達に関わる3個の鉄-硫黄クラスターの配置は、これまでに研究されてきた標準型酵素とほとんど同じであった。
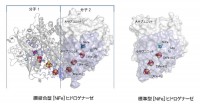
図1 膜結合型(左)および標準型[NiFe]ヒドロゲナーゼ(右)の構造全体の比較図
膜結合型ヒドロゲナーゼについては、左側の分子はリボン図で、右側の分子は分子表面図で示す。[NiFe]活性部位と3個の鉄-硫黄クラスターおよびMg中心の原子は球で示す。膜結合型酵素の[4Fe-3S]-6Cysクラスターは、Ni-Fe活性部位に一番近くに位置していた。膜結合型酵素の全体構造とNi-Fe活性部位や鉄-硫黄クラスターの相対配置は標準型酵素のそれとほとんど差異はなかった。両酵素とも大サブユニットは灰色、小サブユニットは紫色で示す。
| データセット | 水素還元型 | [K3Fe(CN)6]酸化型 | 空気酸化型 |
| 結晶学的データ | |||
| 空間群 | P 21 | P 21 | P 21 |
| 格子定数 a, b, c(Å) | 75.7, 116.3, 113.6 | 75.6, 116.9, 113.3 | 75.6, 116.7, 113.6 |
| β( °) | 91.4 | 91.4 | 91.3 |
| データ測定 | |||
| X線波長(Å) | 0.9000 | 0.9000 | 0.9000 |
| 分解能(Å) | 20.00-1.18(1.20-1.18) | 20.00-1.32(1.34-1.32) | 20.00-1.22(1.24-1.22) |
| 反射データ数 | 1,797,315 | 1,727,254 | 2,390,583 |
| 独立な反射データ数 | 627,603(31,537) | 459,529(22,500) | 578,159(28,793) |
| R merge | 0.080(0.464) | 0.080(0.496) | 0.084(0.385) |
| 〈I / σ(I)〉 | 13.6(2.8) | 12.6(3.2) | 12.5(3.3) |
| 精密化 | |||
| 分解能(Å) | 20.00-1.18 | 20.00-1.32 | 20.00-1.22 |
| 反射数/パラメータ数 | 1,106,011 / 140,564 | 844,961 / 140,701 | 1,035,058 / 140,969 |
| R / free R | 0.139 / 0.169 | 0.136 / 0.173 | 0.139 / 0.171 |
| 原子数(非対称単位) | |||
| タンパク質 | 27,117 | 27,158 | 27,270 |
| リガンド | 96 | 96 | 98 |
| 水 | 1,655 | 1,647 | 1,631 |
| 温度因子(Å2) | |||
| 主鎖原子 | 13.6 | 14.7 | 12.1 |
| 側鎖原子 | 20.5 | 22.1 | 18.7 |
| リガンド | 14.1 | 15.1 | 12.5 |
| 水 | 30.6 | 32.5 | 29.2 |
| ラマチャンドランプロット(%) | |||
| 推奨範囲内 | 97.5 | 97.4 | 97.5 |
| 許容範囲内 | 2.5 | 2.6 | 2.5 |
解析した水素還元型の立体構造を詳細に分析したところ3個の鉄-硫黄クラスターのうち最もNi-Fe活性部位に近いもの(近位クラスター)が、これまでに知られていた正六面体型の[4Fe-4S]タイプ(図2左)ではなく、[4Fe-3S]タイプの新規の構造であった(図2中)。つまり、一般的な[4Fe-4S]の1つのS原子(S4)が失われ、その代わりに2つのシステイン(Cys25 とCys126)が加わり、合計6つのシステイン残基のS原子が[4Fe-3S]クラスターに配位して[4Fe-3S]-6Cysとなっていた。結果として一般的な[4Fe-4S]-4Cysに見られるFe4とS4の結合は失われているが、全てのFeには4つの配位子が結合しており、全体の構造としては、正六面体型に近い構造を維持していた。このヒドロゲナーゼの結晶に酸素よりも効率のよい酸化剤[K3Fe(CN)6]を加えて酸化したところ、この[4Fe-3S]-6Cysクラスターの構造が変化することを見出した。すなわち、クラスターのFe2原子が動いてFe2-S3結合が切れ、その代わりに、Fe2原子はタンパク質中のCys26のペプチド主鎖の窒素原子と新たな結合(2.09 Å)をつくっていた(図2右)。一方、通常の酸素雰囲気下で精製・結晶化しただけの酵素(空気酸化型)では、上記の[4Fe-3S]-6Cysクラスターの構造は、水素還元型と[K3Fe(CN)6]酸化型の構造の混合物であった。これは、クラスターの酸化状態と、[4Fe-3S]-6Cysクラスターの構造変化が関係していることを強く示唆している。このように酵素の酸化還元に同期した鉄-硫黄クラスターの構造変化(およびペプチド主鎖窒素原子のFeへの配位)については、ニトロゲナーゼのP-クラスター[8][8]J. W. Peters et al.: Biochemistry 36 (1997) 1181-1187.や好熱菌の呼吸鎖複合体Ⅰなどの4Fe-4Sクラスター[9][9]J. M. Berrisford and L. A. Sazanov: J. Biol. Chem. 284 (2009) 29773-29783.で知られており、本研究結果はこれらに加えて3つめの例である。クラスターの構造変化は可逆的で、酸化型は、水素還元や還元剤の添加、あるいは過剰のX線照射により再度還元型構造に戻ることを確認した。
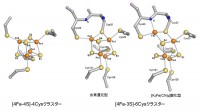
図2 正六面体型[4Fe-4S]-4Cysおよび膜結合型酵素の[4Fe-3S]-6Cysクラスターの構造
一般的な正六面体[4Fe-4S]型のクラスターの4個のFeは、近くの4つのシステイン残基のSによりタンパク質中に保持されている。膜結合型酵素に見出された[4Fe-3S]型クラスターは、[4Fe-4S]の中の4個のSのうちS2がなくなり、代わりにシステイン残基(Cys25)のSがFeに結合している。またもうひとつのシステイン残基(Cys126)もクラスターの保持に参加している。通常の酸素がある状態では水素還元型と[K3Fe(CN)6]酸化型の混合物の構造が得られた。オレンジ色は鉄原子、黄色は硫黄原子、灰色は炭素原子を示している。
本研究で見出された新規の[4Fe-3S]-6Cys型クラスターは、一般的な[4Fe-4S]-4Cys型とその総電荷は同じであり、従ってFe原子の酸化還元状態も同じである。実際、クラスター近辺の電荷をもったアミノ酸残基側鎖の数や配置も下記の2点を除いてほぼ同じであった。膜結合型では、側鎖に負電荷を持った2つの残基Asp51(S)とGlu73(L)がクラスターの近くに位置していた(ここで残基番号の後に示した(S)や(L)は、それぞれ小サブユニットおよび大サブユニットに属する残基であることを意味する)。Asp51(S)はこのクラスターと約12 Åの距離にある。Glu73(L)は、近くのArg74(L)の正電荷を相殺しているが、膜結合型においては厳密に保存されているわけではなく、その効果は小さいと思われる。一般的な[4Fe-4S]クラスターの酸化数は、その酸化還元サイクルにおいて「2+/1+」で遷移することが知られている。一方、[4Fe-3S]クラスターにおいては、通常の水素酸化触媒サイクルで、その酸化数は「4+/3+」で遷移していると考えるのが最も適当であろう。つまり、各Fe原子の価数は、両者とも同じ[2Fe2+: 2Fe3+および3Fe2+: 1Fe3+]である。これは、2011年に発表された他の膜結合型の電子スピン共鳴法、赤外分光法、メスバウアー効果、変異体解析および電気化学的研究結果と矛盾しない[10, 11][10]M. E. Pandelia et al.: J. Am. Chem. Soc. 132 (2010) 6991-7004.
[11]T. Goris et al.: Nat. Chem. Biol. 7 (2011) 310-318.。これらの結果によるとRalstonia eutropha H16とAquifex aeolicusの膜結合型の近位クラスターにおける常磁性から反磁性状態への中間酸化還元電位はそれぞれ、−60および+87 mVであり、さらにこのクラスターは超酸化状態で常磁性となり、それぞれ+160および+232 mVの中間酸化還元電位を示すと報告された。すなわち近位クラスターは2回の1電子遷移をすると示された。しかし、一般的な[4Fe-4S]クラスターの構造から上記のような物理化学的挙動を説明するのは極めて困難であり、これを解決するにはその構造解明が必須と考えられていた。本研究結果で得られた水素還元型と[K3Fe(CN)6]酸化型における[4Fe-3S]クラスターの構造変化は、クラスターが電子を他に与えて自身は超酸化状態([4Fe-3S]5+)になった結果として起ったものであり、上記の分光学的および電気化学的結果を極めて論理的に説明するものであった。超酸化状態になったクラスターの1個の鉄原子(Fe2)は、Cys26 のアミド窒素原子に結合するが、脱プロトンしたこのアミド窒素の負電荷は、より酸化された状態のFe2(おそらくFe23+)を安定化していると考えられる。生体システムにおいて、鉄-硫黄クラスターが3つの酸化還元状態をもち、1電子遷移を2回行うという報告はこれまでにないことから、本研究結果で見出された[4Fe-3S]クラスターが初めての例となる。
さて、前述した「近位クラスターが構造変化して超酸化状態を取り得る」ことが本酵素のもつ特異な性質である「酸素耐性」とどのように関係するのかをもう少し考察する。標準型、すなわち酸素耐性をもたない[NiFe]ヒドロゲナーゼは、活性化された状態が酸素に暴露されると分光学的に区別可能なNi-AおよびNi-B型と呼ばれる2つの酸化状態に可逆的にうつる(図3)[12][12]W. Lubitz, E. Reijerse and M. van Gastel: Chem. Rev. 107 (2007) 4331-4365.。Ni-Aは電子が少ない状態でNi-Fe活性部位が酸素により酸化された時に生じ、再活性化までに極めて長い時間がかかる。一方、Ni-Bは十分な電子がある状態で酸素と反応した時に生じ、瞬時に再活性化される。これまでに発見された酸素耐性をもつ[NiFe]ヒドロゲナーゼの活性部位は酸化型においてもNi-Aは示さずNi-Bのシグナルのみが電子スピン共鳴法で観測されており、Ni-B型であれば大気中と同程度の酸素があっても酵素は水素の酸化還元を触媒できる。従って、膜結合型の酸素耐性能は、Ni-Fe活性部位がNi-A型にならないことに起因すると考えられていた。本研究で得られた結果から次のように酸素耐性機構を理解できる。すなわち、Ni-Fe活性部位に近い[4Fe-3S]型クラスターは、酸素分子が活性部位に結合したときに構造変化を起こし、電子を余分に活性部位に供給する。
これにより活性部位は、酸素を分解でき、Ni-A型になることを免れることが可能となる。構造解析の結果、標準型も膜結合型もそのNi-Fe活性部位およびその周辺構造には大きな違いがなかった。また、分子表面から分子内部のNi-Fe活性部位まで通じる水素分子チャネル(水素を通すトンネル)のサイズや長さにも両者には大きな違いはなかった。従って、活性部位や水素分子チャネルに本酵素の酸素耐性の「しくみ」があるわけではなく、従来タンパク質中において電子を通すという機能のみをもっていると考えられていた鉄-硫黄クラスターにその秘密があったと結論づけた。
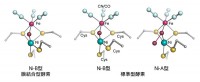
図3 膜結合型および標準型酵素のNi-Fe活性部位の比較
Ni-A型は、NiとFeの間に2原子分子(あるいはその水素化分子)がブリッジ配位子として結合するが、Ni-B型は単原子(あるいはその水素化分子)が結合している。標準型酵素のNi-Fe活性部位は、Ni-A型とNi-B型の両方を示すが、膜結合型は、空気酸化型、[K3Fe(CN)6]酸化型の両者ともにNi-B型のみを示した。これは電子スピン共鳴法による実験結果と矛盾しない。オレンジ色はFe、黄色はシステイン残基側鎖のS、緑色はNi、赤色はO、水色はFeに配位する2原子分子を示す。
基質である水素はタンパク質中の奥深い内部のNi-Fe活性部位で分解されて電子とプロトンになる。電子は、上記のように鉄−硫黄のクラスターを通って分子外部の電子伝達タンパク質とやりとりされる。一方、プロトンはタンパク質中の水素結合ネットワークを通して分子外部の溶媒に渡される。このプロトン伝達経路の全容は未だ確定されていないが、活性部位から最初にプロトンを受け取るのはCys590(L)で、それに続いてGlu28(L)であるという説は最も広く受け入れられている[13, 14][13]J. C. Fontecilla-Camps, A. Volbeda, C. Cavazza and Y. Nicolet: Chem. Rev. 107 (2007) 4273-4303.
[14]V. H. Teixeira, C. M. Soares and A. M. Baptista: Proteins 70 (2008) 1010-1022.。これは、これら2つの残基の構成原子が高い温度因子をもっていることと、これらの残基を他の残基に置換することで酵素活性が大きな影響を受けたという実験結果により支持されている。これに続くプロトン伝達経路については、2通りが提案されている。ひとつは、近位の鉄-硫黄クラスターを通る経路で、もうひとつはカルボキシ末端のHis596(L)を通って、Mg原子に至る経路である。このうち、本膜結合型[NiFe]ヒドロゲナーゼでは、カルボキシ末端のHis596(L)を通る水素結合ネットワークは途中で遮断されている。これに対して、近位の鉄-硫黄クラスターを通る経路は、本酵素でも保存されており、しかも興味深いことにこの経路は、近位の鉄-硫黄クラスターの配位子であるCys26(S)のアミド窒素に繋がっている。つまり本研究で注目している[4Fe-3S]クラスターのひとつの鉄原子(Fe2)に配位結合する窒素原子である。これは、本酵素の触媒活性により駆動されるプロトン・電子移動が、鉄-硫黄クラスターの酸化還元システムと共役し得ることを示唆するものであろう。
まとめ
膜結合型[NiFe]ヒドロゲナーゼの空気酸化型、水素還元型および[K3Fe(CN)6]酸化型の高分解能X線結晶解析を行ったところ、酵素分子がもつ3個のクラスターのうちの1つは新規の構造をもった[4Fe-3S]-6Cys型であることを見出した。このクラスターは、酵素が水素の分解を触媒している間は、一般的な[4Fe-4S]-4Cysタイプのクラスターと同様に2つの酸化還元状態を行き来して電子の流れを制御する。ヒドロゲナーゼが酸素にさらされると、酸素分子がNi-Fe活性部位に結合し、標準型酵素は不活性な状態になる。しかし、酸素耐性をもつ膜結合型酵素は、[4Fe-3S]-6Cysタイプのクラスターが構造変化をおこして超酸化状態になり、Ni-Fe活性部位にさらに電子を渡すことができる。これによって、Ni-Fe活性部位に結合した酸素分子は速やかに分解されると考えられる。クラスターの構造変化は主鎖のアミド窒素原子の脱プロトンをともない、これにより活性部位に電子を渡すこと、すなわち3つの酸化還元状態をとることが可能になる。これは生体高分子に見られる電子伝達体としては極めて希な例である。
今回の結果は、酵素中で電子伝達体としてのみはたらくと考えられていた鉄-硫黄クラスターが、酸化還元依存的な構造変化をともなうことによって、いわば電子の流れのスイッチとしての機能を併せもち、酵素の機能を守るための役割も担っていることを明らかにした。また、結晶構造に基づいた同酵素の酸素耐性機構の詳細なモデルを世界で初めて提唱した。ヒドロゲナーゼが触媒する水素分解や水素合成のメカニズムについては未だ不明な点が多いが、その巧妙な「しくみ」の理解は、より効率的な水素エネルギー利用に関する研究・開発に重要な情報を提供する。特に今回の研究成果は、ヒドロゲナーゼの酸素による機能の損失を克服するために重要な知見であるとともに、この情報を基にした新たな合成触媒などの開発につながると期待される。
謝辞
本研究は、茨城大学農学部の西原宏史准教授および尹基石特任准教授(現・九州大学大学院工学府 特任准教授)と著者らとの共同研究の成果である。本研究に関するX線回折実験は、BL44XU(課題番号2010A/B6520)およびBL41XU(課題番号2010A1223)で行った。なお、本研究の一部は、文部科学省のグローバルCOEプログラム(樋口)と科学研究費((20051022(庄村)、22770111(庄村)、18GS0207(樋口))、日本科学技術振興機構の科学研究費(20580094(西原)、22370061(樋口)、22657031(樋口))、兵庫県立大学およびひょうご科学技術協会の若手研究費(庄村)、科学技術振興機構の戦略的創造研究推進事業(樋口)、宇宙航空研究開発機構(樋口)からの助成事業により行われた。
参考文献
[1]P. M. Vignais and B. Billoud: Chem. Rev. 107 (2007) 4206-4072.
[2]H. Ogata, W. Lubitz and Y. Higuchi: Dalton Trans. (2009) 7577-7587.
[3]M. Brugna-Guiral et al.: Extremophiles 7 (2003) 145-157.
[4]E. Van der Linden et al.: J. Biol. Inorg. Chem. 9 (2004) 616-626.
[5]K. S. Yoon, K. Fukuda, K. Fujisawa and H. Nishihara: Int. J. Hydrogen Energy 36 (2011) 7081-7088.
[6]Y. Shomura, K. Hagiya, K. S. Yoon, H. Nishihara and Y. Higuchi: Acta Crystallogr. F67 (2011) 827-829.
[7]Y. Shomura, K. S. Yoon, H. Nishihara and Y. Higuchi: Nature 479 (2011) 253-257.
[8]J. W. Peters et al.: Biochemistry 36 (1997) 1181-1187.
[9]J. M. Berrisford and L. A. Sazanov: J. Biol. Chem. 284 (2009) 29773-29783.
[10]M. E. Pandelia et al.: J. Am. Chem. Soc. 132 (2010) 6991-7004.
[11]T. Goris et al.: Nat. Chem. Biol. 7 (2011) 310-318.
[12]W. Lubitz, E. Reijerse and M. van Gastel: Chem. Rev. 107 (2007) 4331-4365.
[13]J. C. Fontecilla-Camps, A. Volbeda, C. Cavazza and Y. Nicolet: Chem. Rev. 107 (2007) 4273-4303.
[14]V. H. Teixeira, C. M. Soares and A. M. Baptista: Proteins 70 (2008) 1010-1022.
樋口 芳樹 HIGUCHI Yoshiki
兵庫県立大学大学院 生命理学研究科 生体物質構造学Ⅰ分野
〒678-1297 兵庫県赤穂郡上郡町光都3-2-1
TEL:0791-58-0179
e-mail:hig@sci.u-hyogo.ac.jp
庄村 康人 SHOMURA Yasuhito
兵庫県立大学大学院 生命理学研究科 生体物質構造学Ⅰ分野
〒678-1297 兵庫県赤穂郡上郡町光都3-2-1
TEL:0791-58-0562
e-mail:shomura@sci.u-hyogo.ac.jp








