Volume 09, No.2 Pages 114 - 118
3. 最近の研究から/FROM LATEST RESEARCH
光合成電子伝達で働く巨大分子複合体チトクロムb6fの立体構造
Crystal Structure of Cytochrome b6fComplex of Oxygenic Photosynthesis
大阪大学 蛋白質研究所 Institute for Protein Research, Osaka University
- Abstract
- The photosynthetic unit of oxygenic photosynthesis is organized as two large multimolecular membrane complexes, photosystem II (PSII) and photosystem I (PSI). The two photosystems operate in series linked by a third multiprotein complex called the cytochrome b6f complex. The cytochrome b6f complex is a membrane-spanning protein complex embedded in a thylakoide membrane of photosynthetic organisms. The b6f complex arranges the electron transfer between plastoquinol reduced by PSII and an electron carrier protein plastocyanin that connects to PSI. The structure of the b6f complex from cyanobacterium M. laminosus was solved at 3.0 Å resolution by isomorphous replacement method and multiwavelength anomalous diffraction from native iron atoms. The crystal structures of the cytochrome b6f complex complete the description of the architecture of the oxygenic photosynthetic electron transport chain, since three-dimensional structures have been provided for two photosystems.
1.はじめに
地球上の多くの生物は光合成に依存して生活している。光合成のうち光エネルギーを化学エネルギーに変換する光合成電子伝達は地球上で最も重要な化学反応の一つであると言えよう。高等植物やラン藻などが行う酸素発生型の光合成電子伝達では、水を酸化して酸素を発生する光化学系Ⅱと、CO2などを同化する還元力を生み出す光化学系Iの2種類の膜蛋白質複合体が、チトクロムb6f複合体を介してチラコイド膜上で直列に繋がった構成となっている(図1)。光合成電子伝達は植物生理学的にも生化学的にも多くの知見があり、反応を構成する蛋白質群は古くから結晶構造解析のターゲットとして多くの構造研究がなされてきた。筆者らも2001年に光合成電子伝達の末端で働く電子伝達蛋白質フェレドキシンとフェレドキシン依存性酵素複合体の結晶構造をSPring-8の放射光を利用することにより報告している [1, 2] [1]G. Kurisu et al. : Nature Struct. Biol., 8 (2001) 117-121.
[2]栗栖源嗣、楠木正巳:SPring-8利用者情報、Vol.6, No.3 (2001) 218-222.。2001年以降、好熱性ラン藻由来の光化学系Ⅰ [3] [3]P. Jordan et al. : Nature, 411 (2001) 909-917.およびⅡ [4, 5] [4]A. Zouni et al. : Nature, 409 (2001) 739-743.
[5]N. Kamiya and J-. R. Shen : Proc. Natl. Acad. Sci., 100 (2003) 98-103.の結晶構造が次々に報告され、光化学系Ⅱの高分解能構造解析というテーマは残っているものの、全体構造という点ではチトクロムb6f複合体が最後に残された立体構造不明の蛋白質であった。チトクロムb6f複合体は、葉緑体のチラコイド膜およびラン藻の光合成膜中に存在し、2量体あたり16個のサブユニットを含む分子量22万の超分子複合体である。b6f複合体は光化学系Ⅱで光還元された脂溶性プラストキノンから電子伝達蛋白質プラストシアニンへと電子を伝達するが、この電子伝達と共に膜のストローマ側(n-サイド)からルーメン側(p-サイド)へとH+を輸送するポンプの役割も担っている [6] [6]W. A. Cramer and D. B. Knaff : Energy Transduction in Biological Membranes, chap. 6 (1991) Springer-Verlag, New York.。
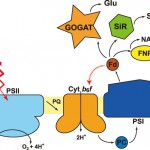
図1 光合成電子伝達を構成する蛋白質群とその周辺の蛋白質を示した模式図
光化学系Ⅱ(PSII)、チトクロムb6f複合体(Cytb6f)、プラストシアニン(PC)、光化学系Ⅰ(PSI)、フェレドキシン(Fd)、フェレドキシン-NADP+還元酵素(FNR)、亜硫酸還元酵素(SiR)、グルタミン酸合成酵素(GOGAT)を示している。
昨年11月に筆者を含む米国のグループとフランスのDaniel Picot等のグループが、相次いでチトクロムb6f複合体の立体構造を報告した。我々は好熱性ラン藻由来の複合体をSPring-8およびAPSの放射光を使い3.0Å分解能で [7] [7]G. Kurisu, H. Zhang, J. L. Smith and W. A. Cramer : Science, 302 (2003) 1009-1014.、フランスのグループはESRFの放射光を利用しクラミドモナス由来の複合体を3.1Å分解能で構造解析した [8] [8]D. Stroebel, Y. Choquet, J-. L. Popot and D. Picot : Nature, 426 (2003) 413-418.。光化学系ⅠおよびⅡの結晶構造も好熱性ラン藻由来なので、結果的にラン藻では膜上で起こる光合成電子伝達反応の構成成分すべての立体構造が明らかになったことになる。両グループにより報告されたラン藻およびクラミドモナス由来b6f複合体の結晶構造を比較したところ、非常に良く似た構造をしており本質的に同じ構造であると考えられる。本稿では筆者が構造解析に携わった好熱性ラン藻由来のチトクロムb6f複合体の結晶構造を基に複合体周辺の電子伝達について最新の知見を紹介したいと思う。
2.結晶化と構造解析
可溶性蛋白質と比べて膜蛋白質の構造解析例が極端に少ない第一の理由は、膜蛋白質の精製・結晶化が非常に難しいからであろう。我々が構造解析に用いた好熱性ラン藻M. laminosus由来のb6f複合体は、界面活性剤で可溶化した後も高い電子伝達活性を有し、結晶化に十分な純度で再現性よく精製する方法が確立されていた。筆者がチトクロムb6f複合体の構造解析を目指して渡米した時点では、構造解析可能なb6f複合体の結晶は得られていなかったが、あきらめずに構造解析を目指してM. laminosus由来b6f複合体の結晶化条件の検討を行ったところ、精製の最終段階で均質な合成脂質を添加剤として加えた時に良質の結晶を得ることができた(図2) [9] [9]H. Zhang, G. Kurisu, J. L. Smith and W. A. Cramer : Proc. Natl. Acad. Sci. USA., 100 (2003) 5160-5163.。

図2 好熱性ラン藻由来チトクロムb6f複合体の結晶
米国と日本の大型放射光施設(APSおよびSPring-8)のビームライン(SBC-19IDおよび阪大蛋白研ビームライン)を用いてb6f複合体結晶のX線回折強度データを収集し、重原子同型置換法と多波長異常分散法を用いて立体構造を解析した [7] [7]G. Kurisu, H. Zhang, J. L. Smith and W. A. Cramer : Science, 302 (2003) 1009-1014.。構造の精密化には3種類の結晶からの回折強度データを使用した。まずNative結晶を3.4Å分解能で、次に臭素を含む小型の基質アナログ(DBMIB)複合体結晶の構造を3.4Å分解能で、最後に基質とほぼ同じ分子サイズを持つアナログ(TDS)複合体結晶の構造を3.0Å分解能で構造決定した。立体構造を決定した蛋白質分子のサイズは膜のルーメン側(p-サイド)で約120×75Å、膜貫通部分で約90×55Åであった(図3)。
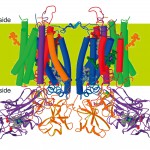
図3 好熱性ラン藻由来チトクロムb6f複合体の結晶構造
ヘムx(茶色)、クロロフィル(緑色)、β-カロテン(黄色)も合わせて表示している。
チラコイド膜を貫通する膜貫通領域は2量体あたり26本の膜貫通ヘリックスから構成されている。膜貫通領域中に電子密度図から3種の補欠分子族を同定した。サブユニットⅣの2つのヘリックスに挟まれる形でクロロフィル分子を確認し、b6f分子の外側に突き出る形でβ-カロテン分子を同定した。さらに、すでに分光学的な研究がある2つのb型ヘム(heme bpおよびheme bn)以外に膜貫通領域のストローマ側の端にもう一つ余計なヘムも発見した。この初めて同定された新しいヘムは5配位型で、配位子がb型ヘム(heme bn)のプロピオネイト基に結合した水分子(またはOH-)であるという非常に新奇なものであった。さらに興味深いことにc型ヘムのようにチトクロムb6のCys35とヘムのビニル基がチオエーテル結合していたのである。我々はこのヘムを既存のカテゴリーに分類できない新しいヘムであると結論付けて、投稿論文中で“ヘムx”と名づけることにした [7] [7]G. Kurisu, H. Zhang, J. L. Smith and W. A. Cramer : Science, 302 (2003) 1009-1014.。
なぜこのヘムxは長い間存在が確認されなかったのであろうか。答えは2つあると考えられる。第一に「ミトコンドリア呼吸鎖に存在する進化的に相似なチトクロムbc1複合体と同じである」という強い固定概念。第二に「膜からの可溶化、精製の難しさ」である。ヘムxを発見した後に、b6f複合体に関する分光学の論文を確認したが、その幾つかに5配位型ヘムに見られるHigh Spinシグナルの存在を記述している物があった(10%程度) [10] [10]V. Schunemann, A.X. Trautwein, J. Illerhaus and W. Haehnel : Biochemistry, 38 (1999) 8981-8991.。しかし精製の難しさを踏まえて、それは不純物由来もしくは部分分解したb型ヘム由来のシグナルであろうと結論していた。プロテオミクス研究においても同様である。実際にはマススペクトルの分子量でヘム1つ分の分子量差が観測され [11] [11]J. P. Whitellegge, H. Zhang, R. Taylor and W. A. Cramer : Mol. Cell. Proteomics, 1 (2002) 816-827.、電気泳動ゲルをヘムで染色するとチトクロムb6に対応するバンドが染色されていた。これらの場合も部分的に分解されたb型ヘムが残っている物として十分な考察がされていなかったのである。
3.立体構造から推測するチトクロムb6f周辺の電子伝達
2量体として存在しているチトクロムb6f複合体のモノマーの間に大きなキャビティーが存在している。膜貫通部分にあるこのキャビティーには基質であるプラストキノンおよび結晶化の際に加えた基質アナログTDSが結合していた(図4)。チトクロムb6f複合体は膜中に2つのキノン結合サイト(QpサイトとQnサイト)を持ち、Qサイクルと呼ばれるメカニズムで機能している [6] [6]W. A. Cramer and D. B. Knaff : Energy Transduction in Biological Membranes, chap. 6 (1991) Springer-Verlag, New York.。Qサイクルでは膜のp-サイドに還元状態のプラストキノールが結合し、電子と共にH+を放出し、膜のn-サイドに酸化状態のプラストキノン(又はプラストセミキノン)が結合しbnヘムから電子を受け取ると同時にH+を汲み上げる。結果的に電子伝達と共にH+を膜のn-サイドからp-サイドへと運ぶことになる。我々は構造中でQpサイトとQnサイトの両方へ基質が結合した状態を見ることができた。このキャビティーがキノン交換キャビティーであることが実験的に確認できたと考えている。もう一つの基質アナログであるDBMIBは小型の分子であるため、キャビティーよりもさらに奥まったところに結合していた。DBMIBが結合していたのはサブユニットIVにある保存配列-PEWY-の近傍であり、チトクロムbc1で考えられているようにこの保存配列がH+を放出する際に重要な役割を担っているのかもしれない。
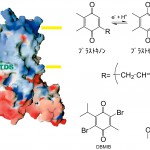
図4 基質であるプラストキノンと基質アナログ(TDS)の結合サイトとそれらの化学構造
ヘムxおよびクロロフィル、βカロテンは生理的にどう言う役割を担っているのであろうか。ヘムxは膜貫通領域のストローマ側の端に位置し、ミトコンドリア呼吸鎖のチトクロムbc1複合体には存在しないことから、光合成に特有のフェレドキシン依存性循環電子伝達に関与している可能性が高いと考えられる。光合成の研究分野では古くからチラコイド膜上にフェレドキシン依存性のプラストキノン還元反応が存在することが知られていた。植物やラン藻は生育環境によってATPを過剰に必要とする場合、フェレドキシンからプラストキノンへと電子を循環させH+の濃度勾配のみを形成する仕組みをもっているのである(図1)。しかし、ゲノムの時代になってもこの反応を触媒する酵素(フェレドキシン-プラストキノン還元酵素)は発見されていなかった。チトクロムb6f複合体のストローマ側の分子表面は非常に塩基性でLysやArgなどの塩基性のアミノ酸が多く配置している(図4)。フェレドキシンはAspやGluの多い酸性蛋白質なので直接b6f複合体とフェレドキシンが相互作用する可能性も考えられる。また他の蛋白質を介した電子伝達カスケードが存在する可能性も否定できない。高等植物ではフェレドキシン-NADP+還元酵素(FNR)がb6f複合体のサブユニットとして存在しているという報告もあり [12] [12]H. Zhang, J. P. Whitelegge and W. A. Cramer : J. Biol. Chem., 276 (2001) 38159-38165.、ヘムxがフェレドキシン用のヘムであると言う仮説は大変興味深いところである。
一般にクロロフィルは光エネルギーを吸収するアンテナの役割を担うが、光に依存しないチトクロムb6f複合体の反応系ではアンテナの役割は必要としない。そこで我々はクロロフィルが構造形成の為だけにb6f複合体に取り込まれている可能性を指摘している。膜貫通ヘリックス3本からなるサブユニットIVの2本のヘリックスに挟まれる形で膜の中央に存在するクロロフィルが無ければ、明らかにサブユニットIVのヘリックスは構造的に不安定化するであろう。βカロテンについても同様な構造上の役割を担っていると考えている。PetGおよびPetLと呼ばれる小さなサブユニットの間でサブユニット同士が正しい相対位置に取り込まれるためのスペーサーになっているのであろう。
4.おわりに
最近になって高等植物由来の光化学系Ⅰの結晶構造が4.4Å分解能で解析された [13] [13]A. Ben-Shem, F. Frolow and N. Nelson : Nature, 426 (2003) 630-635.。高等植物の光化学系Iは3量体構造を取らず、LHC1と結合した状態で存在しプラストシアニンとの結合に有利なサブユニット構造を取っていると報告されている。高等植物では葉緑体中のチラコイド膜の形態にもバラツキがあり、ラメラ構造を取る領域では光化学系Ⅱとb6f複合体が、それ以外の領域では光化学系Ⅰとb6f複合体が多いと言われている。また先に述べたとおり高等植物のチトクロムb6f複合体ではラン藻と異なりFNRがb6f複合体のサブユニットとなっていることも報告されている [12] [12]H. Zhang, J. P. Whitelegge and W. A. Cramer : J. Biol. Chem., 276 (2001) 38159-38165.。高等植物とラン藻の光合成電子伝達において、分子レベルで異なった生理機能の制御が行われている可能性があるとするとヘムxやクロロフィルは高等植物の複合体中で主に働くということも考えられる。今後、高等植物由来の光化学系Ⅱおよびチトクロムb6f複合体の結晶構造が明らかになると、そのあたりの仮説が明らかになることであろう。
筆者はPSIからの光還元力がフェレドキシンを分岐点にして色々な代謝反応に分配される仕組みを立体構造の観点から探ってきた(図1)。チトクロムb6f複合体がフェレドキシン-プラストキノン酸化還元酵素として機能しているのであれば、FNRや亜硫酸還元酵素らと同様にフェレドキシンとチトクロムb6f複合体が電子伝達複合体を形成する可能性が出てくる。これまでそのような観点でチトクロムb6f複合体を捕らえた生化学的な実験は行われておらず、現在筆者等のグループでチトクロムb6f複合体とフェレドキシンの相互作用を確認する実験を計画中である。光合成電子伝達は反応を構成するすべての蛋白質の結晶構造が明らかになった初めての膜上反応系である。原子レベルで構造を精密に見て、原子レベルでの知見と一連の生理機能とをすべて関連付けて考察することが初めて可能になったと言える。今後、立体構造と生理機能との相関の解明が飛躍的に進むことが期待される。
最後に、本研究は筆者が文部科学省在外研究員として米国に滞在していた際に行った研究の一部であり、米国Purdue大学生物科学科のH.Zhang博士、J.L.Smith教授、W.A.Cramer教授との共同研究の一部である。X線回折実験ではAPSの構造生物学ビームライン(SBC)とSPring-8の生体超分子ビームライン(阪大蛋白研)のスタッフの皆さんの協力を得た。この場を借りて感謝したい。
参考文献
[1]G. Kurisu et al. : Nature Struct. Biol., 8 (2001) 117-121.
[2]栗栖源嗣、楠木正巳:SPring-8利用者情報、Vol.6, No.3 (2001) 218-222.
[3]P. Jordan et al. : Nature, 411 (2001) 909-917.
[4]A. Zouni et al. : Nature, 409 (2001) 739-743.
[5]N. Kamiya and J-. R. Shen : Proc. Natl. Acad. Sci., 100 (2003) 98-103.
[6]W. A. Cramer and D. B. Knaff : Energy Transduction in Biological Membranes, chap. 6 (1991) Springer-Verlag, New York.
[7]G. Kurisu, H. Zhang, J. L. Smith and W. A. Cramer : Science, 302 (2003) 1009-1014.
[8]D. Stroebel, Y. Choquet, J-. L. Popot and D. Picot : Nature, 426 (2003) 413-418.
[9]H. Zhang, G. Kurisu, J. L. Smith and W. A. Cramer : Proc. Natl. Acad. Sci. USA., 100 (2003) 5160-5163.
[10]V. Schunemann, A.X. Trautwein, J. Illerhaus and W. Haehnel : Biochemistry, 38 (1999) 8981-8991.
[11]J. P. Whitellegge, H. Zhang, R. Taylor and W. A. Cramer : Mol. Cell. Proteomics, 1 (2002) 816-827.
[12]H. Zhang, J. P. Whitelegge and W. A. Cramer : J. Biol. Chem., 276 (2001) 38159-38165.
[13]A. Ben-Shem, F. Frolow and N. Nelson : Nature, 426 (2003) 630-635.
栗栖 源嗣 KURISU Genji
大阪大学 蛋白質研究所
〒565-0871 大阪府吹田市山田丘3-2
TEL:06-6879-8634 FAX:06-6879-8636
e-mail: kurisu@protein.osaka-u.ac.jp
略歴:
1992年 大阪大学 工学部 応用精密化学科卒業
1997年 大阪大学大学院 工学研究科 博士課程修了
1997年 博士(工学)取得
1997年〜現在 大阪大学蛋白質研究所 助手
2002年〜2003年 文部科学省在外研究員(米国Purdue大学)








