Volume 08, No.5 Pages 348 - 353
2. 最近の研究から/FROM LATEST RESEARCH
ヒト心筋トロポニンの結晶構造
Crystal structure of the core domain of human cardiac troponin
[1]国立循環器病センター研究所 心臓生理部 Department of Cardiac Physiology, National Cardiovascular Center Research Institute、[2]理化学研究所 播磨研究所 構造生物化学研究室 Laboratory of Structural Biochemistry, Riken Harima Institute
- Abstract
- Troponin (Tn) plays key roles in the Ca2+ regulation of skeletal and cardiac muscle contraction. It consists of three subunits (TnT, TnC and TnI), and, together with tropomyosin (Tm), is located on the actin filament. We have solved crystal structures of the core domains (relative molecular mass of 46kDa and 52kDa) of human cardiac Tn in the Ca2+-saturated form. The structures reveal that the core domain is further divided into structurally distinct sub-domains that are connected by flexible linkers, making the entire molecule highly flexible. The α-helical coiled-coil formed between TnT and TnI is integrated in a rigid and asymmetric structure (about 80Å long), the IT-arm, which bridges putative Tm-anchoring regions. The structures of Tn ternary complex imply that the Ca2+-binding to the regulatory site of TnC removes the C-terminal portion of TnI from actin/Tm, thereby alters the flexibility of Tn/Tm on the actin filament.
1.はじめに
骨格筋と心筋は横紋構造を持ち、2種類の繊維、「太い繊維」と「細い繊維」が互いに滑りあうことで張力を発生する。「太い繊維」はモータータンパク質ミオシンからなり、ATPの加水分解エネルギーを力学エネルギーに変換する機構を持つ。「細い繊維」はアクチンおよび調節タンパク質であるトロポニン、トロポミオシンからなり、それらが7対1対1のモル比で結合し、らせん状の繰り返し構造によりタンパク質線形超分子複合体を形成している(図1)。1960年代に江橋節郎らによって筋収縮弛緩のカルシウム調節機構が発見され、同時にその中心となるタンパク質、トロポニンが発見された[1]。江橋らの研究は生体内で働くカルシウムイオンの役割をはじめて示したものであり、医学・生物学の進展に大きな影響を及ぼした。トロポニンは3つのポリペプチド、TnT、TnIおよびTnCで構成され、それぞれ「トロポミオシン結合」、「アクトミオシン相互作用阻害」および「カルシウム結合」の役割を主に分担する[2]。トロポミオシンは分子のほぼ全長約40nmがαヘリカルコイルドコイルからなり、アクチンらせんに沿って存在する。筋細胞内のカルシウム濃度が上昇するとTnCによって感知され、TnI、TnTおよびトロポミオシンを介し「細い繊維」全体の構造変化を引き起こし、ミオシンを活性化し筋肉は収縮する。TnCはカルシウム結合モチーフであるEF-handを4つ持ち、それぞれ2つずつが球状ドメインを形成し、ダンベル構造を持つ[3,4](図2)。これらの球状ドメインの内、分子のN末端側のドメインへのカルシウムイオンの結合・解離が筋収縮弛緩の調節に直接関与すると考えられているが、そのメカニズムの詳細は明らかでない。本研究では筋収縮調節の分子メカニズムを明らかにするため、トロポニンのコアドメインのX線結晶構造解析を行なった。本稿では結晶構造から得られた新たな知見を解説すると共に、原著論文で詳しく触れなかった研究過程での工夫点についても触れることにする。
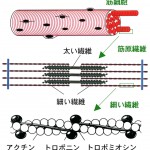
図1 筋肉の模式図
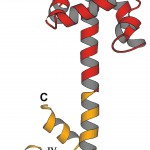
図2 TnC単独の結晶構造
2.トロポニンの結晶化
トロポニンは筋肉より比較的簡単に大量に得ることが出来、例えば材料としてウサギを用いた場合、2日間の作業で約1gのタンパク質標品を得ることが出来る。しかし、筋肉より調製したトロポニンには多くのアイソフォームが存在し、これが結晶化の妨げとなっていた。我々はヒト心筋、ウサギ骨格筋およびニワトリ骨格筋cDNAより大腸菌による大量発現系を構築し、結晶化試料を調製した。これらの内、ヒト心筋型とウサギ骨格筋型については結晶化に成功し、今回ヒト心筋型について構造決定に至った(ウサギ骨格筋型は分解能が8Å程度と十分でなかった)。このように異なる種の試料を用意してスクリーニングすることは良質の結晶を得るための有効な手段である。また、3つのサブユニットはあえて共発現せず、それぞれ高純度の標品が得られるよう工夫を行なった。酸化しやすいシステイン残基のアラニンあるいはセリン残基への置換(ヒト心筋型ではTnC、TnIについてそれぞれ2箇所ずつ)、リンカー部あるいは不安定と考えられる部分[5]の系統的な切除(TnTのN末側、TnIのN末端およびC末端)等の変異の導入である。また、TnTについては全長分子としてインクルージョンボディに発現させ、精製後CNBr切断によりC末側断片を得て結晶化に用いているが、酵素分解でなく化学切断法を用いることで高純度の試料を得ることに成功した。この方法はシステイン残基の化学切断[6]と共にリフォールディングが可能なタンパク質断片を得る方法として有効であろう。個別に発現精製した各サブユニットを6Mグアニジン塩酸中で混合し、徐々にイオン強度を下げることでリフォールドさせ、等モル比で結合した複合体をイオン交換カラムで分離し、結晶化標品とした。様々な複合体試料を調製し、結晶化条件のスクリーニングを行なった結果、ヒト心筋型Tn複合体、コアドメインTn46K(分子量約46キロダルトン)およびTn52K(分子量約52キロダルトン)について結晶を得て、構造解析を行なった。
3.構造解析
結晶を得たが、構造解析を行なう上で大きな障害があった。Tn46KおよびTn52Kはいずれも単斜晶系(P21)で、非常に良く似た格子を持つが、共に単結晶が得られる確率が極めて低い。光学顕微鏡での結晶の観察とX線の回折像から、結晶中でb軸(21らせん軸)の反転が高頻度で起こっていることが判明した(図3)。単斜晶系であるため完全な双晶ではなく、b軸を共有した複数の部分結晶の集合体ということである。例えば図3Bのような結晶からは特定の反射点を共有した2つ(またはそれ以上)の結晶由来の重なった回折像が観察される。この兆候が見られる結晶ではいかに領域を限ってX線を当ててもデータを収集することは不可能であった。話は前後するが、構造解析の結果から非対称単位に存在する2分子の非結晶学的二回対称(NCS)軸が結晶のb軸およびc軸とほぼ直交して存在することが判明している(図4)。トロポニン分子は2つのサブドメインから成るが、これらが柔軟なリンカー構造で結び付けられているため、NCSの関係にある2分子はサブドメイン間の関係が若干異なる(後述)。この差異が原因となり約100度のベータ角を生じるのだが、結晶成長過程でのa軸方向の積み方の誤りがb軸を反転させた部分を生むようである。結晶化母液にグリセロールを加えるなどして単結晶が得られる確立を高めたが、数百のハンギングドロップから最終的にデータ測定の出来るものが1〜2個得られる、という非常に厳しい状況であった。何とかTn46Kの単結晶を得てBL44B2にて2.8Å分解能のNativeデータを得て構造解析に着手したのだが、分子置換法(既知のTnCおよびTnIの部分構造を用いた)による位相決定は出来なかった。そこで次のように2通りの方法でMAD法に用いる結晶を準備し解析を行なった。まず、ソーキングによる重原子検索を行なった。単結晶が得られにくい、ということから有色の重原子溶液で結晶が染まるかという点に着目しスクリーニングを行ない、塩化オスミウムの置換体を得た。最終的にはBL45XU-PXで得た3.3Å分解能のオスミウムMADデータから解釈できる電子密度図を得ることが出来、分子モデルの構築を開始した。一方で、トロポニンの4つのEF-handには様々な2価および3価の陽イオンが結合する点に着目した。TnC単体の結晶はCd、Hgおよびランタノイド等によるMIRにより構造解析されたが[3,4]、残念ながらTn46Kの結晶ではソーキング法ではこれらの重原子は入らない、もしくは結晶を劣化させることが判明した。そこで、試料調製時からカルシウムイオンのかわりにストロンチウムイオンを結合させて結晶を調製しBL44B2を利用し2.8Å分解能のMADデータを得た。異常分散差パターソン図からはカルシウム結合サイトに結合したストロンチウムイオンのシグナルが検出された(図5)。結果的にはストロンチウムのMADデータからはオスミウム置換体のものよりも良い位相情報を得ることが出来た。ストロンチウムはランタノイドほどタンパク質を凝縮させず、K殻吸収端波長も0.77Å(16keV)程度とSPring-8の各ビームラインで比較的データの取りやすい領域にあり、また得られる異常分散シグナルもセレンと同程度である。EF-hand型カルシウム結合モチーフを持つタンパク質には試料調製時から結合させることが出来、その試料の扱いが容易という点で非常に有効である。最終的にはBL41XUにてTn46KおよびTn52Kそれぞれ2.6Åおよび3.3Å分解能のNativeデータを得て、Tn52KについてはTn46Kをモデルとした分子置換法で解き、それぞれ構造精密化を行なった[7]。

図3 ヒト心筋トロポニン(Tn46K)の結晶。多くの場合、複数の結晶の集合体として成長しデータ収集には使えない(A)。結晶の外形と結晶のb軸(21らせん軸)の関係(B)。この場合、b軸の反転した2つの結晶の集合体として成長している。
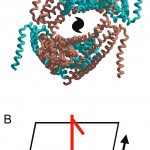
図4 b軸(21らせん軸)から見た分子のパッキング(A)と結晶格子およびNCS軸の関係(B)。結晶の21らせんで関係付けられる分子を同じ色で示す。分子のパッキングからa軸方向への結晶成長の誤り(水色分子が来るべき所に橙色分子の形状で積層する。当然その逆も同時に起こる)がb軸を反転させる原因と考えられる。
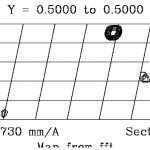
図5 ストロンチウム置換体結晶より得たPeak波長での異常分散差パターソン図。
4.トロポニン・コアドメインの結晶構造
コアドメインTn52Kはトロポニン分子全体よりTnTのトロポミオシン結合に関わるN末端部(TnT1)とTnIの心筋特異的なN末端配列を切除したものであり、Tn46KはこれからさらにTnIのC末端部57アミノ酸残基を切除したものである。結晶はカルシウムイオン存在下で得られたので、今回の構造は筋の収縮時に相当する。コアドメインは長いαへリックスより成るサブドメインIT-armと調節に直接関わるカルシウム結合サイトIIを含むサブドメイン、調節頭部(Regulatory head)で構成される(図6)。IT-armはTnTとTnIの各45アミノ酸残基からなるαヘリカルコイルドコイルを含む約80Åの長さの細長い構造体である。調節頭部は結合サイトIIにカルシウムイオンを結合することで生じたTnCの疎水性領域にTnIの両親媒性αへリックスH3(I)が結合したものであり(図7)、この構造とこれまでの知見[5,6,8]からH3(I)とTnCの結合の変化がカルシウムイオン濃度に応じたスイッチとして機能することが示唆される。即ち、結合サイトIIからカルシウムイオンが遊離すると、H3(I)がTnCから離れ、TnIのC末端部の構造変化が誘起されると考えられる(後述)。TnCのN末およびC末ドメインはそれぞれ調節頭部およびIT-armの一部を構成し、TnC単体の構造(図2)では連続したαへリックスであったD/Eリンカー部が解け、既知のTnC[3,6]とは異なるドメイン間の位置関係を取っていた。さらに、先に少し触れたようにTn46KおよびTn52Kからそれぞれ2分子、計4分子の構造を決定したが、4分子全てでサブドメイン間の位置関係が異なっていた(図8)。これはサブドメイン間のリンカーが柔軟な構造であるため、結晶格子によりサブドメイン間の位置関係が決定されているものと考えられる。一方、それぞれのサブドメインの構造は変わらないことから、それぞれのサブドメインがユニットとして機能することが示唆された。
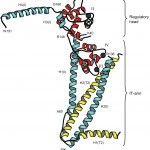
図6 Tn52Kのリボンモデル
TnT(黄色)、TnI(水色)、TnC(赤色)
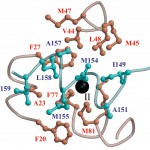
図7 調節頭部でのTnC(ピンク)とTnI(水色)の相互作用
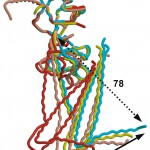
図8 構造決定した4分子の重ね合わせ
5.筋収縮調節のしくみ
最初に述べたようにトロポニンは主にTnTを介してトロポミオシンに結合するが、特にTnTのN末部(TnT1)およびC末部(C-TnT)が結合に関与し、IT-arm自体はトロポミオシンと強い相互作用はしないと考えられている。TnT1およびC-TnTは共に今回の結晶構造に含まれないが、IT-arm部のそれぞれ末端に位置することから約60Å隔てて結合する「橋渡し構造」が示唆された(図9)。TnT1とC-TnTは筋の収縮・弛緩の状態に関わらずトロポミオシンに結合すると考えられる。調節頭部はIT-armの橋渡し構造により、筋繊維に繋ぎ止められ、カルシウムイオン濃度に応じて調節領域のスイッチングを行なうと考えられる。TnIの分子中央部(心筋型では137〜146残基)にある「阻害領域(Inhibitory region)」からC末端部にかけてアクトミオシン相互作用の阻害に重要であることが確かめられ[5,9]、我々はこの領域を「調節領域(TnIreg)」と名づけた。今回の解析ではこの阻害領域とC末端部(192〜210残基)の電子密度は不明瞭でありモデルに組んでいない。調節領域は先に述べたスイッチ機構により筋の弛緩状態(結合サイトIIにカルシウムイオンが結合しない状態)では調節頭部より離れ、アクチン・トロポミオシンと結合し、逆に収縮時(カルシウムイオンの結合した状態)にはアクチン・トロポミオシンから遊離し今回の結晶構造のようにTnCに結合すると考えられる。弛緩時に調節領域がトロポミオシンをアクチンに強く結合させることがミオシンの結合を阻害するのに重要と考えられるが、結晶構造からさらに興味深いことが示唆された。TnIの調節領域とC-TnTはコイルドコイルを形成するαへリックスのそれぞれC末端側のすぐ下流に位置する。C-TnTの近傍で調節領域のアクチン・トロポミオシンへの結合・解離が行なわれることから、このコイルドコイルのC末端領域で構造変化が生じることが予測できる。我々はコイルドコイルのC末端部をピボットとしてIT-armの微小な回転運動が生じ、この情報がIT-armを介しTnT1に伝わるのではないかと考えている。実際、TnT1部を切除すると筋の活性化が減少することが知られ、調節頭部へのカルシウム結合の情報が何らかの方法でTnT1部に伝わることが示唆されている。トロポミオシンは分子のN末端とC末端が繋がった繊維としてアクチン繊維上に存在する。IT-armの動きによりトロポミオシン分子にゆがみを生じると、弦をつまんで捻る時のようにトロポミオシン繊維にかかる張力の変化となって表れるだろう。このような軸方向に情報が伝わるメカニズムは繊維状分子の調節機構として理にかなっているように思われ、今後検証すべき重要な課題と我々は考える。
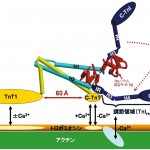
図9 トロポニンとトロポミオシンおよびアクチンとの相互作用
6.今後の展望
1970年代に筋繊維のX線繊維回折像を基に筋収縮調節機構を説明するモデルとして「立体障害仮説(Steric Blocking Theory)」が提唱され、広く引用されている[10]。この仮説ではアクチン繊維上においてトロポミオシン分子がカルシウム濃度依存的に方位角方向に位置を変えることでミオシンとの相互作用を立体障害的に阻害するというものであるが、未だこの仮説を実証するデータは得られていない。トロポミオシンの動きを支持するとされるX線繊維回折強度および電子顕微鏡像の変化についても、その解釈はトロポニンとトロポミオシンの質量分布がアクチンらせん対称性に完全に従っている、つまり一組のトロポニンとトロポミオシンの質量が7個のアクチンに沿って平均的に分布する、との誤った仮定に基づいている。今回トロポニンコアドメインの結晶構造が明らかになり、らせん対称を仮定した方法で検出できない局所的な構造変化の重要性が浮き彫りにされた。著者らは現在トロポニン・トロポミオシン複合体のX線結晶構造解析を進めているが、これによりトロポニンへのカルシウム結合によって誘起されるトロポミオシンの構造変化が捉えられることを期待している。
7.おわりに
我々の研究グループがこのプロジェクトを始めてから実に13年間の年月が過ぎ去っている。現在タンパク3000プロジェクトが進行中であるが、膜タンパク質をはじめ構造決定に至るのが非常に困難な標的タンパク質も多く存在し、それらは押し並べて生理的に重要であるものが多い。幸い、著者の一人は本研究の非常に重要な時期にさきがけ研究21の研究支援を受けることが出来、それを大きな励みに今回の結果に結びつけることが出来た。このような困難な課題に取り組む若手研究者を支援する助成プログラムが今後ますます充実することを望みたい。
本稿で紹介した研究は主として理化学研究所播磨研究所、構造生物化学研究室において行なわれたもので、同研究室研究員山下敦子博士ならび前田佳代博士との共同研究であり、科学技術振興事業団さきがけ研究21「形とはたらき」および文部科学省科学技術振興調整費の助成を受けたものである。
参考文献
[1]S. Ebashi, M. Endo and I. Otsuki:Control of muscle contraction. Q Rev Biophys 2(1969)351-84.
[2]I. Ohtsuki, K. Maruyama and S. Ebashi:Regulatory and cytoskeletal proteins of vertebrate skeletal muscle. Adv Protein Chem 38(1986)1-67.
[3]O. Herzberg and M. N. James:Structure of the calcium regulatory muscle protein troponin-C at 2.8 Å resolution. Nature 313(1985)653-9.
[4]M. Sundaralingam et al. : Molecular structure of troponin C from chicken skeletal muscle at 3-angstrom resolution. Science 227(1985)945-8.
[5]S. Takeda, T. Kobayashi, H. Taniguchi, H. Hayashi, and Y. Maeda:Structural and functional domains of the troponin complex revealed by limited digestion. Eur J Biochem 246(1997)611-7.
[6]D. G. Vassylyev, S. Takeda, S. Wakatsuki, K. Maeda and Y. Maeda:Crystal structure of troponin C in complex with troponin I fragment at 2.3-Å resolution. Proc Natl Acad Sci U S A 95(1998)4847-52.
[7]S. Takeda, A. Yamashita, K. Maeda and Y. Maeda:Structure of the core domain of human cardiac troponin in the Ca2+ -saturated form. Nature 424 (2003)35-41.
[8]M. X. Li, L. Spyracopoulos and B. D. Sykes:Binding of cardiac troponin-I147-163 induces a structural opening in human cardiac troponin-C. Biochemistry 38(1999)8289-98.
[9]C. S. Farah and F. C. Reinach:The troponin complex and regulation of muscle contraction. Faseb J 9 (1995)755-67.
[10]J. M. Squire and E. P. Morris:A new look at thin filament regulation in vertebrate skeletal muscle. Faseb J 12(1998)761-71.
武田 壮一 TAKEDA Soichi
国立循環器病センター研究所
心臓生理部
〒565-8565
大阪府吹田市藤白台5-7-1
TEL:06-6833-5012(内)2530
FAX:06-6835-5416
e-mail:stakeda@ri.ncvc.go.jp
略歴:
1991年 名古屋大学理学部生物学科卒業
1996年 名古屋大学大学院理学研究科生物学専攻 博士課程修了
1996年 松下電器産業㈱国際研究所 リサーチアソシエート
1997年 博士(理学)取得
1998年 科学技術振興事業団さきがけ研究21研究員
2000年 理化学研究所 構造生物化学研究室 研究員
2003年 国立循環器病センター研究所 心臓生理部 室長

前田 雄一郎 MAEDA Yuichiro
理化学研究所 播磨研究所
構造生物化学研究室
〒679-5148
兵庫県佐用郡三日月町光都1-1-1
TEL:0791-58-2822
FAX:0791-58-2836
e-mail:ymaeda@spring8.or.jp
略歴:
1972年 東京大学理学部物理学科卒業
1977年 名古屋大学理学研究科分子生物学専攻博士課程修了
1978年 理学博士
1979〜1984年 Max Planck 医科学研究所(ハイデルベルグ)博士研究員
1984〜1993年 EMBL ハンブルグ支所、筋収縮研究G, グループ・リーダー
1993〜1999年 松下電器中央研究所国際研究所所長兼グループ長
1998年〜現 在 理化学研究所構造生物化学研究室主任研究員








