Volume 09, No.1 Pages 30 - 35
3. 最近の研究から/FROM LATEST RESEARCH
脂質結合タンパク質を輸送するタンパク質、LolAとLolBの結晶構造
Crystal Structures of Bacterial Lipoprotein Localization Factors, LolA and LolB
[1]理化学研究所 播磨研究所 Harima Institute, RIKEN、[2]京都大学 大学院理学研究科 Graduate School of Science, Kyoto University
- Abstract
- Five Lol proteins are involved in the lipoprotein transport in Gram-negative bacteria. Crystal structures of a lipoprotein-specific periplasmic chaperone, LolA, and an outer membrane lipoprotein receptor, LolB from Escherichia coli were determined using diffraction data collected at the beamlines of SPring-8. Despite their dissimilar amino acid sequences (identity ~ 8%), the structures of LolA and LolB are strikingly similar to each other. Both have a hydrophobic cavity consisting of an unclosed β-barrel and an α-helical lid. The cavity represents a possible binding site for the lipid moiety of lipoproteins. However, the structural differences in size and shape of hydrophobic inner spaces between LolA and LolB are highly connected to the functional differences between two proteins. Furthermore, these structural differences between two proteins provide significant insights into the molecular mechanisms underlying the energy-independent transfer of lipoproteins from LolA to LolB, and from LolB to the outer membrane.
はじめに
タンパク質は合成された後にそれぞれが働くべき場所まで輸送されてはじめてその機能を発揮する。したがって、合成されたタンパク質がその持ち場まで運ばれるメカニズムを理解することは、複雑な生命現象を理解する上でたいへんに重要なことの一つである。タンパク質輸送のなかでも、水に溶けないタンパク質の輸送形態にはとりわけさまざまな工夫が見られる。そのような不溶性タンパク質の一つであるリポタンパク質は、タンパク質のN末端が脂質と結合しており、その脂質部分が生体膜に埋め込まれているため、細胞を満たしている細胞液の中に溶け込むことができない。そのため、リポタンパク質が生体膜から他の生体膜へ移動するには、その輸送を助けるタンパク質が必要となる。細菌類には脂質で修飾されたリポタンパク質が多く存在し、それらは細胞周壁の構成要素として、形態維持、物質輸送・排出などの重要な細胞活性を担っている。
グラム陰性細菌の一種である大腸菌には、外膜や内膜のペリプラズム表面に少なくとも90種類のリポタンパク質があることが知られている(図1)。これらのリポタンパク質は、そのN末端にシグナルペプチドを持つ前駆体として合成され、内膜を透過し内膜のペリプラズム表面で、シグナルペプチドの切断と脂質(アシル基)の修飾が起こる。そのようなリポタンパク質はその成熟後に、Lolシステムと呼ばれる五種類のタンパク質により、内膜あるいは外膜に局在化されることが、東京大学分子細胞生物学研究所の徳田 元教授のグループにより明らかにされている [1-4] [1]T. Yakushi, K. Masuda, S. Narita, S. Matsuyama and H. Tokuda : Nature Cell Biol. 2 (2000) 212-218.
[2]S. Matsuyama, T. Tajima and H. Tokuda : EMBO J. 14 (1995) 3365-3372.
[3]S. Matsuyama, N. Yokota and H. Tokuda : EMBO J. 16 (1997) 6947-6955.
[4]T. Tajima, N. Yokota, S. Matsuyama and H. Tokuda : FEBS Lett. 439 (1998) 51-54.。内膜に留まるか外膜に運ばれるかの選別は、脂質が結合しているN末端の次のアミノ酸(+2位のアミノ酸)の種類によって決定される。LolシステムのLolCDE複合体 [1] [1]T. Yakushi, K. Masuda, S. Narita, S. Matsuyama and H. Tokuda : Nature Cell Biol. 2 (2000) 212-218.は、ABC(ATP-結合カセット)トランスポーター・スーパーファミリーに属し、ATPの加水分解エネルギーを使って外膜に運ばれるべき(外膜特異的)リポタンパク質を内膜から放出し、ペリプラズムに存在するリポタンパク質特異的分子シャペロンLolA [2] [2]S. Matsuyama, T. Tajima and H. Tokuda : EMBO J. 14 (1995) 3365-3372.との複合体を形成させる。LolAとリポタンパク質の複合体は、ペリプラズム空間を通ってリポタンパク質受容体LolB [3] [3]S. Matsuyama, N. Yokota and H. Tokuda : EMBO J. 16 (1997) 6947-6955.が存在する外膜へ移動する。LolA−リポタンパク質複合体がこのLolBと相互作用することによって、リポタンパク質はLolAからLolBに受け渡される。最終的にLolBがリポタンパク質を外膜に組み込む。LolA−リポタンパク質複合体は、LolB の非存在下においてのみ安定であり、LolBのリポタンパク質に対する親和性はLolAよりも高いことが示唆される。また、LolB−リポタンパク質複合体は、外膜の非存在下で安定である。Lolタンパク質の欠損は細菌にとって致命的であり [4] [4]T. Tajima, N. Yokota, S. Matsuyama and H. Tokuda : FEBS Lett. 439 (1998) 51-54.、大腸菌等のグラム陰性細菌の生存に本質的な役割を果たしている。このリポタンパク質輸送の分子機構を解明するためには、これらのLolタンパク質の立体構造を明らかにすることが不可欠であった。われわれは、SPring-8の放射光を用いたX線結晶解析によって、大腸菌由来のLolAとLolBの構造を高分解能で解明することに成功した [5] [5]K. Takeda, H. Miyatake, N. Yokota, S. Matsuyama, H. Tokuda and K. Miki : EMBO J., 22 (2003) 3199-3209.。
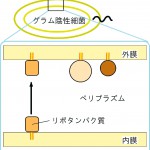
図1 グラム陰性細菌の細胞構造の模式図。グラム陰性細菌は内膜と外膜の二重の生体膜を持っている。二つの膜にはさまれた空間がペリプラズムである。
LolAおよびLolBの結晶化
大量発現、精製した野生型LolA [2] [2]S. Matsuyama, T. Tajima and H. Tokuda : EMBO J. 14 (1995) 3365-3372.については、斜方晶系(I222)および三方晶系(P3221)の結晶を得ることができ、SPring-8の放射光(BL44B2およびBL38B1)によって、それぞれ1.65Å分解能と1.9Å分解能という高い分解能の回折データを得ることができた [6] [6]K. Takeda, H. Miyatake, N. Yokota, S. Matsuyama, H. Tokuda and K. Miki : Acta Cryst., D59 (2003) 1440-1446.。野生型のLolBはアシル基を持つ不溶性のリポタンパク質であるため、アシル基によって修飾されるN末端のシステイン残基をアラニンに置換した可溶性の変異体を発現、精製し [3] [3]S. Matsuyama, N. Yokota and H. Tokuda : EMBO J. 16 (1997) 6947-6955.、結晶化に用いた。単斜晶系(P21)と六方晶系(P6322)の結晶が得られ、同じくSPring-8の放射光によって、それぞれ1.9Å分解能と2.2Å分解能の回折データを収集することができた [7] [7]K. Takeda, H. Miyatake, N. Yokota, S. Matsuyama, H. Tokuda and K. Miki : Acta Cryst., D59 (2003) 1224-1226.。
構造解析
LolAの重原子誘導体としては、斜方晶系(I222)の結晶に対する白金誘導体しか作成することができず、しかもNative結晶との同型性がかなり崩れたものであった。したがって、この誘導体結晶を用いて、白金を異常散乱原子とする多波長異常散乱(MAD)法によって解析することにした。この回折データの測定はSPring-8の理研ビームラインBL44B2で行った。困ったことには、結晶中には白金の他に亜鉛やヒ素化合物であるカコジル酸が含まれていて、それらの蛍光X線が白金のものと重なってしまう。このためMAD法において回折データを収集すべきエネルギーを決定するために必要なX線吸収スペクトルを蛍光法で測定できなくなってしまった。この結晶の析出と安定化のためには酢酸亜鉛とカコジル酸が必要であり、これらを含まない条件で結晶化することは困難であった。加えて、このような条件下では、BL44B2でのX線集光ミラーにコーティングされた白金によるX線吸収も、タンパク質に結合した白金化合物のX線吸収スペクトル測定には悪影響を及ぼし、結局は満足なX線吸収スペクトルは測定することはできなかった。そこで定法からははずれるがやむをえず、吸収端付近で5eVおきに回折データを多数収集し、回折データに含まれる異常分散シグナルから白金原子の散乱因子の異常散乱項の実数項f′と虚数項f″の値を推定して、解析の際に初期値として用いることにした。図2にf′とf″に比例した2つの量(パターソン図における白金のピークの高さと異常分散比)をプロットしたものを示す。いずれも吸収端におけるf′とf″の変化をよくとらえており、これらをもとにedge(│f′│が最大)とpeak(f″が最大)のデータの帰属ができた [6] [6]K. Takeda, H. Miyatake, N. Yokota, S. Matsuyama, H. Tokuda and K. Miki : Acta Cryst., D59 (2003) 1440-1446.。またこの帰属から推定したf′とf″をMAD法による位相計算の際に初期値として用いることで、良好な電子密度が得られた。このような方法は上述のような場合の他にも、装置の故障などの理由でX線吸収スペクトルが測定できない場合にも有効であろう。
一方、LolBの構造は、セレノメチオニンタンパク質の単斜晶系(P21)の結晶を用いてMAD法で決定した [7] [7]K. Takeda, H. Miyatake, N. Yokota, S. Matsuyama, H. Tokuda and K. Miki : Acta Cryst., D59 (2003) 1224-1226.。位相計算時のセレン原子の占有率は平均で0.81となり、質量分析から求めた値である0.85と良好な一致を示した。
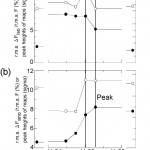
図2 6波長で回折測定したLolAの白金誘導体結晶における異常分散シグナルを見積もるためのプロット。
(a)白丸は分散差パターソンマップのハーカー面上の白金のピークの高さ。黒丸はr.m.s. ΔFiso /r.m.s. F =〈││F│-│Fremote││2〉1/2/〈│F│2〉)]1/2の値。
(b)白丸は異常差パターソンマップのハーカー面上の白金のピークの高さ。 黒丸はr.m.s. ΔFano/r.m.s. F =〈││F+│-│F-││2〉1/2/[(〈│F│2〉)]1/2の値。
LolAとLolBの結晶構造
LolAの立体構造(図3a)は、12個のβストランドと3本のαヘリックスからなり、袋状になった骨格構造の内部に形成される空洞(図3b)は、αヘリックスがフタのように塞いでいた。この空洞の表面は、芳香性残基が多く分布しており非常に疎水的であった。この疎水的空洞がリポタンパク質の脂質部(アシル基)を結合する部位と考えられる。しかし、この空洞は外部とは遮断された閉ざされた空間を形成していて、リポタンパク質の結合と解離に際してはフタを開閉する必要がある。変異体解析からリポタンパク質の結合や解離に関連した三つの重要な残基(Arg43, Phe47, Glu144)が特定されていたが [8,9] [8]A. Miyamoto, S. Matsuyama and H. Tokuda : Biochem. Biophys. Res. Com. 287 (2001) 1125-1128.
[9]A. Miyamoto, S. Matsuyama and H. Tokuda : FEBS Lett. 528 (2002) 193-196.、これらはいずれもフタを形成するαへリックスとβシートの界面に位置していた(図3a)。とりわけArg43は水素結合によってフタであるαへリックスをβシートに固定するのに大変重要な働きを担っており、この部位のアミノ酸置換(R43L)は、リポタンパク質を結合できるが受容体であるLolBに受け渡せない変異体になる [8] [8]A. Miyamoto, S. Matsuyama and H. Tokuda : Biochem. Biophys. Res. Com. 287 (2001) 1125-1128.。また、異なる2種の結晶系での構造を比較することによって、αへリックスが非常に動きやすいことが示唆された。これらのことから、αへリックスのフタが開閉することが、リポタンパク質の結合と受け渡しに重要であることが明らかになった。
LolBの構造を図4aに示す。この構造は、LolAの構造と驚くほどよく似ていて、βシートとαへリックスで疎水的な空洞を形成していた。LolAとLolBのアミノ酸配列の比較からは全く予想しなかったことである(アミノ酸の一致度は10%以下)。しかしながら、LolAとLolBでαへリックスの配置や向きは大きく異なっている(図3a、図4a)。空洞を形成している疎水的な残基の構成は、LolAでは芳香性残基が中心であるのに対して、LolBでは主にロイシンやイソロイシン等の柔軟な側鎖を持つものによって占められている。これらの結果、LolBの疎水的空洞は外部の溶媒につながることになり、リポタンパク質を結合するときにもαへリックスのフタを開ける必要がないように思われる。実際にLolBの2つの結晶系のうちの一方(六方晶系の結晶)には、この空洞にすっぽり入る細長い電子密度が観測され、これは結晶化に使用したポリエチレングリコールモノメチルエーテル(PEGMME)であると推測できた。これは、リポタンパク質の脂質がLolBに取り込まれる時のモデルと目することができる。加えて、LolBには溶媒に突き出たループの中央にPro67やLeu68等の疎水性残基があり(図4a)、これらはLolAに見いだすことができない。また、N末端9残基の電子密度を観察することができなかったが、これはN末端付近にはプロリンやグリシン等の二次構造形成に適さない残基が多く見られるためと考えられる。野生型のLolBではこのN末端には3本のアシル基が共有結合しており、N末端部分には構造上の柔軟性が求められることによるのであろう。
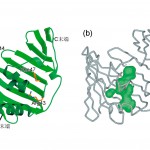
図3 LolAの結晶構造。(a)リボン図。(b)LolA分子内部の空洞。
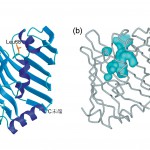
図4 LolBの結晶構造。(a)リボン図。(b)LolB分子内部の空洞。
このように、LolA、LolBという2つのタンパク質は、アミノ酸配列もリポタンパク質輸送における役割もまったく異なっているにもかかわらず、その立体構造は非常に似ていた。どちらもβシートによって中心部に疎水性の空洞を持つ袋状ポケットを備えていることから、この基本構造はさまざまな組成を持つ脂質部分をつかまえるのに都合のよい構造であることがうかがえる。しかしながら、LolAとLolBでは、袋状ポケットのフタを形成するαヘリックスの配置と空洞を取り囲むアミノ酸の種類が異なり、この構造上のわずかな違いが、ATPのエネルギーを使うことなしに、リポタンパク質をLolAからLolBへ受け渡すために重要であることが明らかとなった。
Lolシステムによるリポタンパク質輸送機構について
結晶構造解析により得られたLolAとLolBの立体構造とこれまでに得られている生化学的データから、Lolシステムによるリポタンパク質の輸送を以下のように表すことができる(図5)。
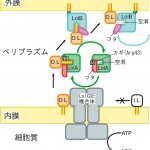
図5 Lolタンパク質群によるリポタンパク質輸送の概念図。I.L.は内膜に残留する(内膜特異的)リポタンパク質。O.L.は外膜に輸送される(外膜特異的)リポタンパク質。
外膜特異的リポタンパク質はLolCDE複合体に選択的に認識され、ATP加水分解エネルギーを使用して内膜から遊離される。LolAのArg43とαへリックスの間の水素結合が切れ、αへリックスのフタが開き、その結果露出する内部の疎水的な分子表面にリポタンパク質のアシル鎖部分を結合する。このLolA−リポタンパク質複合体では、疎水的なアシル基の部分がLolAで覆われているため、ペリプラズム空間の溶液中に存在することができるようになる。LolA−リポタンパク質複合体はペリプラズム空間を拡散して、外膜に到達する。LolA(pI〜6)と外膜のペリプラズム側に結合しているLolB(pI〜9)は、電荷の違いによって静電的に相互作用すると考えられる。LolBとLolA−リポタンパク質複合体が相互作用すると、アシル鎖がLolAからLolBに移動しLolB−リポタンパク質複合体が形成される。LolAからLolBにリポタンパク質が移動するのは、LolAとLolBとのアシル鎖に対する親和性の違いを利用している。LolAの疎水性空洞は多くの芳香性アミノ酸で構成されるが、LolBの疎水性空洞は主にロイシンやイソロイシンなどの構造的に柔軟な側鎖を持ったアミノ酸で構成されている。こうした空洞を構成するアミノ酸側鎖の柔軟性の違いは、おもに疎水相互作用の原因であるエントロピーの寄与によりアシル鎖との親和性に対して大きな影響を与える。LolBの方がLolAよりもアシル鎖に対して大きな親和性を持つ原因となり、LolAからLolBへのリポタンパク質の移動はエネルギーを使わずに進行できる。リポタンパク質を遊離したLolAは、再びαへリックスのフタを閉じて、フタとArg43の間に水素結合が形成された安定な閉構造に戻り、次のサイクルで使用される。LolAからリポタンパク質を受け取るためにはLolBの空洞はペリプラズム側を向く必要があるが、リポタンパク質を外膜に組み込むためには、リポタンパク質を結合している空洞を外膜側に向けなければならない。LolBを外膜に繋ぎ止めているN末端には、グリシンやプロリンなど二次構造を形成せず柔軟性に富むアミノ酸残基が多く存在しているため、このような動きも可能である。また、アシル鎖を外膜に組み込むためには、外膜を構成する脂質の頭部が互いに形成する水素結合を切断しなければならない。この役割をLolBのPro67とLeu68が存在するループが担っているのではないかと考えられる。このうちLue68はLolBのホモログタンパク質で高度に保存されている残基である。このループは疎水的な性質を持つ残基を持ちながら、溶媒中に飛び出しているという特徴を持っている。このような疎水的ループは他の脂質輸送タンパク質にも存在し、それらのタンパク質で脂質の脂質膜からの取り込みや脂質膜への組み込みに関与している。また、このような疎水的なループがLolAには存在せず、LolBのみに存在することによって、LolAから内膜へのリポタンパク質の逆戻りの移動が防止できるため、ATPエネルギーの有効利用に一役買っているのではないかと思われる。このように外膜特異的リポタンパク質は最終的には外膜に組み込まれ、外膜の脂質膜中に安定にアシル鎖を繋ぎ止める。
今後の展開について
タンパク質の輸送は、細菌類からヒトなどの高等生物に至るまで、細胞内で幅広く見られる普遍的な現象であり、その分子機構を明らかにしていくことは、生命活動の本質に迫る意味で非常に重要である。今後、LolAとリポタンパク質の複合体、LolBとリポタンパク質の複合体、LolCDE複合体、などの構造が決定されることによって、リポタンパク質局在化の仕組みがより詳細に理解されることになろう。また、LolAとLolBはグラム陰性細菌の生存に欠くことのできない重要な働きを担っていることから [4] [4]T. Tajima, N. Yokota, S. Matsuyama and H. Tokuda : FEBS Lett. 439 (1998) 51-54.、得られた立体構造をもとにして、病原性のグラム陰性細菌(O-157大腸菌、サルモネラ菌等)を特異的ターゲットとした抗生物質の開発につながることも期待される。
謝 辞
本研究は、東京大学分子生物学研究所の徳田 元教授、松山伸一助教授(現 立教大学教授)、横田直子技官、理化学研究所播磨研究所の宮武秀行研究員との共同研究である。また、X線回折実験ではJASRIの谷田 肇研究員、理化学研究所播磨研究所の足立伸一、朴 三用、引間孝明の各研究員にご援助いただいた。
参考文献
[1]T. Yakushi, K. Masuda, S. Narita, S. Matsuyama and H. Tokuda : Nature Cell Biol. 2 (2000) 212-218.
[2]S. Matsuyama, T. Tajima and H. Tokuda : EMBO J. 14 (1995) 3365-3372.
[3]S. Matsuyama, N. Yokota and H. Tokuda : EMBO J. 16 (1997) 6947-6955.
[4]T. Tajima, N. Yokota, S. Matsuyama and H. Tokuda : FEBS Lett. 439 (1998) 51-54.
[5]K. Takeda, H. Miyatake, N. Yokota, S. Matsuyama, H. Tokuda and K. Miki : EMBO J., 22 (2003) 3199-3209.
[6]K. Takeda, H. Miyatake, N. Yokota, S. Matsuyama, H. Tokuda and K. Miki : Acta Cryst., D59 (2003) 1440-1446.
[7]K. Takeda, H. Miyatake, N. Yokota, S. Matsuyama, H. Tokuda and K. Miki : Acta Cryst., D59 (2003) 1224-1226.
[8]A. Miyamoto, S. Matsuyama and H. Tokuda : Biochem. Biophys. Res. Com. 287 (2001) 1125-1128.
[9]A. Miyamoto, S. Matsuyama and H. Tokuda : FEBS Lett. 528 (2002) 193-196.
竹田 一旗 TAKEDA Kazuki
理化学研究所 播磨研究所 協力研究員
〒679-5148 兵庫県佐用郡三日月町光都1-1-1
TEL:0791-58-2912 FAX:0791-58-2913
e-mail:ktakeda@sp8sun.spring8.or.jp
三木 邦夫 MIKI Kunio
京都大学 大学院理学研究科 教授
理化学研究所 播磨研究所 主任研究員
〒606-8502 京都市左京区北白川追分町
TEL:075-753-4029 FAX:075-753-4032
e-mail:miki@kuchem.kyoto-u.ac.jp








