Volume6 No.2
SPring-8 Section A: Scientific Research Report
X-ray Crystal Structural Analysis of ATP-dependent Membrane Supramolecular Complex
京都大学
Kyoto University
- Abstract
-
AAA+プロテアーゼはリング構造を形成し、中心の孔に基質ポリペプチド鎖を通して内部のプロテアーゼ活性部位に送り込むと考えられている。これにはATP加水分解に伴う構造変化が重要であることが知られている。我々は膜結合型AAA+プロテアーゼFtsHの構造変化に着目してその可溶性ドメインの構造決定を目指している。現在までに、AMP-PNP存在下で作製した結晶から、3.45 Å 分解能のX線回折データを得、分子置換法で解を得た。
Keywords: AAA+プロテアーゼ、ATP加水分解、タンパク質の品質管理
背景と研究目的:
プロテアソームに代表されるATP依存性プロテアーゼ(AAA+プロテアーゼ)はリング構造を形成し、その中心の孔に基質ポリペプチド鎖を通して内部のプロテアーゼ活性部位に送り込むと考えられている。その際、構造を保った状態の基質タンパク質でもATP依存的に変性させて、プロテアーゼ活性部位に届ける機能があることも考えられている。この機能は、基質を一度も離すことなく連続的に分解することが知らており、特に膜タンパク質であるAAA+プロテアーゼの一つのFtsHは、主に複合体形成に失敗して機能を失った不要な膜タンパク質を膜から引きずり出して連続的に分解する。この時もやはりATP加水分解を伴っており、FtsHのATP依存的な構造変化がこの現象を実現させていると考えられている。したがって、この反応過程の構造を決定することはFtsHの機能発現の分子メカニズムを知る上で非常に重要である。FtsHの様々な反応状態の構造情報は、他のAAA+プロテアーゼの機能についても有力な情報となると考えられる。これまでに膜貫通領域を欠損させた可溶性のFtsHの構造は Thermus thermophilus HB8 由来でADP結合型が、Thermotoga Maritima 由来でADP結合型、apo型、Aquifex aeolicus 由来でADP結合型の構造が決定されている[1-4]。現在までにATPおよびそのアナログの結合状態のFtsHのX線結晶構造は得られていない。我々はATPおよびATPアナログ結合状態のFtsHの可溶性ドメインのX線結晶構造解析を行い、FtsHのATP加水分解依存的な構造変化を明らかにすることを目的とした。
実験:
N末端にグルタチオン-S-トランスフェラーゼ(GST)を融合させた膜貫通領域を欠損させたFtsHにG399Lという変異を導入したコンストラクトを作製し、グルタチオンカラムを用いて精製した。ATPの代わりにATPの非分解性の類似体AMP-PNPを含んだリザーバー溶液を調製し、蒸気拡散法により結晶化スクリーニングを行い、数種の条件から結晶を得た。各結晶化条件から得られ結晶をSPring-8のBL32XUにおいて結晶の質の確認およびデータ収集を行った。最終的には 3.45 Å 分解能の回折データを収集した(表1)。XDSによって処理したデータを用いてMolrepによって分子置換法で初期位相を得た。その際、すでに得られている好熱菌 Thermus thermophiles HB8 由来のADP結合型FtsH可溶性ドメインをモデルとして用いた(PDB ID:4EIW)。さらに、Refmac5 や Phenix を用いて現在モデルの修正および精密化を行っているところである。
表1. X線回折データ測定
| Soluble region of Fish/AMP-PNP | |
| Data collection | |
| Space group | P212121 |
| Cell dimensions | |
| a, b, c (Å) | 104.2, 136.0, 225.3 |
| α, β, γ (°) | 90, 90, 90 |
| Resolution (Å) | 50.0-3.14 (3.66-3.45)* |
| Rmeas | 0.16 (2.15) |
| CC1/2 | 0.99 (0.56) |
| I / σI | 12.68 (1.37) |
| Completeness (%) | 99.8 (99.2) |
| Redundancy | 14.5 (14.8) |
| Refinement | |
| Resolution (Å) | 49.55-3.45 (3.67-3.45) |
| No. of unique reflections | 42,819 |
| Rwork / Rfree (%) | 22.8/24.0 (37.4/46.8) |
| No. atoms | |
| protein | 12473 |
| Ligand/ion | 93/4 |
| B-factors | |
| protein | 141.9 |
| Ligand | 152.8 |
| R.m.s. deviations | |
| Bond length (Å) | 0.004 |
| Bond angles (°) | 0.797 |
結果および考察:
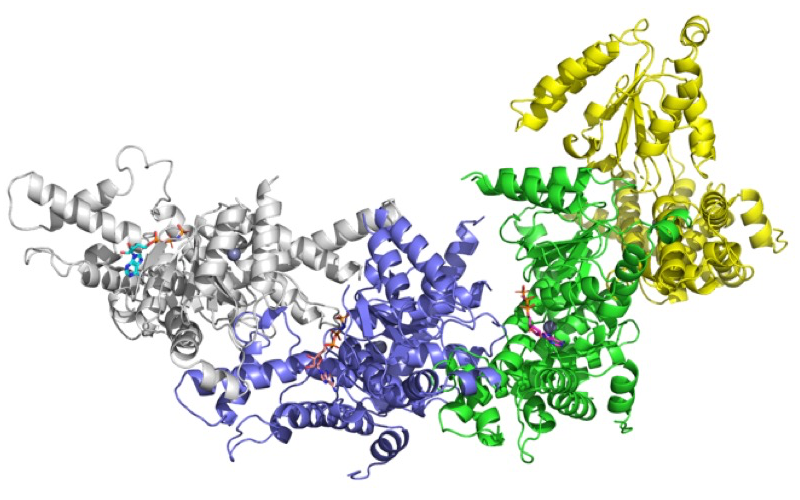
FtsHは6量体のリング構造で機能するが、分子置換法で得られたモデルは非対称単位中に4つのFtsH可溶性ドメインが入っていてリング構造ではなかった(図1)。この4つのFtsH可溶性ドメインのうち3つにはATP結合部位にAMP-PNPと考えられる電子密度が観察され、AMP-PNP結合状態構造であると考えられた(図2)。4つのうちひとつにはAMP-PNPと考えられる電子密度よりは小さい電子密度が見られた。FtsH可溶性ドメインは螺旋状に並んでいたが、この現象はClpBなど他のAAA+ファミリーでも観測されている[5]。今回のAMP-PNP結合状態の構造がリング構造を形成しなかったことは、6量体FtsHのすべてのサブユニットに同時にATPが結合しない可能性をを示唆している。最近、FtsHのミトコンドリアホモログであるYME1の基質ポリペプチド結合状態の6量体構造がクライオ電子顕微鏡の単粒子解析によって 3.4 Å 分解能で決定された[6]。この構造を見てみると、6量体中にATP結合状態は4つ、ADP結合状態は1つ、のこりはアポ状態であった。4つのATP結合状態構造はすべてコンフォメーションが異なっており、6量体内でダイナミックに構造変化していることがわかった。このYME1の構造を踏まえて考えると、我々のAMP-PNP結合状態のFtsH可溶性ドメインがリング構造を形成しなかった原因が、すべてのサブユニットに同じヌクレオチドが結合し、同じ構造を形成したからであると考えられた。
図1. 非対称単位中のAMP-PNP結合型 FtsH可溶性ドメインの構造。
図2. AMP-PNP結合型FtsH可溶性ドメイン構造のComposit omit map (1.0 σ)。
今後の課題:
我々の目的であるFtsHのATP依存的な構造変化を構造生物学的に理解し、基質タンパク質の分解メカニズムを解明するという目的は、ホモログではあるがYME1のクライオ電子顕微鏡の単粒子解析でほぼ達成されてしまった。ただ、FtsHとYME1が同じメカニズムで基質タンパク質を分解しているのかは今後検討するべき課題である。また、これまでの研究では膜タンパク質であるFtsHやYME1の可溶性ドメインを用いてきたので、生体内の主な基質タンパク質である基質膜タンパク質をどのように認識しているのかについては、今後検討するべき課題であると考えている。今後は膜貫通領域を含んだ構造解析を行っていきたい。
参考文献:
[1] R. Suno et al., Mol. Cell 22, 575-585 (2006).
[2] C. Bieniossek et al., Proc. Natl. Acad. Sci. USA 103, 3066-3071 (2006).
[3] C. Bieniossek, B. Niederhauser, U. Baumann, Proc. Natl. Acad. Sci. USA 106, 21579-21584 (2009).
[4] M. Vostrukhina et al., Acta Crystallogr. D Biol. Crystallogr. 71, 1307-1318 (2015).
[5] S. Lee et al., Cell 115(2), 229-240 (2003).
[6] C. Puchades et al., Science 358 (6363), eaa0464 (2017).
公的研究資金:
1. 日本学術振興会科学研究費補助金・若手研究B、代表、課題番号19770079 (平成19,20年度) 計330万円
2. 文部科学省科学研究費補助金 特定領域研究、代表、「タンパク質分解による細胞・個体機能の制御」公募班課題番号19044015(平成19,20年度)計660万円
3. 日本学術振興会科学研究費補助金・若手研究B、代表、課題番号21770106 (平成21,22年度) 計404万円
4. 文部科学省科学研究費補助金 特定領域研究、代表、「革新的ナノバイオ」公募班課題番号21023008(平成21,22年度)計640万円
ⒸJASRI
(Received: March 23, 2018; Accepted: July 3, 2018; Published: August 16, 2018)