Volume6 No.2
SPring-8 Section B: Industrial Application Report
ガラスからのゼオライト合成とガラス中Srの局所構造評価
Synthesis of Zeolite from Glass and Investigation of Local Structures of Sr in the Glass
aシャープ(株), b東北大学金属材料研究所, c大阪府立大学
aSharp Co., Ltd., bIMR, Tohoku University, cOsaka Prefecture University
- Abstract
-
液晶テレビに使用されているガラスを原料として合成したゼオライトと、原料のガラス中のSrの局所構造をXANESにより評価した。その結果、ゼオライトの生成量を増加する効果をもたらすガラス原料の酸処理によって、ガラス原料中のSr濃度は変化するが局所構造は変化していないことが判った。また、生成したゼオライト中のSrの局所構造をXANESで評価した結果、ガラス原料中のSrはゼオライトの構造には寄与せず、合成後もガラス原料中のSrと同じ局所構造を示すことが判明した。
Keywords: ガラス、ゼオライト、Sr、局所構造、XANES
背景と研究目的:
将来的に排出量が急激に増加すると予測される液晶ディスプレイ[1]に使用されているアルミノホウケイ酸ガラスを資源として有効に利用することを見据え、我々はアルミノホウケイ酸ガラスを原料とし、アルカリ水熱処理によりゼオライトを合成する方法を研究してきた。これにより、軟化温度の高いアルミノホウケイ酸ガラスを加熱軟化せずに新たな機能材料としての再資源化が可能となる。これまでの研究結果から、100℃ 以下の水熱処理によりゼオライトの合成が可能であることがわかっている[2-4]。
アルミノホウケイ酸ガラスは、SiO2、Al2O3、B2O3 を主成分としている。ゼオライトは SiO2、Al2O3 から成る結晶性のアルミノケイ酸塩であるため[5]、アルミノホウケイ酸ガラスはゼオライトの原料として適している。一方、アルミノホウケイ酸ガラスはゼオライト本来の成分ではない B2O3、CaO、MgO、SrO を含んでいる。アルカリ土類酸化物は網目形成修飾酸化物であり、網目形成酸化物のネットワークを切断し、ガラスの性質に大きく影響する。
高炉スラグや石炭フライアッシュからのゼオライト合成に関する研究において、原料中にCaやMgのようなアルカリ土類金属が含まれる場合は、ゼオライトの生成が阻害されることが報告されている[6]。アルミノホウケイ酸ガラスもアルカリ土類金属を主成分として含んでいる[7]。これまでに行ったゼオライトの合成プロセスに関する研究の結果、水熱処理前にガラス原料に酸処理を施すことにより、続く水熱処理でのA型ゼオライトの生成量が増加することが明らかとなっている[2-4]。
そこで、本研究ではアルミノホウケイ酸ガラスへ施す酸処理時間を変化させ、ガラス中成分の溶出について調べた。また、酸処理時間を変化させたガラス原料を用い、水熱処理した場合のゼオライト生成について調べた。さらに、アルミノホウケイ酸ガラス中の微量元素であるSrに着目し、ゼオライト合成前後の局所構造について調べた。また、水酸溶出処理前後のSr近傍の局所構造について調べた。これらの結果をもとに、ゼオライトの生成にSrイオンがどのように影響を及ぼしているのか、また、合成条件がゼオライトの生成に及ぼす影響を明らかにすることを目的とする。
ガラス試料の作製
本研究では、市販のアルミノホウケイ酸ガラスを原料として用いた。ボールミルを用いて中央粒径 8 µm に粉砕し、ガラス試料とした。アルミノホウケイ酸ガラスの組成は、SiO2:63、Al2O3:18、B2O3:10、CaO:8、MgO:1、SrO:0.8 wt% であった。アルミノホウケイ酸ガラスは、SiO2 と Al2O3 を主成分とし、ゼオライトの原料として適していることが判った。SrO を微量成分として含んでおり、本研究では SrO 成分に着目した。
ゼオライト合成前の酸処理
ガラス試料に酸処理を施し、ゼオライト本来の成分ではないガラス成分を除去することを試みた。具体的には、ガラス試料 10 g を 5 mol/L の硝酸( HNO3、和光純薬工業製、特級)250 mLと 混合し、75℃ で撹拌を行った。このとき溶出時間を 0.16、1、3、6 時間と変化させ、成分溶出量が異なるサンプルを複数作製した。その後、吸引ろ過を行い、50℃ で24時間乾燥した。
酸処理によるガラス成分の溶出量を、酸中の成分を誘導結合プラズマ発光分析(ICP-AES、ICPE9000、島津製作所製)により分析することで調べた。
生成物の評価方法
水熱処理により生成した結晶相を同定するため、粉末X線回折(XRD、Mini FlexⅡ、リガク製)を行った。XRDは、Cu Kα 線を用い、加速電圧 30 kV、電流 15 mA で行った。
酸処理時間を0から6時間と変化させたガラスと、それらのガラスから水熱処理により合成したゼオライトのSr元素の局所構造は、X線吸収端構造(XANES)スペクトルにより評価した。Sr-K端のXANESデータは、SPring-8のBL14B2を使用してSi(111)の結晶面を用い、二結晶モノクロメータを用い、透過法での測定を行った。XANESデータの解析には、市販のソフトウェアREX2000(リガク製)を用いた。
また、参照試料として SrO、および、市販のA型ゼオライト(和光純薬工業製)を硝酸ストロンチウム水溶液( Sr(NO3)2、メルク製)に浸漬させ作製したSr置換型市販A型ゼオライトのXANESスペクトルの測定も行った。
結果および考察:
図1に酸処理時間とガラス中の成分の溶出率の関係を示した。酸処理時間が長くなるにつれ、Si以外のガラス成分が溶出することがわかった。これは、通常 SiO2 は、強アルカリやフッ酸に溶けやすいが、硝酸、とくに高濃度のものには極めて溶け難いことが報告されていることと一致した[8, 9]。SrO、MgO、CaO などのアルカリ土類金属酸化物は硝酸に溶出しやすかった。これはアルカリ土類金属酸化物がガラスの網目修飾剤として存在し、酸性水溶液中の H+ または H3O+ と容易に交換するためである。

図1. 酸処理時間とガラス中の成分の溶出率
Sr 、Ca、Mg のような網目修飾剤は電荷補償の役割を果たしているため、アルカリ土類金属イオンは、Si4+ と Al3+ イオンの電荷補償のため、Al3+ の近傍に存在している。そのため、アルカリ土類金属イオンの溶出に伴い、Al3+ イオン近傍の構造が不安定となる。結果として、アルミノホウケイ酸ガラス中の Al3+ イオンもアルカリ土類金属イオンと同様に酸処理により溶出しやすいと考えられる。また、一般的にガラス中の B2O3 は、酸に溶けやすいことも報告されている[10]。以上の理由から、酸処理によって、アルカリ土類金属酸化物、Al2O3、B2O3 は、SiO2 に比べて優先的に溶出したと考えられる。
結果として、Si以外のガラス成分の溶出率は6時間の酸処理で 7~13% 程度であり、ガラス粒子の表面にSi-richな層が形成されたと言える。
酸処理を施したガラスを用いて、水熱処理を行った際の生成物のXRDを図2に示す。粉砕したままの酸処理を施さないガラス原料からは、A型ゼオライト、P型ゼオライトが生成していたが、ガラス原料に酸処理を施すことにより、A型ゼオライトの生成量が増加し、P型ゼオライトの生成量が減少した。原料ガラスの酸処理時間が長いほど、すなわち、ガラスがよりSi-richになるほど、A型ゼオライトの生成量は、多くなった。本研究では、CaO を含む高炉スラグを原料とするゼオライト合成の研究[11]で、生成が報告されているトバモライト、ハイドロガーネットはいずれも生成しなかった。これは、40 wt% の CaO を含む高炉スラグと比べ、アルミノホウケイ酸ガラスの CaO 含有量が少ないためと考えられる。
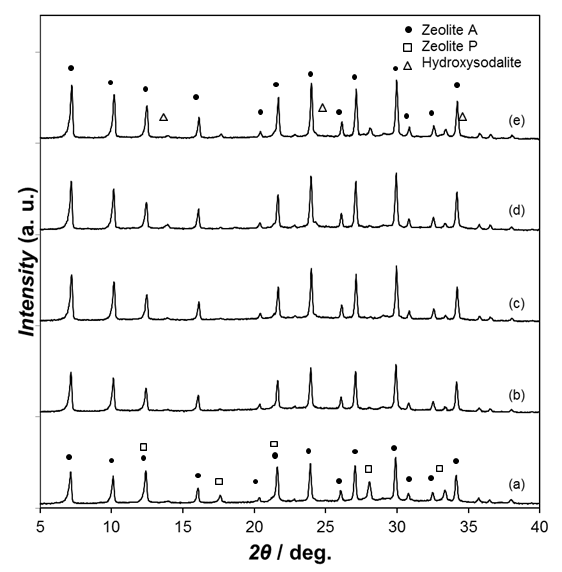
図2. 水熱処理後生成物のXRD、酸処理時間 (a) 0、(b) 0.16、(c) 1、(d) 3、(e) 6時間
つぎに、アルミノホウケイ酸ガラス中の微量成分であるSrの局所構造の変化を調べた。図3に硝酸処理時間を0から6時間と変化させたアルミノホウケイ酸ガラス中SrのK殻吸収端におけるXANES領域のスペクトル測定結果を示した。また、参照試料として SrO のXANESスペクトルも示した。SrO とガラスのXANESスペクトルを比較すると、両者の吸収端は類似しており、ガラス中でSrは +2価として存在することが示唆された。SrのXANESスペクトルはいずれの酸処理時間のガラスについても一致しており、酸処理時間による差は見られなかった。この結果から、酸処理によってガラス原料中のSr濃度は変化するが、Srの局所構造に変化はないことが判った。この結果は、酸処理によってガラス中のアルカリ土類金属は、酸の H+ や H3O+ イオンと交換するため網目修飾剤として残存するか、酸中へ溶出するかのいずれかであることとよく一致する。
(A) (B)
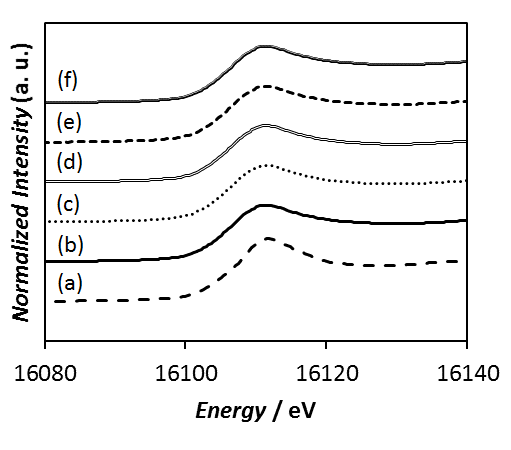
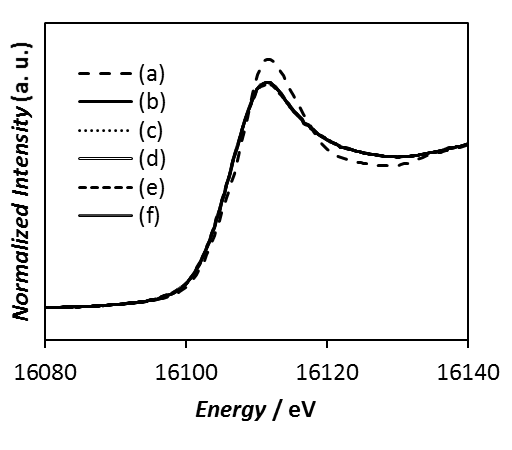
図3. Sr-K殻吸収端XANESスペクトル、(a) SrOおよび(b) 0、(c) 0.16、(d) 1、(e) 3、(f) 6時間の酸処理ガラス。
(A)は並べて比較、(B)は重ねて比較
図4に6時間酸処理ガラス、酸処理0.16時間、および、酸処理6時間ガラスから合成したA型ゼオライト、Sr置換型市販A型ゼオライトにおけるXANES領域の測定結果を示す。図4より、酸処理がゼオライト中のSrの局所構造に与える影響はごくわずかで、水熱処理の前後において、または、酸処理時間の異なるガラスに対する水熱処理においても、これらのXANESスペクトルに変化がみられないことが判明した。また、これらのスペクトルはSr置換型市販A型ゼオライト中のSrの局所構造とも異なる結果を示したことから、ガラス中のSrは水熱処理後も網目修飾剤として残存している可能性が示唆された。以上の結果から、水熱処理前の酸処理はA型ゼオライトの生成量や結晶化度には寄与するが、その後の水熱処理においてSrの局所構造は変化しないことが明らかとなった。
(A) (B)
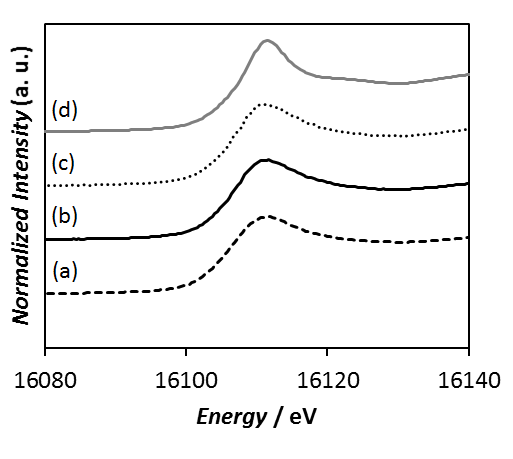
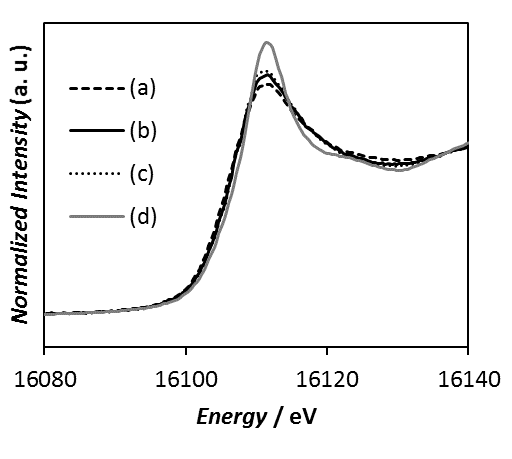
図4 Sr-K殻吸収端XANESスペクトル、(a) 6時間酸処理ガラス、(b) 0.16時間および (c) 6時間酸処理ガラスの水熱
処理生成物、(d) Sr置換型市販A型ゼオライト。(A)は並べて比較、(B)は重ねて比較。
今後の課題:
アルミノホウケイ酸ガラスの微量アルカリ土類金属成分であるSrの局所構造は酸処理の有無、酸処理時間、水熱処理の前後で変化しないことが判明した。これらは、今後、液晶パネルに使用されているガラス基板の資源有効利用において有益な知見となり得る。一方で、アルミノホウケイ酸ガラスから合成したゼオライトを、吸着剤や触媒として使用する際に、ガラス中に残存しているSrがその性能に与える影響や、酸処理前後、または、水熱処理前後でのSr以外のアルカリ土類金属の局所構造について調べる必要がある。また、生産プロセスの簡易化やコストの低減を考慮した際に、酸処理を省略することも必要となり、酸処理を行っていないガラスを原料として、様々な条件で合成したゼオライトのXANSEスペクトルを測定することにより、アルミノホウケイ酸ガラスからのゼオライト合成におけるアルカリ土類金属の影響を明らかにしていくことも今後の課題である。
なお、Ca K端の測定も予定していたが、Sr K端の測定を優先して行った結果Ca K端を測定する時間を確保出来なかったため、今回はSr K端のみ測定を行った。
参考文献:
[1] H. Koyama and R. Nakazawa, Ceram. Jpn., 47, 81 (2012).
[2] M. Tsujiguchi et al., J. Am. Ceram. Soc. 97, 114 (2014).
[3] M. Tsujiguchi, et al., J. Ceram. Soc. Jpn. 122, 104 (2014).
[4] M. Tsujiguchi et al., J. Asian Ceram. Soc. 2, 27 (2014).
[5] D. W. Breck, " Zeolite Molecular Sieves ", Wiley, New York (1974).
[6] T. Murakami et al., ISIJ Int. 51, 901-905 (2011).
[7] Patent, WO2013084832A1, Asahi Glass Co., Ltd.
[8] M. Kawahara and M. Katoh, J. MMIJ. 125, 495 (2009).
[9] 前田他, 廃棄物処理学会誌, 15, 45-51 (2004).
[10] J. Yoshinaga et al., J. Environ. Chem. 12, 333-342 (2002).
[11] Y. Sugano et al., ISIJ Int. 45, 937-945 (2005).
ⒸJASRI
(Received: March 18, 2016; Early edition: April 25, 2018; Accepted: July 3, 2018; Published: August 16, 2018)






