Volume6 No.2
SPring-8 Section A: Scientific Research Report
核共鳴非弾性散乱測定の膜結合型一酸化窒素還元酵素への適用
Application of Nuclear Resonance Vibrational Spectroscopy to Membrane-integrated Nitric Oxide Reductase
a理化学研究所 SPring-8、b(公財)高輝度光科学研究センター
aRIKEN, SPring-8 Center, bJASRI
- Abstract
-
膜結合型一酸化窒素還元酵素(NOR)は、ヘム鉄と非ヘム鉄からなる複核中心を活性部位にもっており、2分子の一酸化窒素(NO)から亜酸化窒素(N2O)に還元する反応を触媒する。本研究では、NOR の活性部位構造を検討できる手法として核共鳴非弾性散乱(NRVS)に着目し、酸化型、還元型、配位子結合型試料の測定を行った。
Keywords: 核共鳴非弾性散乱、金属タンパク質、ヘム鉄、非ヘム鉄
背景と研究目的:
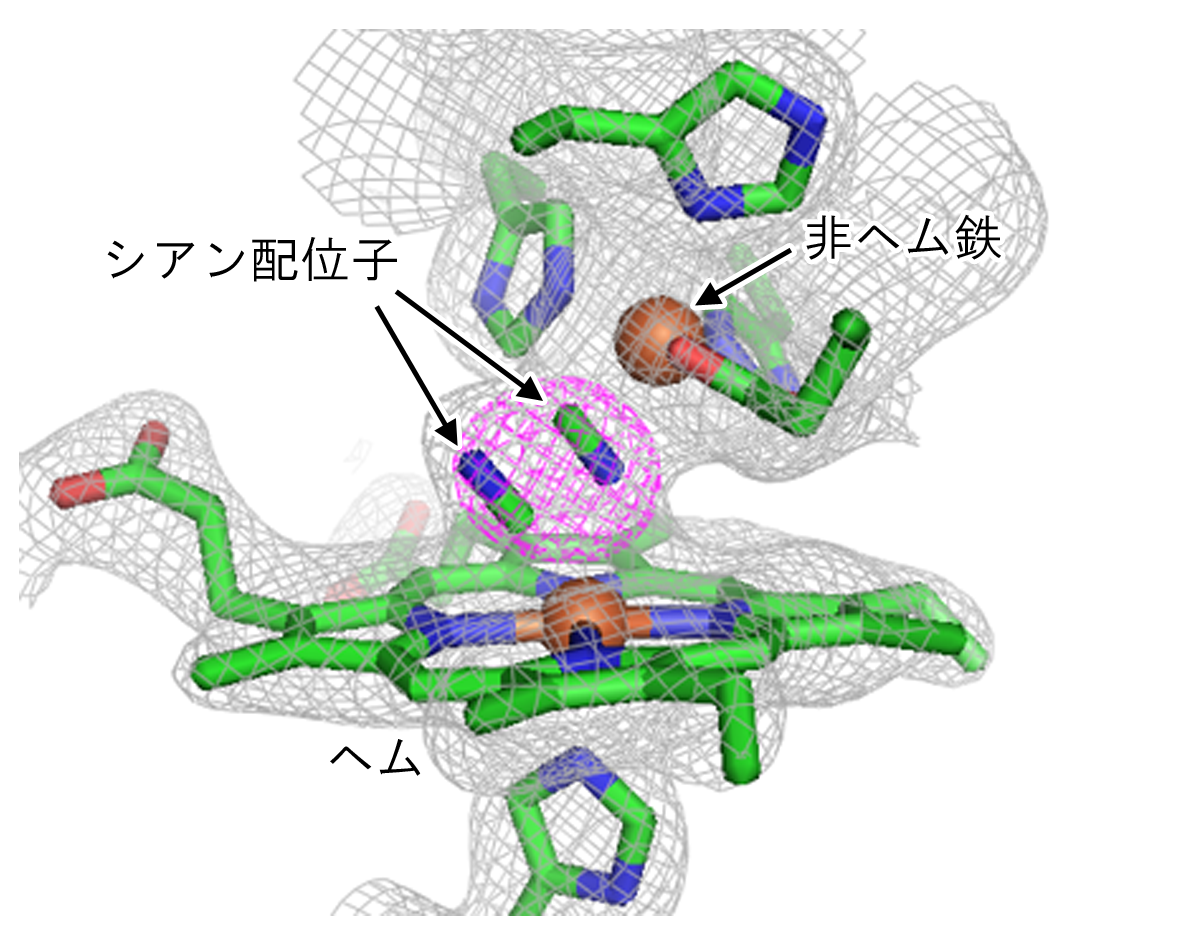
膜結合型一酸化窒素還元酵素(NOR)は、一酸化窒素(NO)を還元し、亜酸化窒素(N2O)を生成する反応を触媒する。この反応は、脱窒と呼ばれる硝酸から窒素分子を形成する過程に含まれており、細胞毒性の高い NO を速やかに分解するために必須である。また、緑膿菌(Pseudomonas aeruginosa)などの病原菌は、感染の際に宿主が免疫系として産生するNOを分解するために NOR を利用している。NORは、ヘム鉄と非ヘム鉄から構成される複核中心において、2当量の電子とプロトンを利用することで2分子の NO から N2O と水分子を生成する(2NO + 2e- + 2H+ → N2O + H2O)。この反応には、NO の鉄への配位、鉄から NO への電子供与、NO へのプロトン供与、N-N 結合の形成および N-O 結合の開裂といった興味深いケミストリーが含まれており、それらが巧妙に共役することで NO 還元が行われる。そのため、その分子機構には、多くの研究者が興味をもっている[1]。我々は、これまでにX線結晶構造解析を主軸とし、NOR の反応機構の解明を目指した研究に取り組んでき、その活性部位の構造を明らかにしてきた(図1)[2,3]。しかし、X線結晶構造解析からは、NOR の活性中心金属の電子状態に関する情報を得ることは難しく、詳細な反応機構の理解にはいたっていない。
図1.NORの活性部位の構造[2,3]。還元シアン結合型の構造では、2つのシアン分子がそれぞれヘム鉄と非ヘム鉄に配位している様子がみられている。
本研究では、NOR の触媒反応機構に関する研究を進めるために、活性部位の鉄原子の電子状態や配位構造を検討することが可能な核共鳴非弾性散乱測定(Nuclear Resonance Vibrational Spectroscopy: NRVS)に注目した。NRVS は、「放射光を利用した振動分光法」であり、57Fe のようなメスバウアー活性な核種を含む試料に応用可能である。NRVS 測定では、活性中心にある鉄原子を安定同位体である 57Fe に置き換える必要があるが、他の分光法と異なり、鉄原子の状態を問わず、鉄原子が含まれる振動モードを選択的に全て観測することができるという利点がある[4]。我々は、これまでに、NRVS に適した NOR 試料の調製法を確立してきている[5]。本研究では、これまでに測定してきた酸化型の酵素だけではなく、反応過程に含まれる還元型および基質結合型のモデルとして基質アナログであるシアン化物イオン結合型のNRVS測定を行った。
実験:
57Fe を含む合成培地で生育させた緑膿菌から NOR を精製することで、NOR の活性部位に存在する鉄が 57Fe に置換されたものを調製した。試料の精製は、既報に従った[2,3]。精製した試料は、紫外可視吸収測定から、活性部位にヘムが取り込まれていることを確認した。また、NO 還元活性を調べることで、活性のある酵素が精製できていることを確認した。精製標品は、50 mM HEPES buffer pH 7.0、0.05% (w/v) ドデシルマルトシド(DDM)に溶解させた。NRVS スペクトルの測定には、タンパク質としては高濃度(1 mM以上)の試料を必要とするので、精製試料を遠心濃縮により限界まで濃縮したものを酸化型の測定試料とした。
還元型試料の調製は、次の手順で行った。酸化型の試料をゴム栓のできるバイアル瓶に入れた後、真空ポンプにより窒素雰囲気にした。ジチオナイトの粉を別のバイアル瓶に入れて、こちらも真空ポンプにより窒素雰囲気にした。ガスタイトシリンジを用いて窒素雰囲気にした NOR 試料をとり、ジチオナイトの粉が含まれたバイアル瓶に移した。試料が還元されたことを示す茶色から赤色への変化を確認した。還元シアン結合型の試料は、還元型の試料にガスタイトシリンジを用いて高濃度のシアン溶液を加えることで調製した。
それぞれの試料は、ガスタイトシリンジにより NRVS 測定用のセルに導入し、素早く液体窒素で凍結した。凍結試料をクライオスタット中のセルホルダーに設置することでNRVS測定を行った。
NRVS 測定は、BL09XUにおいてタンパク質の NRVS 測定を行う際の標準的な装置配置で行った。すなわち Si975-Si975 の高分解能モノクロメータによって 0.8 meV に分光したX線をクライオスタット中の凍結試料(液体 He 温度)に照射し、APD検出器で核の準位を経た時間遅れの成分だけをカウントする。入射X線のエネルギーを走査することにより NRVS スペクトルを得た。エネルギーの走査範囲は、-20 ~ 80 meV とした。50 ~ 100回程度の積算を行い、NRVS スペクトルを得た。本測定条件では、一回のエネルギー走査に約45分の時間がかかったので、一つのNRVSスペクトルを得るには、2 ~ 3日程度の測定時間が必要であった。
結果および考察:
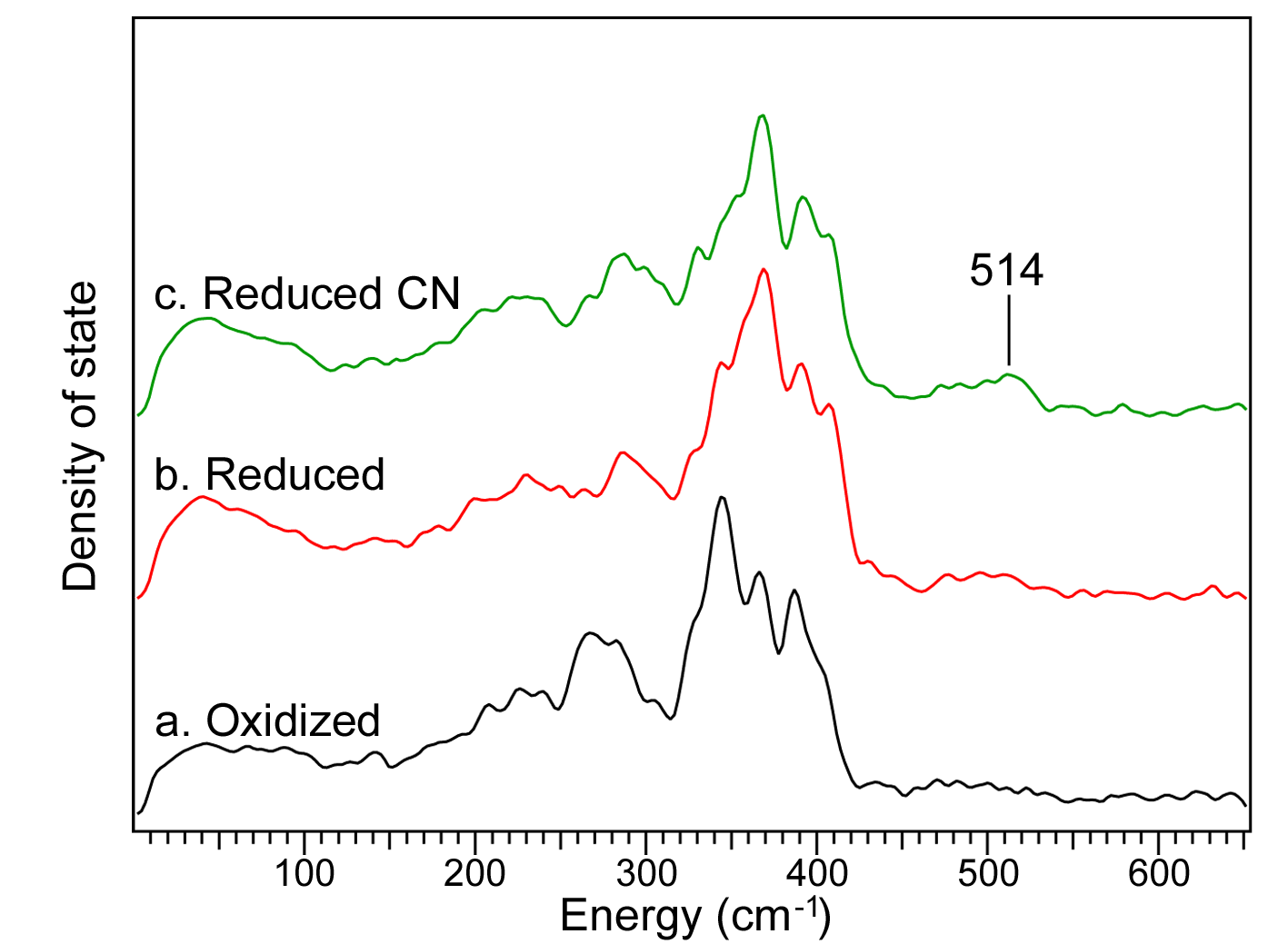
図2に酸化型の試料、還元型および還元シアン結合型 NOR の NRVS スペクトルを示す。還元型およびシアン結合型のスペクトルについても酸化型と同様に、200 ~ 400 cm-1 のエネルギー領域にシグナルが観測された。振動分光法であるラマン分光の結果とあわせて考えると、200 ~ 300 cm-1 に観測されているシグナルは、鉄とヒスチジンの窒素原子間の振動モードに由来すると推定される。また、350 cm-1 近辺のシグナルは、鉄とポルフィリン環ピロール由来の窒素原子間の伸縮振動を反映していると推察される。これらのシグナルがいずれの試料状態でもみられていることから、今回の測定に用いた試料の調製はうまく行えており、NOR が構造を保った状態で NRVS スペクトルの測定が行えていると考えられる。
図2において酸化型と還元型の NRVS スペクトルを比較すると、200 ~ 400 cm-1 にみられるシグナルに違いがみられた。現時点で、この差が何に由来するものかを特定することはできないが、鉄が3価から2価に還元されることで、鉄と配位子間の伸縮振動数に違いが生じていることを示しており、本研究で調製した試料が酸化型とは異なる状態、すなわち還元型になっていることを示唆している。
次に、還元型と還元シアン結合型の NRVS スペクトルを比較すると、200 ~ 400 cm-1 にみられるシグナルには、大きな差がみられなかった。これは、いずれの試料においても鉄は2価の状態をたもっているため、鉄と配位子(ヒスチジンおよびポルフィリン)間の伸縮振動に大きな差がみられなかったものと考えられる。一方で、シアン結合型では、還元型ではみられなかった 514 cm-1 にシグナルが観測された。過去の他のタンパク質でのラマン分光測定の研究から、鉄とシアンの炭素原子間の伸縮振動が 450 cm-1 あたりに観測されるという報告[5]があるので、今回 514 cm-1 に観測されたシグナルは、鉄-CN伸縮振動の可能性がある。しかし、図1に示したように、NOR のシアン結合型のX線結晶構造解析では、活性部位に2つのシアン分子が存在し、それぞれがヘム鉄および非ヘム鉄に結合している。つまり、鉄-CN伸縮振動は2本のシグナルが観測されるはずである。詳細な議論を行うためには、CNの同位体を用いるなどの実験を行い、帰属を正確に行う必要がある。
図2. NORのNRVSスペクトル。aは、酸化型、bは、還元型、cは、還元シアン結合型の試料から得られたスペクトルを示す。測定は、BL09XUで行った。一つのスペクトル測定には、50回以上の積算を行っており、2 ~ 3日間の測定時間を要した。
今後の課題:
本研究では、酸化型 NOR に加えて、還元型および還元シアン結合型の試料に関する測定を行ったが、シグナルの帰属までにはいたらなかった。また結晶構造との不一致もあり、結果の解釈ができていない。今回の実験では、実験当時に構造解析ができていたシアン結合型をターゲットとしたが、一般的に還元シアン結合型は、調製が難しいうえ、ラマン分光をはじめとする分光データが不足している。より安定な配位子結合型である一酸化炭素(CO)結合型では、過去に膨大な研究例があるので、鉄-CO伸縮振動のデータが得られれば、構造に関する議論が進むものと期待できる。
参考文献:
[1] P. Moënne-Loccoz, Nat. Prod. Rep., 24, 610 (2007).
[2] T. Hino, et al., Science, 330, 1666 (2010).
[3] N. Sato, et al., Proteins, 82, 1258 (2014).
[4] R. W. Scheidt, J. Inorg. Biochem., 99, 60 (2005).
[5] T. Tosha et al., SPring-8/SACLA利用研究成果集, 6, 153 (2018).
[6] J. Al-Mustafa et al., J. Biol. Chem., 270, 10449 (1995).
ⒸJASRI
(Received: September 29, 2017; Early edition: February 27, 2018; Accepted: July 3, 2018; Published: August 16, 2018)