Volume6 No.2
SPring-8 Section A: Scientific Research Report
皮膚角層細胞間脂質モデルの確立と赤外吸収特性の評価
Preparation of Lipid Model of Stratum Corneum and Evaluation of Infrared Characteristics
a星薬科大学, b(公財)高輝度光科学研究センター
aHoshi University, bSPring-8/JASRI
- Abstract
-
代表的な脂質を組み合わせて調製した脂質モデルは、脂質組成によって赤外吸収特性が異なった。CH2 面内変角はさみ振動の比較において、皮膚表面温度付近で直方晶の存在を示唆する吸収ピークのスプリットが明確に認められる処方と、皮膚表面より低温ですでにピークが単一となっている処方があった。温度走査に伴う相転移挙動から推定される充填構造の変化は、微量脂質の添加の割合により大きく影響を受ける可能性が示唆された。
Keywords: 皮膚角層、細胞間脂質、ラメラ構造、充填構造、赤外吸収
背景と研究目的:
皮膚は異物侵入や脱水から生体を保護する重要な役割をもっているが、なかでも皮膚の最表面に存在する「角層」と呼ばれる厚さわずか15マイクロメートル程度の薄い膜がその役割の多くの部分を担っている。角層は UCSF のP. M. Elias 教授が提唱した「レンガ・モルタル構造」をとり、「レンガ」に相当するケラチンに満たされた角層細胞の周辺を「モルタル」である細胞間脂質が取り囲んでいる[1]。この細胞間脂質が形成するラメラ構造が、生体を保護する物理的バリアの本体であると考えられている。我々ははこれまでに、細胞間脂質の構造を調べて皮膚に適用する製剤の開発への応用を試みてきた。角層は生体の一部であることから、非常に多くの成分を含んでおり、様々な機器測定で得られる信号は複雑で解析が困難な場合が少なくない。そこで、細胞間脂質の代表的な脂質を選択してモデル脂質系を作成した。これまでにも、細胞間脂質のモデルはいくつか作られてきたが、いずれも細胞間脂質の混合比を単純に模したのみであり、その性質を評価して妥当性を議論するには至っていなかった、そこで我々は実験計画法にもとづいて統計的手法を導入して脂質を組み合わせて細胞間脂質モデルの調製を試みて、それらの特性をX線回折を中心に検討を行うことで、ヒト角層の特性をあらわす妥当なモデルを調製することに成功した。今回の申請では、これまでに得られた細胞間脂質の特性を利用して、モデルの妥当性の評価を行うとともに病態皮膚の状態解析への応用を考える。これまでの実験はX線回折測定が中心であったことから[2-4]、主として構造化した脂質の特性を評価してきたが、赤外吸収特性をあらたなパラメータに加えることにより構造化脂質のみならず液晶化した脂質を含めて包括的に検討することが可能である。
また、皮膚の表面状態が正常皮膚とは異なる病態皮膚においては、実際に患者の角層を使用して実験を行ったとしても、すでに治療のための外用剤の適用が行われている可能性が大きいため、その特徴を明確に解析することは難しいと考えられる。最近、UCSFのUchidaらがアトピー性皮膚炎を発症している角層では、細胞間脂質に含まれている微量セラミドの存在比が、正常皮膚とは異なっていることを見出した[5]。そこで、微量セラミドを正常および病態の存在比で添加したモデル脂質のラメラ構造を含めた微細構造を検討することで、病態皮膚の状態を構造のレベルで議論することができる。これまでに、アトピー性皮膚炎の角層の、とくに充填構造に着目した構造解析の研究例は報告がないため、生体の機能解明に役立つ情報が得られる。また、明らかにした構造を、正常皮膚のモデルの状態へと近づけることができる製剤を考えることで、これまでとまったく異なった新しい製剤開発へのアプローチが可能になると考えられる。
細胞間脂質は、角層質量のおよそ 10%程度に過ぎないため試料量は大変少ない。したがってSPring-8の顕微赤外顕微鏡を利用することで、その赤外吸収特性を詳細に評価できると考えた。
実験方法:
脂質モデルの調製:Table 1に示す組成で、Fig. 1に示した微量脂質を含むすべての脂質をクロロホルム:メタノール混合溶液 (= 2 : 1)に溶解して、最終濃度を 10 mM とした。その後、精製水を添加し、相転移温度以上の温浴下で 30 分間水和させた後に、超音波処理を 5 分間行ったものを脂質モデルとした。顕微赤外分光測定:調製した脂質モデルをKRS5 基板上に滴下し、完全に乾燥させたものを測定試料とした。測定はSPring-8 (BL43IR)においてDSC (MettlerTolnedo 社)を用い 10℃ から 90℃ の範囲で温度走査を行った。顕微鏡にはHYPERION 2000 (Bruker optics)、分光光度計にはVertex 70 (Bruker optics)を用いた。ビームサイズは試料位置で約 10 μm であった。積算回数は 500 回、波数分解能は 2 cm-1 で測定領域は 7500 から 550 cm-1 で行い、解析にはOPUS 6.5 (Bruker Optics)を用いた。得られた赤外吸収曲線は、Origin 8 (OriginLab, MA, USA)を用いて、ガウス関数の重ね合わせによるフィッティングを行い、ピーク位置を求めた。
表1. 細胞間脂質モデルの処方
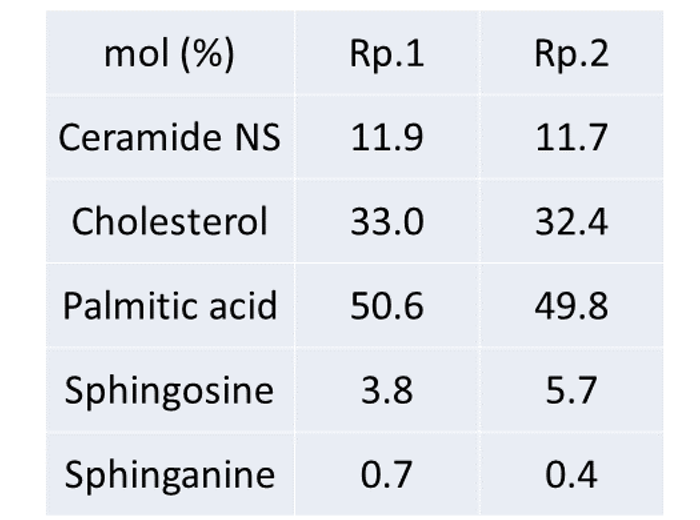
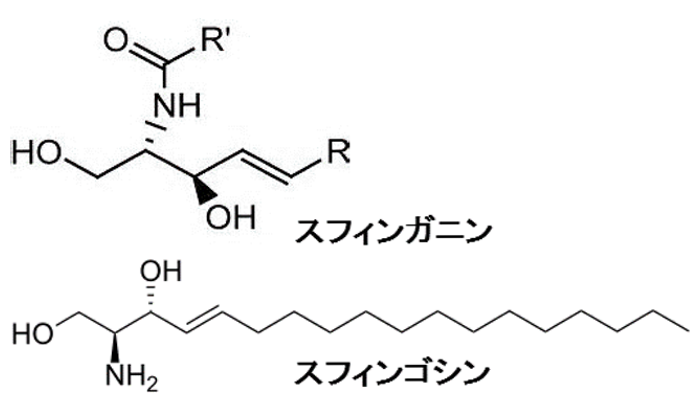
図1. 微量脂質の構造式
結果および考察:
赤外分光では、官能基ごとの吸収ピークを一定の波数域に検出することができる。例えば、脂質モデルの脂肪酸の炭化水素鎖を例にとると、その結合様式だけでも多くの種類が存在するが、それらはそれぞれに特徴的な赤外吸収を示すことが知られている。そのため、観察領域を絞り込むことで分子内の官能基の挙動や相互作用を調べることが可能である。今回は、炭化水素鎖の充填構造の情報が得られるCH2 面内変角はさみ振動領域 (1460~1480 cm-1 )に着目した。
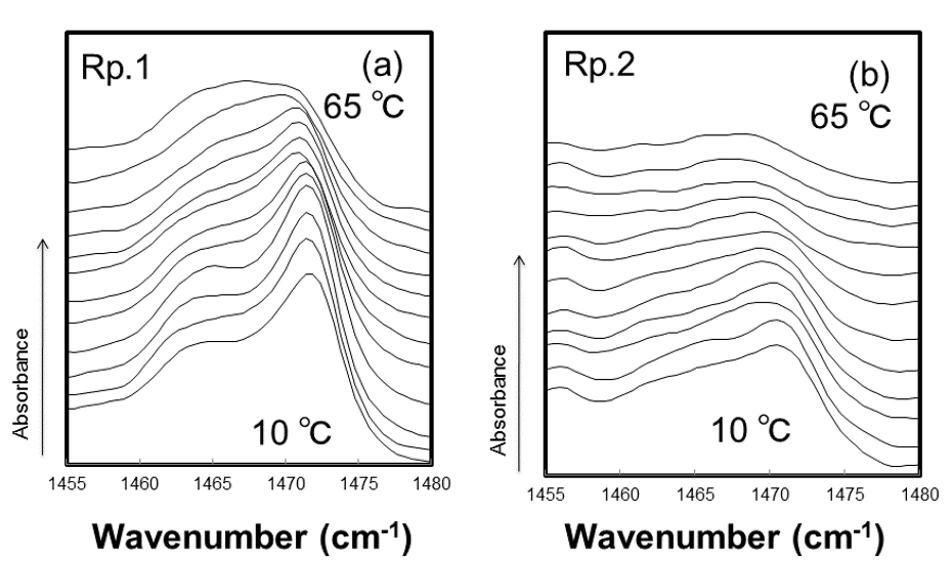
図2. CH2 面内変角はさみ振動の温度走査プロファイル
CH2 面内変角はさみ振動領域におけるRp.1 およびRp.2 の吸収曲線の温度変化を、Fig. 2 (a)およびFig. 2 (b)に示した。Rp.1 およびRp.2 は、正常角層および疾患皮膚の角層細胞間脂質の、とくに微量脂質の組成比に着目した脂質モデルを示している。Rp.1 (Fig. 2 (a))では、測定開始温度から 1463 cm-1 および 1473 cm-1 付近に2つの吸収極大が認められた。これらの吸収極大はヒト角層や脂質モデルでの検討においても同様の吸収波数域に認められており、直方晶の存在を示唆している[6]。これに対してRp.2 (Fig. 3 (b))では、1463 cm-1 の吸収極大が消失し、1472 cm-1 の吸収極大のみが認められる結果となった。過去の報告では、六方晶を示す吸収極大は 1468 cm-1 付近に観察されているが、本研究での測定開始温度の吸収極大の位置は 1472 cm-1 であり、わずかに高波数側への移行が認められた。しかし、その吸収波数域の吸収極大は1つのみであることから、Rp.2 では六方晶が優位な構造をとっていると考察した。Fig. 3 (a)およびFig. 3 (b)には、Rp.1 およびRp.2 の吸収極大の位置の変化を、温度の変化とともに示した。Rp.1 (Fig. 3 (a))では、直方晶の融解温度である40℃ 付近まで2カ所の吸収極大に加えて、高温六方晶の形成に伴うピークが認められ、40℃ を超えると、低波数側に存在する吸収極大が消失した。また、25℃ から40℃ 付近までは吸収極大が3カ所あることから、直方晶と六方晶の共存を示す結果が得られた。ヒト角層におけるCH2 面内変角はさみ振動領域の吸収曲線をみると、28℃ 付近から2つの充填構造が共存する可能性が高く、本研究で得られた結果と一致した。六方晶を示す 1467 cm-1付近の吸収極大は、90℃ までの温度変化に対してはその波数は不変だった。一方、Rp.2 (Fig. 3 (b))では、10℃ で観察された単一の吸収極大は、温度変化に対して波数の変化がほとんどなく、直方晶融解温度でやや低波数側へ移行する傾向が認められたが、ほぼ一定のまま推移した。アトピー性皮膚炎の皮膚では角層中に含有される遊離脂肪酸のうち、短い側鎖のものが優位になっていることが定量的解析から明らかとなっており、短い側鎖の遊離脂肪酸を用いた脂質モデルの検討では、直方晶の形成されない単一の吸収極大を示した。さらに、同じ炭化水素鎖長の脂肪酸でも、不飽和度の違いにより直方晶が形成されないとの報告もある。本研究で用いた2つの微量成分のうち、スフィンガニンは炭素鎖中に二重結合1 つを有しており、直方晶の形成にとって重要な役割を果たすと考えられる。
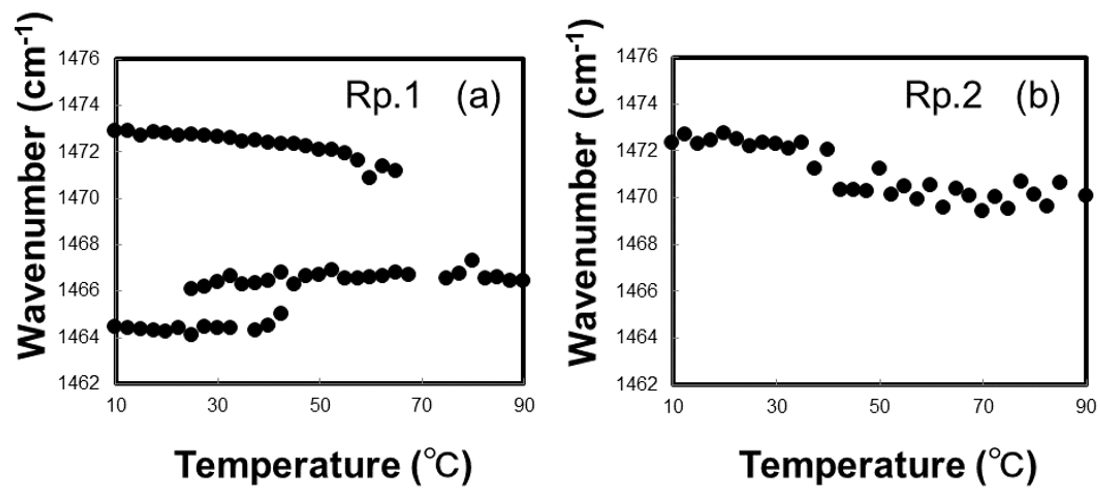
図3. CH3面内変角はさみ振動吸収極大の温度変化
今後の課題:
脂質組成を変化させることにより、赤外吸収特性が異なることを明らかにできたので、さらに、アトピー性皮膚炎や乾癬などの疾患皮膚角層の測定や、治療戦略に役立つ脂質成分の探索に取り組みたいと考える。
参考文献:
[1] P. M.Elias, D. R. Friend, J. Cell. Biol., 65, 180-191 (1975).
[2] S. Utsumi et al, Chem. Pharm. Bull., 64, 1692-1697 (2016).
[3] S. Utsumi, Y. Obata, K. Takayama, J. Drug Del. Sci. Tech., 35, 200-206 (2016).
[4] S. Yoshida et al, Chem. Pharm. Bull., 65, 134-142 (2017).
[5] N. Loiseau et al, J. Dermatol. Sci., 72, 296-303 (2013).
[6] J. Caussin et al, Biochim. Biophys. Acta, 1778, 1472-1482 (2008).
ⒸJASRI
(Received: September 25, 2018; Early edition: February 27, 2018; Accepted: July 3, 2018; Published: August 16, 2018)






