Volume6 No.2
SPring-8 Section A: Scientific Research Report
一酸化窒素還元酵素の反応機構の解明のための核磁気共鳴非弾性散乱実験条件の確立
Establishment of Experimental Condition of Nuclear Resonance Vibrational Spectroscopy for Elucidation of Molecular Mechanism of Nitric Oxide Reductase-catalyzed Reaction
a理化学研究所SPring-8, b兵庫県立大学, c(公財)高輝度光科学研究センター
aRIKEN, SPring-8 Center, bUniversity of Hyogo, cJASRI- Abstract
-
一酸化窒素還元酵素(NOR)は、ヘム鉄と非ヘム鉄からなる複核中心を活性部位にもつ膜結合型の金属酵素であり、2分子の一酸化窒素(NO)を2当量の電子とプロトンを利用し、亜酸化窒素(N2O)に還元する。本研究では、核共鳴非弾性散乱(NRVS)測定によりNORの活性部位の詳細な構造情報を得ることを目的とし、その試料の調製法や測定条件を検討した。
キーワード: 核共鳴非弾性散乱、金属タンパク質、ヘム鉄、非ヘム鉄
背景と研究目的:
一酸化窒素還元酵素(NOR)は、嫌気下で生育する細菌の細胞膜上に存在する酵素で、一酸化窒素(NO)を還元し、亜酸化窒素(N2O)を生成する反応を触媒する。この反応は、脱窒と呼ばれる硝酸から窒素分子を形成する過程のキーステップであり、地球上における窒素原子の循環を考える上で非常に重要なケミカルプロセスである。NORの活性部位は、ヘム鉄と非ヘム鉄から構成される複核中心であり(図1)、そこに2分子の NO が結合し、2当量の電子とプロトンを利用することで N2O が形成される(2NO + 2e- + 2H+ → N2O + H2O)。この反応には、N-N 結合の形成や N-O 結合の開裂といった興味深いケミストリーが含まれており、NORによる NO 還元反応の分子機構は、多くの注目を集めている[1]。我々は、これまでにNORの反応機構の解明を目指した研究に取り組んできており、緑膿菌(Pseudomonas aeruginosa)由来NORの立体構造をX線結晶構造解析により明らかにしてきた[2,3]。しかし、X線結晶構造解析からは、NORの活性中心金属の電子状態に関する情報を得ることは難しく、詳細な反応機構の理解にはいたっていない。
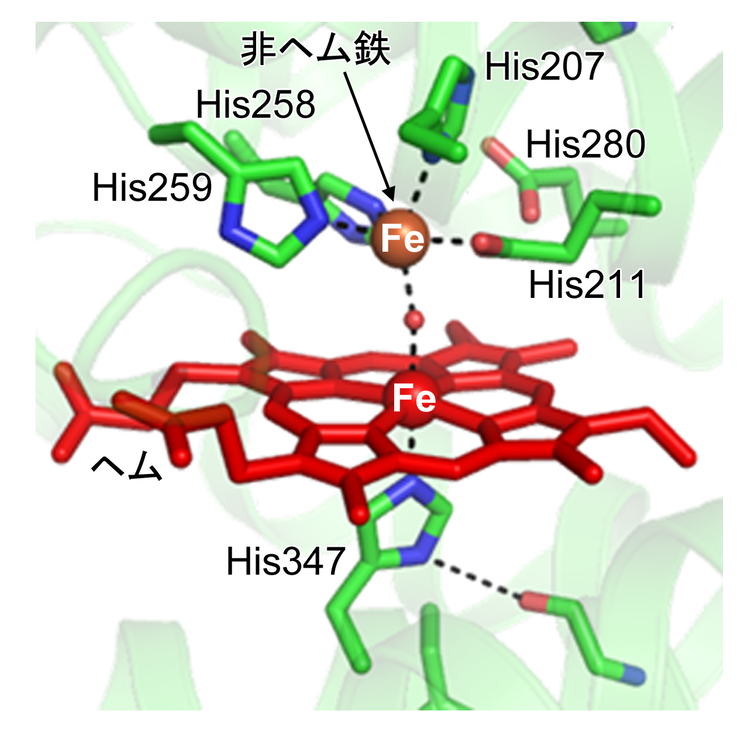
図1. NOR の活性部位の構造[2]。ヘム鉄非ヘム鉄から構成される複核中心において、2分子のNOを還元しN2Oを生成する反応(2NO + 2e- + 2H+ → N2O + H2O)を触媒する。ヘム鉄には、ヒスチジン(His476)が配位しており、非ヘム鉄には、3つのヒスチジン(His258、 His259およびHis207)と1つのグルタミン酸(Glu211)が配位している。また、活性部位には、高度に保存されたグルタミン酸(Glu280)が存在し、酵素機能に重要であると考えられている。
本研究では、NORにおける触媒反応機構の理解のために、活性部位に存在する鉄原子の電子状態や配位構造を詳細に検討することが可能な核共鳴非弾性散乱測定(Nuclear Resonance Vibrational Spectroscopy: NRVS)に注目した。NRVSは、「放射光を利用した振動分光法」であり、57Fe のようなメスバウアー活性な核種を含む試料に応用可能である(メスバウアー効果と分子振動が組み合わさった結果起こる現象)。NRVS測定では、金属酵素の活性中心にある鉄原子を安定同位体である 57Fe に置き換える必要があるが、他の分光法と異なり、鉄原子の状態を問わず、鉄原子が含まれる振動モードを選択的に全て観測することができるという利点がある[4]。本研究では、鉄原子の状態を調べるのに強力な手段であるNRVSの特性を利用し、NORの活性部位を構成する2つの鉄原子(ヘム鉄と非ヘム鉄)の状態や周辺環境が触媒サイクル中にどのように変化するのか調べ、NORの触媒反応機構の解明することを目的とした。
実験:
NRVS測定には、NORの活性部位を構成する鉄原子を安定同位体である 57Fe に置換する必要があったので、57Fe を含む合成培地で生育させた緑膿菌からNORを精製することで、NORの活性部位に存在する鉄が 57Fe に置換されたものを調製した。試料の精製は、既報に従った[2,3]。精製した試料は、紫外可視吸収測定から、活性部位にヘムが取り込まれていることを確認し、NO 還元活性を測定することで、活性のある精製酵素が得られていることを確認した。精製標品は、50 mM HEPES buffer pH 7.0、0.05% (w/v) ドデシルマルトシド(DDM)に溶解させた。NRVSスペクトルの測定には、タンパク質としては高濃度(1 mM 以上)の試料を必要とするので、精製試料を遠心濃縮により限界まで濃縮したものを測定試料とした。
NRVS測定は、BL09XUにおいてタンパク質のNRVS測定を行う際の標準的な装置配置で行った。具体的にはSi975-Si975の高分解能モノクロメータによって 0.8 meV に分光したX線をクライオスタット中の凍結試料(液体He温度)に照射し、APD検出器で核の準位を経た時間遅れの成分だけをカウントした。入射X線のエネルギーを走査することによりNRVSスペクトルを得た。エネルギーの走査範囲に関しては、まずはじめに -20 ~ 100 meV で行い、高エネルギー領域にシグナルがみられなかったので、-20 ~ 80 meV とした。1 mM 以上濃度に濃縮した試料を 40 µL 程度用い、100回程度の積算を行い、NRVSスペクトルを得た。
結果および考察:
本研究では、別々に調製した2つの試料についてNRVS測定を行った。一つ目の試料(試料 i )は、精製試料を遠心濃縮により限界まで(1.5 mM 程度)濃縮したものである。図2(スペクトルa)に示すように、試料 i のNRVSスペクトルは、25 meV にブロードなシグナルを示すのみで、他の金属酵素の例[5,6]と比較して、単純なものであった。測定後の試料を回収・融解し、その状態を確認したところ、試料 i には、NORタンパク質の凝集による沈殿の形成がみられた。つまり、試料 i では、NRVS測定の間、もしくは、試料を凍結・融解した際に、NORが変性・凝集を起こしてしまったため、変性状態のスペクトルを与えたものと推察できる。この原因として、膜タンパク質であるNORの可溶化状態を保つために添加している界面活性剤(DDM)が、試料の濃縮の際に同時に濃縮され、NORの変性を引き起こしたのではないかと考えられた
上記の結果をふまえて、いったん濃縮したNOR試料をゲル濾過にかけて、過剰に濃縮された界面活性剤を除去し、再度濃縮を行うという作業を繰り返すことで、できるかぎり界面活性剤の濃度が高くならないように注意しつつ、試料をできるかぎり濃縮した(試料 ii )。その結果、試料 ii のNRVSスペクトルは、試料の i のものと異なり、20 ~ 60 meV の範囲において複数のシグナルが観測された(2スペクトルb)。これらのシグナルの帰属のためには、より精度の高いスペクトル測定および理論計算が必要となるが、このエネルギー領域には、ヘム鉄および非ヘム鉄とその配位子(アミノ酸)間の振動モードを含んでいるものと考えられる。また、測定後の試料iiを融解したところ、試料 i でみられた沈殿の形成は全く観測されず、試料の変性が起きていないことも確認できた。このように、本研究で用いた試料 ii の調製方法がNORのNRVS測定に、有効であることが示された。また、本実験結果から、NORのNRVSスペクトルを得るには、限界まで濃縮した試料を用いても、最低50回の積算が必要であり、2日程度の測定時間を要することが明らかとなった。
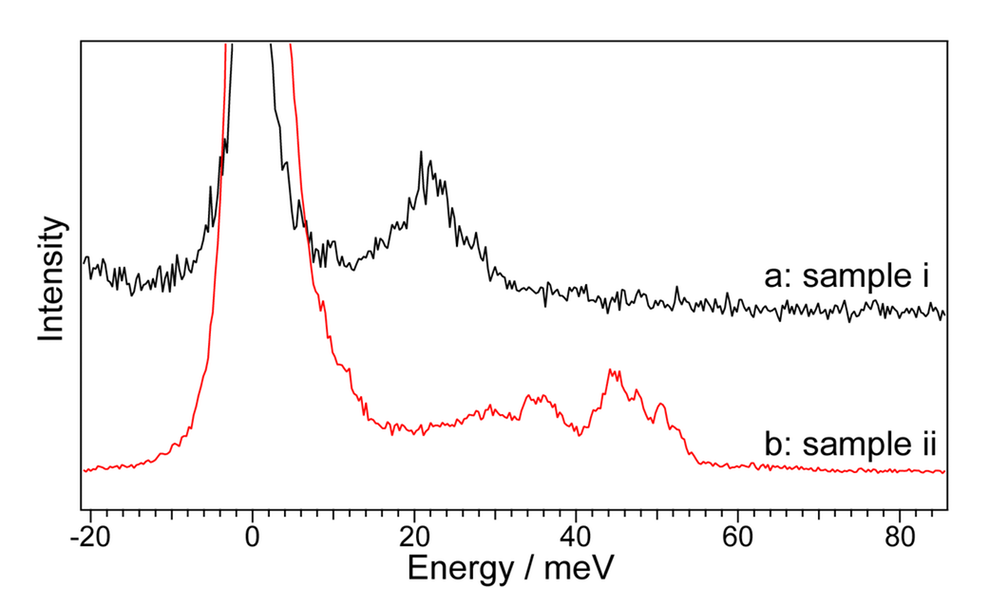
図2. NORのNRVSスペクトル。aは、試料i、bは、試料iiから得られたスペクトルを示す(それぞれの試料の詳細は、本文参照)。測定は、BL09XUで行った。
今後の課題:
本研究は、膜タンパク質の活性中心をNRVSを用いて調べようとしたこれまでに例のない挑戦的な研究である。本研究では、NRVS測定に適した膜タンパク質試料の調製方法の確立にとどまった。本測定において、20 ~ 60 meV の領域にシグナルがみられたが、NRVSにより得られた情報を構造情報として議論するためには、これらのシグナルの帰属が必要となる。NORには、活性部位に存在するヘム鉄と非ヘム鉄に加えて、2つのヘム鉄が含まれるため、これらのシグナルの帰属のために、より質の高いスペクトル測定および理論計算との組み合わせが課題となる。また、本研究で用いた休止状態の酵素だけではなく、外部配位子(基質)結合型NORのNRVSスペクトル測定を行えば、外部配位子の同位体を用いることで、その配位子由来のシグナルが帰属でき、NORの反応機構の理解につながる成果が得られると期待できる。
参考文献:
[1] P. Moënne-Loccoz, Nat. Prod. Rep., 24, 610 (2007)
[2] T. Hino, et al., Science, 330, 1666 (2010)
[3] N. Sato, et al., Proteins, 82, 1258 (2014)
[4] R. W. Scheidt, J. Inorg. Biochem. 99, 60 (2005)
[5] S. D. Wang, et al., Nature, 499, 320 (2013)
[6] D. Mitra, et al., Biochemistry, 50, 5220 (2011)
ⒸJASRI
(Received: March 23, 2017; Early edition: January 31, 2018; Accepted: July 3, 2018; Published: August 16, 2018)






