Volume6 No.1
SPring-8 Section A: Scientific Research Report
挿入変異が引き起こすYFPの構造変化
Structure Change of YFP Induced by Insertion Mutations
a大阪大学大学院理学研究科, b理化学研究所 QBiC
aGraduate School of Science, Osaka University, bRIKEN QBiC
- Abstract
-
YFPは発色団近傍の7番目のβ鎖にアミノ酸を挿入すると、蛍光の圧力応答性が著しく向上した変異蛍光タンパク質が得られるが圧力応答性が生じる原因は不明である。本研究では、系統的に挿入変異を行ったYFPについて様々な圧力下での構造解析を行い、蛍光圧力応答の構造基盤を明らかにすることを目的として、加圧セル材のテストとYFP1残基挿入変異体YFP-Qの構造解析を行った。
キーワード: YFP、圧力応答、結晶構造解析
背景と研究目的:
GFPの変異体であるYFP (黄色蛍光タンパク質) は、その蛍光の明るさや吸収蛍光波長特性を生かしてFRETセンサーやマーカー分子として、細胞内の状態を調べるために広く用いられている。
最近、我々はYFPの発色団近傍の7番目のβ鎖の、144番目のアスパラギンと145番目のチロシンの間にアミノ酸を挿入すると、圧力、pH、イオン濃度変化に対する蛍光応答性が劇的に変化すること、特に蛍光の圧力応答性が著しく向上した変異蛍光タンパク質を作成することに成功した[1]。これらYFP挿入変異体の蛍光スペクトルをさまざまな圧力下で調べたところ、0.65 MPa の圧力変化であっても蛍光により検出可能であることを見出した。従って、この変異体をベースにして、さらに変異を導入し改良することで、細胞内の圧力や圧力変化を様々なレベルで測定することができる「生体分子圧力センサー」の創成が可能になると考えられる。また、1残基挿入変異体の中に、周囲の蛋白質濃度に応じて蛍光応答が変化するものも見出された[2]。しかし、挿入変異体でこのような圧力応答性が生じる原因は未だ不明である。そこで、我々は低圧から高圧までの様々な圧力下で種々の挿入変異体の結晶構造を高分解能で解析し、各圧力での蛍光スペクトル測定結果と合わせて解釈することで蛍光圧力応答を引き起こす構造基盤を明らかにすることを目指した研究を進めている。圧力下での蛋白質結晶のX線回折測定にはダイヤモンドアンビルセルが用いられる[3]。しかし、ダイヤモンドアンビルセルは 100 MPa 以上の高圧測定には適しているが特定の圧力に調節することが難しく、低圧から高圧までの各点での測定を効率よく行うには問題がある[4]。一方で、100 MPa 以下の圧力に適した測定用の加圧セルは存在しないため、この領域の圧力で測定可能な加圧セルの作成に取り組んでいる。本実験では、YFP1残基挿入変異体YFP-Qを用いてX線回折測定を行い、加圧セル候補材料のテストを行うと共にYFP-Qの構造解析を行った。
実験:
ガスクロマトグラフィーやHPLCに用いられるキャピラリは 100 MPa 程度の耐圧性を持つ。そこで、これらに用いられるポリイミドコーティングした耐圧性のフューズドシリカチューブにYFP変異体結晶を入れて常圧で回折データを収集し、実験条件の検討と問題点の抽出を行った。キャピラリは、内径 0.53 mm 外径 0.66 mm と内径 0.2 mm 外径 0.35 mm のものを用いた。YFP-Q結晶は sitting drop 蒸気拡散法により作成し、太さ 30 – 60 µm 程度の針状結晶を実験に用いた。開発している器具は水圧により加圧するため、キャピラリ中は結晶化に用いたリザーバー溶液で満たした。各結晶は、リザーバー溶液と同じ組成のドロップに移し、キャピラリ内に吸い上げた。また、液中測定であることから測定中に結晶が動くことを想定し、一部の結晶はろ紙の繊維と共に吸い上げて結晶と絡ませて固定することを試みた。回折測定は Rayonix 社製 MX225HE CCD 検出器を用い、室温下、1フレームあたりの回転角 1° で露光時間を変えて行った。波長は 1 Å に固定し、結晶が太さ 30 – 60 µm 程度の針状晶であったことから、ビームサイズは 60 µm × 60 µm に設定した。
結果および考察:
溶液で満たしたキャピラリ中の結晶に対して室温で測定するため、測定中の結晶のスリップ、キャピラリおよびコーティング材の吸収・散乱によるS/N比の低下、溶液の吸収・散乱によるS/N比の低下、X線照射ダメージについて評価した。
結晶のスリップについては、回折データの処理結果から、内径 0.2 mm、内径 0.53 mm のどちらのキャピラリを使用した場合も、ろ紙の繊維の有無に関わらずYFP変異体結晶が通常のセンタリング操作や測定中にキャピラリ内で動くことはなかった。YFP変異体は太さ 60 µm 以下の針状晶であり、キャピラリの軸方向に沿って内壁に付着していたことがスリップを防いだと考えられる。
次に露出時間を1秒から60秒まで様々に変えて回折測定を行った。その結果、露光時間 30秒で 2 Å を超える回折を確認できた。また、内径 0.2 mm と内径 0.53 mm からの結晶の回折を比較すると、溶液量が少ない内径 0.2 mm の方が予想通りBackgroundが低かった。そこで、内径 0.2 mm のキャピラリに詰めたYFP-Q結晶に対して露光時間 3 0秒と露光時間 60 秒で180フレームの回折強度データを収集した。回折データはプログラムMOSFLMおよびAimlessで処理した。露光時間 60 秒では50フレームほどで深刻な損傷を受け、回折分解能が著しく低下したが、露光時間 30 秒のときは回折分解能の大幅な低下は見られず、2.0 Å 分解能の回折強度データを収集することができた。回折強度データ統計値を表1に示す。格子定数は a = 51.3 Å、b = 62.6 Å、c = 68.9 Å、空間群は P212121 であった。以上のことから、内径 0.2 mm の耐圧性フューズドシリカチューブは加圧セルに用いることが可能であることが実証できた。
表1. 回折強度データおよび精密化の統計値(YFP-Q)
| Resolution (Å) | 41.4-2.00 (2.05-2.00) | Observed reflections | 108643 (7990) | Unique reflections | 15595 (1133) | Means I/s(I) | 15.7 (7.0) | Completeness (%) | 100.0 (100.0) | Multiplicity | 7.0 (7.1) | Rmerge# (%) | 9.5 (26.2) | R/Rfree | 15.7 (21.1) | Number of atoms | protein | 1837 | water | 222 | R.m.s. deviations | Bond length (Å) | 0.020 | Bond angle (°) | 2.05 |
Rmerge# = ΣhklΣi |Ii(hkl)-<I(hkl)>|/ΣhklΣiIi(hkl), where Ii(hkl) is an individual intensity measurement and <I(hkl)> is the average intensity for this reflection.

図1. 室温耐圧キャピラリ YFP-Q 結晶の回折像
YFP-Qの構造は未解明であったため、この回折データを用いて、プログラム Phenix による分子置換法により構造解析を行った。サーチモデルにはYFP-Gの構造(3W1C)を用いた。分子モデルの修正には Coot、精密化には Refmac5 を用いた。精密化の統計値を表1に示す。YFP-Qの構造はYFP-Gの構造と比較すると、7番目のβ鎖の構造が大きく変化していた(図2)。YFPはβバレル構造をとるが、Y145とN146の側鎖のバレルに対する向きが逆転していた。この変化が挿入変異による多様な蛍光応答変化と対応していると考えられる。
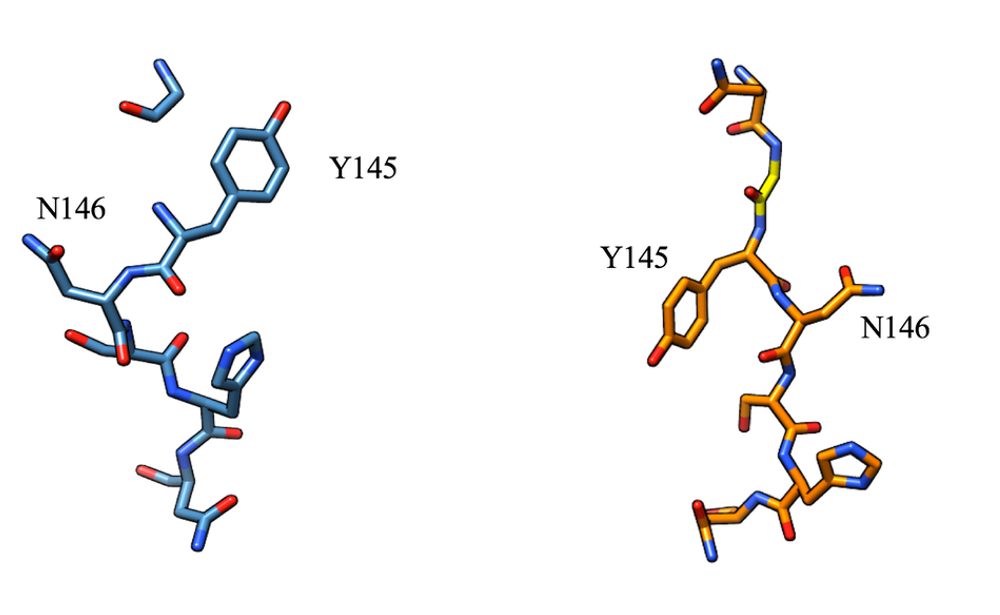
図2. YFP-Q(左)と YFP-G(右)のβ7構造
YFP-G で挿入した Gly は黄色で表示。YFP-Q で挿入した Gln(Y145 の一つ手前)は密度が乱れていたため、モデルを構築していない。
今後の課題:
今回の実験により、市販の耐圧性ポリイミドコーティング-フューズドシリカチューブを用いて、解析に十分なデータを収集できることがわかった。また、内径 0.2 mm の液中測定で30秒露光であれば、2.0 Å 分解能で明瞭なダメージを生じることなくデータ収集することができた。しかし、現在のセルは加圧ポンプから切り離すと 30 MPa 程度でもバルブ接合部から徐々にリークが生じて圧力が下がるため、様々な圧力下での解析ためには加圧セルの改良が必要である。現在、加圧ポンプと直接つないだ状態で測定できるセルの作成を進めている。また、YFP-Qの構造の違いが明らかになった。今後、他の変異体の構造解析と結晶からの蛍光スペクトルの測定を進め、構造と蛍光スペクトルの関係を明らかにしていく必要がある。
参考文献:
[1] T. Watanabe et al, PLoS One. 8, e73212 (2013).
[2] T. Morikawa et al, Sci Rep. 6, 22342 (2016).
[3] T. Nagae et al, Acta Crystallgr. D. 68, 300-309 (2012).
[4] N. Watanabe, Subcell Biochem. 72, 677-686 (2015).
ⒸJASRI
(Received: September 25, 2017; Early edition: November 24, 2017; Accepted: December 18, 2017; Published: January 25, 2018)






